
- •Практикум
- •Модуль 1. Вуглеводні та їх похідні, що містять атоми галогенів, гідроксильні та карбонільні групи практичні заняття
- •Лабораторні заняття
- •Самостійна робота студента
- •Література Основна
- •Змістовий модуль 1. Вуглеводні та їх галогенопохідні практична робота №1
- •I. Тестові завдання
- •Завдання для самостійного розв’язання:
- •III. Вправи за темою "Добування та властивості алканів" Приклад розв’язання:
- •Завдання для самостійного розв’язання:
- •Метан а в с бутан.
- •IV. Розв’язання задач" Приклади розв’язання:
- •Кількість речовини Карбону, що міститься в спаленому зразку вуглеводню, дорівнює:
- •Відповідь:масова частка виходу продукту нітрометану дорівнює 85%.
- •Особливості конспектування і вимоги до конспекту
- •I. Тестові питання
- •I. Тестові завдання
- •Завдання для самостійного розв’язання:
- •III. Вправи за темою "Добування та властивості алкенів" Приклад розв’язання:
- •Ця реакція використовується для якісного і кількісного визначення сполук, які містять подвійний зв’язок між атомами Карбону.
- •Завдання для самостійного розв’язання:
- •Хлорометанетан а етен 1,2-дибромоетан.
- •IV. "Розв’язання задач" Приклади розв’язання:
- •Самостійна робота №2. Алкадієни. Загальна характеристика. 1,3-Бутадієн. Ізопрен. Застосування 1,3-бутадієну та ізопрену
- •I. Тестові завдання
- •Завдання для самостійного розв’язання:
- •III. Вправи за темою “Добування та властивості алкінів” Приклад розв’язання:
- •Завдання для самостійного розв’язання:
- •IV. “Розв’язання задач” Приклади розв’язання:
- •Згідно рівнянням (I) і (II):
- •Практична робота №4
- •I. Тестові завдання
- •Завдання для самостійного розв’язання:
- •III. Вправи за темою “Добування та властивості аренів” Приклад розв’язання:
- •Завдання для самостійного розв’язання:
- •IV. “Розв’язання задач” Приклади розв’язання:
- •Самостійна робота №3. Окиснення гомологів бензену. Багатоядерні арени.
- •Лабораторна робота № 1
- •Дослід 1. Добування хлороформу з хлоралгідрату
- •Дослід 2. Добування йодоформу
- •Дослід 3. Якісне визначення галогенів (проба Бейльштейна)
- •Література
- •Змістовий модуль 2. Гідроксильні похідні вуглеводнів та карбонільні сполуки лабораторна робота № 2
- •Дослід 1. Взасмодія етанолу з металічним натрієм
- •Література
- •Самостійна робота №4. Багатоатомні спирти. Загальна характеристика. Окремі представники: етиленгліколь та гліцерин, їх ідентифікація в медицині.
- •Лабораторна робота № 3
- •Дослід 1. Дія ферум (III) хлориду на одно- та багатоатомні феноли
- •Дослід 2. Реакція конденсації фенола з реактивом Маркі
- •Дослід 3. Осадження білка фенолом
- •Література
- •Самостійна робота №6.Багатоатомні феноли. Пірокатехін. Резорцин. Гідрохінон. Пірогалол
- •Лабораторна робота № 4
- •Дослід 1
- •Дослід 4 Окиснення формальдегіду купрум (II) гідроксидом в лужному середовищі (проба Троммера)
- •Дослід 5
- •Модуль 2. Органічні сполуки, що містять карбоксильні групи, атоми Нітрогену; гетерофункціональні та гетероциклічні сполуки лабораторні заняття
- •Самостійна робота студента
- •Література Основна
- •Додаткова
- •Змістовий модуль 3 лабораторна робота № 5
- •Дослід 1. Відношення карбонових кислот до дії окисників
- •Дослід 2. Підтвердження наявності альдегідної групи в молекулі форміатної кислоти
- •Дослід 3. Розчинність бензенової кислоти у лугах
- •Дослід 4. Якісні реакції на ацетат- та бензоат-іони
- •Дослід 5. Возгонка бензенової кислоти (“зимовий сад”)
- •Література
- •Лабораторна робота № 6
- •Дослід 1. Доказ наявності двох карбоксильних груп у молекулі оксалатної кислоти (одержання калієвих солей)
- •Дослід 2. Якісна реакція на оксалат-іон
- •Лабораторна робота № 7
- •Дослід 1. Утворення нітрату сечовини
- •Дослід 2. Гідроліз сечовини
- •Дослід 3. Утворення та виявлення біурету
- •Література
- •Дикарбонові кислоти. Щавлева кислота
- •Дослід 2. Лігнінова проба
- •Дослід 3. Окиснення аніліну
- •Література
- •Завдання для котролю знань
- •Лабораторна робота № 9
- •Дослід 1. Доказ будови тартратної кислоти
- •Дослід 2. Розкладання цитратної кислоти під дією концентрованої сульфатної кислоти
- •Дослід 3. Визначення лактатної кислоти в молочній сироватці
- •Література
- •Завдання для котролю знань
- •Лабораторна робота № 10
- •Дослід 1. Розчинність саліцилової кислоти у воді, спирті, лугах
- •Дослід 2. Доведення наявності фенольного гідроксилу в саліциловій кислоті
- •Дослід 3. Гідроліз ацетилсаліцилової кислоти та фенілсаліцилату (салолу)
- •Література
- •Самостійна робота №10.Фенолокислоти. Будова фенолокислот. Саліцилова кислота: будова, хімічні властивості. Фізіологічний вплив на організм людини. Ацетилсаліцилова кислота. Фенілсаліцилат
- •I. Тестові питання
- •II. Вправи для розв’язання
- •Самостійна робота №11.Поняття про пептиди та білки. Структури білків
- •Дослід 2. Відсутність відновлючої здатності у сахарози
- •Дослід 3. Кислотний гідроліз крохмалю
- •Література
- •Завдання для котролю знань
- •Самостійна робота №12.Вуглеводи.Поняття про полісахариди
- •I. Тестові питання
- •II. Вправи для розв’язання
- •II. Вправи для розв’язання
- •I. Тестові питання
- •II. Вправи для розв’язання
- •71. Укажіть структурну формулу малонової кислоти:
- •107. Укажіть назву органічної сполуки, яка належить до дисахаридів:
- •120. Укажіть назву органічної сполуки, яка належить до пятичленних гетероциклів з двома гетероатомами:
- •141. Установіть відповідність між хімічними формулами та класами органічних сполук:
- •161. Установіть послідовність розташування гомологів у гомологічному ряді одноосновних насичених карбонових кислот:
Самостійна робота №10.Фенолокислоти. Будова фенолокислот. Саліцилова кислота: будова, хімічні властивості. Фізіологічний вплив на організм людини. Ацетилсаліцилова кислота. Фенілсаліцилат
I. Тестові питання
1. Укажіть клас органічних сполук, до якого відноситься речовина, якій відповідає наступна структурна формула:
а) феноли;
б) фенолокислоти;
в) спирти;
г) спиртокислоти.
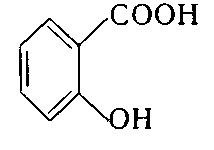
2. Укажіть структурну формулу фенолокислоти:
а) 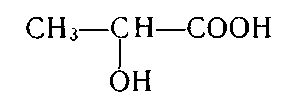 ; б)
; б) 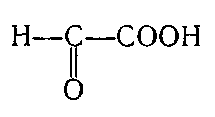 ;
;
в) 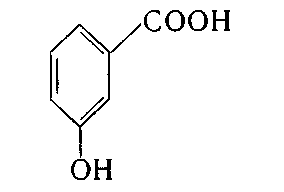 ; г)
; г)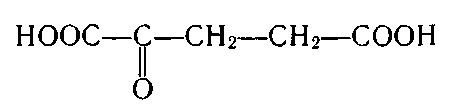 .
.
3. Укажіть структурну формулу саліцилової кислоти:
а) 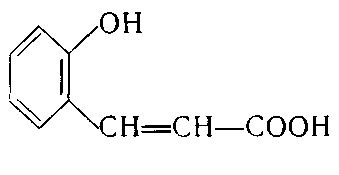 ; б)
; б) 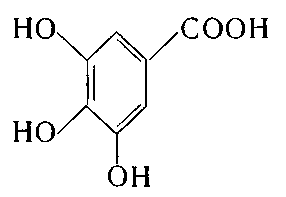 ;
;
в) 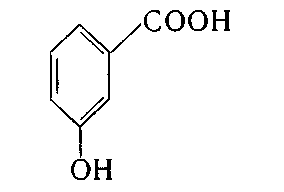 ; г)
; г)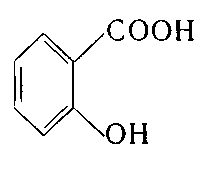 .
.
4. Укажіть структурну формулу галової кислоти:
а) ![]() ; б)
; б) 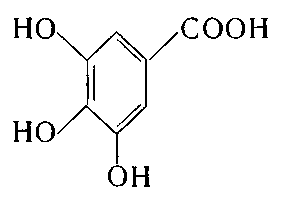 ;
;
в)  ; г)
; г)![]() .
.
5. Укажіть хімічну формулу речовини, з якою саліцилова кислота реагує за участю фенольного гідроксилу:
а) HCl;
б) NH3;
в) FeCl3;
г) PCl5.
II. Вправи для розв’язання
1. Добудьте саліцилову кислоту з відповідного нітрилу та напишіть рівняння реакцій саліцилової кислоти з:
а) NaHCO3 (H2O);
б) CH3OH (H+);
в) PCl5.
2. Добудьте саліцилову кислоту з відповідного нітрилу та напишіть рівняння реакцій саліцилової кислоти з:
а) NaOH (H2O);
б) CH3OH (H+);
в) HNO3 (H2SO4).
3. На прикладі саліцилової кислоти охарактеризуйте кислотний характер фенолокислот. Наведіть приклади реакцій, які підтверджують, що саліцилова кислота – біфункціональна сполука. Якою реакцією можна підтвердити наявність фенольного гідроксилу в молекулі саліцилової кислоти.
Самостійна робота №11.Поняття про пептиди та білки. Структури білків
I. Тестові питання
1. Укажіть скільки різних дипептидів можна добути, використовуючи тільки гліцин та феніламін:
а) один;
б) два;
в) три;
г) чотири.
2. Укажіть скільки пептидних зв’язків входять до складу молекули тетрапептиду:
а) один;
б) два;
в) три;
г) чотири.
3. Пептиди утворюються внаслідок реакцій:
а) дегідратації;
б) полімеризації;
в) поліконденсації;
г) співполімеризації.
4. Скільки різних дипептидів можна отримати, використовуючи тільки гліцин та фенілаланін:
а) 1;
б) 2;
в) 3;
г) 4.
5. Які твердження відносно будови та властивостей білка справедливі:
а) первинна структура послідовність -амінокислотних ланцюгів в лінійному поліпептидному ланцюзі;
б) продукт реакції поліконденсації -амінокислот;
в) при гідролізі утворюють суміш різних -амінокислот;
г) гемоглобін білок з четвертинною структурою.
II. Вправи для розв’язання
1. Які сполуки називають білками?
2. Що називають первинною структурою білка? Складіть схему синтезу дипептиду -амінопропіонової кислоти.
3. Що називають вторинною структурою білка? Складіть схему синтезу дипептиду амінооцтовової кислоти.
4. Які білки називаються гормонами? Як здійснюється синтез білків в організмі?
5. Наведіть реакції осадження білків. Які кольорові реакції на білки Ви знаєте? Яким зв’язком зв’язані залишки амінокислот у білковій молекулі?
Змістовий модуль 5
ЛАБОРАТОРНА РОБОТА № 11
Тема роботи: Якісні реакції на вуглеводи: проба Толленса, проба Троммера, реакція з реактивом Фелінга. Відсутність відновлючої здатності у сахарози. Кислотний гідроліз крохмалю.
Мета роботи: Експериментально здійснити зазначені досліди.
Дослід 1. Якісні реакції на вуглеводи: проба Толленса, проба Троммера, реакція з реактивом Фелінга
Виконання:
1. У пробірку помістіть 1 краплю 0,2 Н розчину аргентум нітрату та 2 краплі 2 Н розчину натрій гідроксиду. До розчину, що утворився, прилийте (по краплях) 3-4 краплі 2 Н розчину амоніаку до повного розчинення аргентум гідроксиду, що утворився раніше.
До прозорого безбарвного амоніачного розчину аргентум гідроксиду, що утворився, додайте 1-2 краплі 0,5 % розчину глюкози. Суміш підігрійте на полум’ї пальника до початку побуріння розчину. Потім нагрівання припиніть (реакція іде без нагрівання). Запишіть спостереження.
2. А) У пробірку помістіть 1 краплю 0,5 % розчину глюкози та 6 крапель 2 Н розчину NaOH. До розчину, що утворився, прилийте 1 краплину 0,2 Н розчину CuSO4. Що спостерігається? Добутий розчин збережіть для наступного досліду.
Б) До лужного синього розчину з попереднього досліду, додайте декілька крапель води до повного розчинення можливого надлишку Си(ОН)2, що не розчинився. Потім пробірку обережно нагрійте до кипіння, тримаючи похило, на полум’ї пальника. Нагрівайте лише верхню частину рідини, залишаючи нижню для контролю. Що ви при цьому спостерігаєте?
3. Феліногва рідина: розчин А ‑ CuSO4 у водному розчині; розчин Б ‑ калій-натрій виннокислий у воднолужному розчині. У пробірку помістіть 2 краплі розчину А та 2 краплі розчину Б. До темно синьої рідини, що утворилася, додайте 2-3 краплини 5 % розчину глюкози та нагрійте пробірку до кипіння. Що спостерігається? Запишіть рівняння реакції.
Завдання:
Складіть рівняння відповідних реакцій.
