
- •Практикум
- •Модуль 1. Вуглеводні та їх похідні, що містять атоми галогенів, гідроксильні та карбонільні групи практичні заняття
- •Лабораторні заняття
- •Самостійна робота студента
- •Література Основна
- •Змістовий модуль 1. Вуглеводні та їх галогенопохідні практична робота №1
- •I. Тестові завдання
- •Завдання для самостійного розв’язання:
- •III. Вправи за темою "Добування та властивості алканів" Приклад розв’язання:
- •Завдання для самостійного розв’язання:
- •Метан а в с бутан.
- •IV. Розв’язання задач" Приклади розв’язання:
- •Кількість речовини Карбону, що міститься в спаленому зразку вуглеводню, дорівнює:
- •Відповідь:масова частка виходу продукту нітрометану дорівнює 85%.
- •Особливості конспектування і вимоги до конспекту
- •I. Тестові питання
- •I. Тестові завдання
- •Завдання для самостійного розв’язання:
- •III. Вправи за темою "Добування та властивості алкенів" Приклад розв’язання:
- •Ця реакція використовується для якісного і кількісного визначення сполук, які містять подвійний зв’язок між атомами Карбону.
- •Завдання для самостійного розв’язання:
- •Хлорометанетан а етен 1,2-дибромоетан.
- •IV. "Розв’язання задач" Приклади розв’язання:
- •Самостійна робота №2. Алкадієни. Загальна характеристика. 1,3-Бутадієн. Ізопрен. Застосування 1,3-бутадієну та ізопрену
- •I. Тестові завдання
- •Завдання для самостійного розв’язання:
- •III. Вправи за темою “Добування та властивості алкінів” Приклад розв’язання:
- •Завдання для самостійного розв’язання:
- •IV. “Розв’язання задач” Приклади розв’язання:
- •Згідно рівнянням (I) і (II):
- •Практична робота №4
- •I. Тестові завдання
- •Завдання для самостійного розв’язання:
- •III. Вправи за темою “Добування та властивості аренів” Приклад розв’язання:
- •Завдання для самостійного розв’язання:
- •IV. “Розв’язання задач” Приклади розв’язання:
- •Самостійна робота №3. Окиснення гомологів бензену. Багатоядерні арени.
- •Лабораторна робота № 1
- •Дослід 1. Добування хлороформу з хлоралгідрату
- •Дослід 2. Добування йодоформу
- •Дослід 3. Якісне визначення галогенів (проба Бейльштейна)
- •Література
- •Змістовий модуль 2. Гідроксильні похідні вуглеводнів та карбонільні сполуки лабораторна робота № 2
- •Дослід 1. Взасмодія етанолу з металічним натрієм
- •Література
- •Самостійна робота №4. Багатоатомні спирти. Загальна характеристика. Окремі представники: етиленгліколь та гліцерин, їх ідентифікація в медицині.
- •Лабораторна робота № 3
- •Дослід 1. Дія ферум (III) хлориду на одно- та багатоатомні феноли
- •Дослід 2. Реакція конденсації фенола з реактивом Маркі
- •Дослід 3. Осадження білка фенолом
- •Література
- •Самостійна робота №6.Багатоатомні феноли. Пірокатехін. Резорцин. Гідрохінон. Пірогалол
- •Лабораторна робота № 4
- •Дослід 1
- •Дослід 4 Окиснення формальдегіду купрум (II) гідроксидом в лужному середовищі (проба Троммера)
- •Дослід 5
- •Модуль 2. Органічні сполуки, що містять карбоксильні групи, атоми Нітрогену; гетерофункціональні та гетероциклічні сполуки лабораторні заняття
- •Самостійна робота студента
- •Література Основна
- •Додаткова
- •Змістовий модуль 3 лабораторна робота № 5
- •Дослід 1. Відношення карбонових кислот до дії окисників
- •Дослід 2. Підтвердження наявності альдегідної групи в молекулі форміатної кислоти
- •Дослід 3. Розчинність бензенової кислоти у лугах
- •Дослід 4. Якісні реакції на ацетат- та бензоат-іони
- •Дослід 5. Возгонка бензенової кислоти (“зимовий сад”)
- •Література
- •Лабораторна робота № 6
- •Дослід 1. Доказ наявності двох карбоксильних груп у молекулі оксалатної кислоти (одержання калієвих солей)
- •Дослід 2. Якісна реакція на оксалат-іон
- •Лабораторна робота № 7
- •Дослід 1. Утворення нітрату сечовини
- •Дослід 2. Гідроліз сечовини
- •Дослід 3. Утворення та виявлення біурету
- •Література
- •Дикарбонові кислоти. Щавлева кислота
- •Дослід 2. Лігнінова проба
- •Дослід 3. Окиснення аніліну
- •Література
- •Завдання для котролю знань
- •Лабораторна робота № 9
- •Дослід 1. Доказ будови тартратної кислоти
- •Дослід 2. Розкладання цитратної кислоти під дією концентрованої сульфатної кислоти
- •Дослід 3. Визначення лактатної кислоти в молочній сироватці
- •Література
- •Завдання для котролю знань
- •Лабораторна робота № 10
- •Дослід 1. Розчинність саліцилової кислоти у воді, спирті, лугах
- •Дослід 2. Доведення наявності фенольного гідроксилу в саліциловій кислоті
- •Дослід 3. Гідроліз ацетилсаліцилової кислоти та фенілсаліцилату (салолу)
- •Література
- •Самостійна робота №10.Фенолокислоти. Будова фенолокислот. Саліцилова кислота: будова, хімічні властивості. Фізіологічний вплив на організм людини. Ацетилсаліцилова кислота. Фенілсаліцилат
- •I. Тестові питання
- •II. Вправи для розв’язання
- •Самостійна робота №11.Поняття про пептиди та білки. Структури білків
- •Дослід 2. Відсутність відновлючої здатності у сахарози
- •Дослід 3. Кислотний гідроліз крохмалю
- •Література
- •Завдання для котролю знань
- •Самостійна робота №12.Вуглеводи.Поняття про полісахариди
- •I. Тестові питання
- •II. Вправи для розв’язання
- •II. Вправи для розв’язання
- •I. Тестові питання
- •II. Вправи для розв’язання
- •71. Укажіть структурну формулу малонової кислоти:
- •107. Укажіть назву органічної сполуки, яка належить до дисахаридів:
- •120. Укажіть назву органічної сполуки, яка належить до пятичленних гетероциклів з двома гетероатомами:
- •141. Установіть відповідність між хімічними формулами та класами органічних сполук:
- •161. Установіть послідовність розташування гомологів у гомологічному ряді одноосновних насичених карбонових кислот:
Згідно рівнянням (I) і (II):
(СаС2) = (С2Н2) = (Ag2C2) = 0,069 моль.
3. Обчислюємо масу СаС2 у зразку технічного карбіду:
m(СаС2) = (СаС2)·М(СаС2) = 0,069 моль·64 г/моль = 4,416 г.
4. Масова частка СаС2 у технічному карбіді становить:
(СаС2) = m(СаС2)·100%/m(карбіду) = 4,416·100%/6 = 73,6%.
Відповідь: масова частка СаС2 у технічному карбіді становить 73,6%.
Завдання для самостійного розв’язання:
1. 6,8 г ацетиленового вуглеводню повністю прореагувало з 4,48 л водню (нормальні умови). Визначте молекулярну формулу вуглеводню, складіть структурні формули ізомерів.
2. 2,7 г ацетиленового вуглеводню повністю прореагувало з 2,24 л гідроген броміду (нормальні умови). Визначте молекулярну формулу вуглеводню, складіть структурні формули ізомерів.
3. Визначте об’єм газу (нормальні умови), що виділяється при обробці водою технічного кальцій карбіду масою 74 г, що місить 15% (за масою) інертних домішок.
4. Визначте масову частку (в %) інертних домішок в 150 г технічного кальцій карбіду, якщо при обробці технічного кальцій карбіду водою зібрано 44,8 л (нормальні умови) газу.
5. Визначте, який об’єм природного газу, що містить 95% метану (за об’ємом) необхідний для добування 1 м3 ацетилену, якщо вихід продукту альдегіду складає 40% від теоретичного.
Практична робота №4
Тема роботи:Розвיязання вправ з ізомерії, номенклатури та хімічних властивостей
аренів. Розвיязання розрахункових задач на встановлення формул аренів.
Мета роботи: Навчитися складати формули ізомерних сполук; давати назви речовинам
за номенклатурою ІЮПАК; складати формули речовин за їх назвою;
складати рівняння реакцій добування та хімічних властивостей аренів;
розвיязувати задачі на знаходження молекулярної формули аренів.
I. Тестові завдання
1. Вкажіть формулу ароматичного вуглеводню та назвіть його за номенклатурою ІЮПАК:
![]()
2. Серед наведених формул вкажіть формулу толуену:
![]()
3. Вкажіть гомологи бензену:
а)
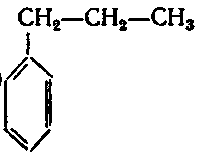 ;
б)
;
б) ;
в)
;
в)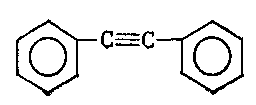 ;
г)
;
г)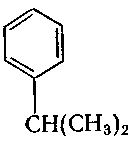 .
.
4. Вкажіть гомологи бензену:
а)
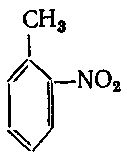 ;
б)
;
б)![]() ;
в)
;
в)![]() ;
г)
;
г)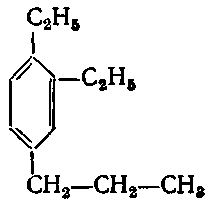 .
.
5. Серед наведених формул вкажіть ізомери:
а)
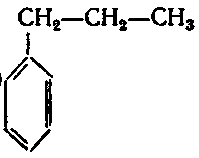 ;
б)
;
б) ;
в)
;
в)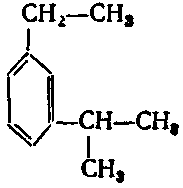 ;
г)
;
г)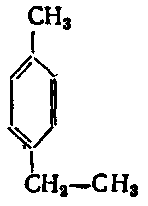 .
.
6. Серед наведених формул вкажіть ізомери:
а)
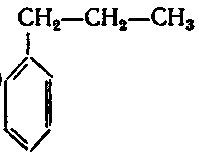 ;
б)
;
б) ;
в)
;
в)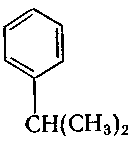 ;
г)
;
г)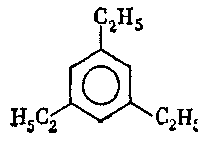 .
.
7. Назвіть речовину, формула якої
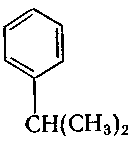
а) толуен;
б) стирол;
в) кумол;
г) мезитилен.
8. Назвіть речовину, формула якої
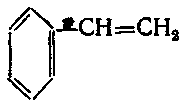
а) толуен;
б) стирол;
в) кумол;
г) мезитилен.
9. Серед наведених формул вкажіть формулу 1-ізопропіл-4-метилбензену:
а)
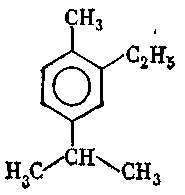 ;
б)
;
б)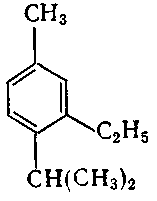 ;
в)
;
в)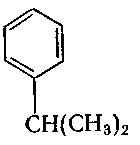 ;
г)
;
г)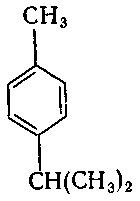 .
.
10. Серед наведених формул вкажіть формулу 1-етил-3-ізопропілбензену:
а)
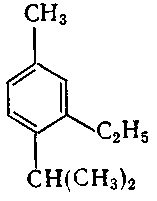 ;
б)
;
б)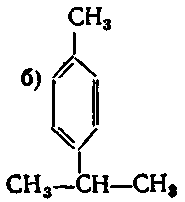 ;
в)
;
в)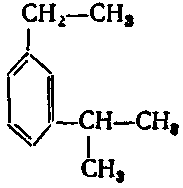 ;
г)
;
г)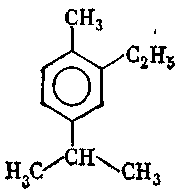 .
.
11. Бензен можна добути:
а) тримеризацією ацетилену;
б) дегідруванням циклогексану;
в) тримеризацією етилену;
г) крекінгом метану.
12. Толуен можна добути:
а) тримеризацією ацетилену;
б) дегідруванням гексану;
в) дегідруванням метилциклогексану;
г) гідруванням метилциклогексану.
13. Бензен може бути перетворений в циклогексан реакцією:
а) гідрування;
б) дегідрування;
в) гідратації;
г) дегідратації.
14. Укажіть за яких умов із бензену утворюється нітробензен:
а) при дії KNO3;
б) при дії KNO2;
в) при дії HNO2;
г) при дії HNO3/H2SO4.
15. Які процеси проходять з руйнуванням -системи бензену?
а) хлорування при освітленні;
б) бромування в присутності FeBr3;
в) гідрування;
г) нітрування.
16. Укажіть з якими речовинами бензен може реагувати за типом реакції заміщення:
а) галогенами;
б) киснем;
в) нітратною кислотою;
г) воднем.
17. Укажіть за яких умов із бензену утворюється хлоробензен:
а) дією HCl;
б) дією Cl2 при ультрафіолетовому освітленні;
в) при обробці Cl2 в присутності FeCl3;
г) дією NaCl.
18. В реакціях бензену з якими речовинами зберігається -система бензенового кільця?
а) воднем;
б) бромом в присутності FeBr3;
в) хлором при освітлення;
г) нітратною кислотою в присутності сульфатної.
II. Вправи за темою “Номенклатура та ізомерія аренів”
Приклад розв’язання:
Завдання: Напишіть структурні формули всіх ізомерних ароматичних вуглеводнів складу С8Н10 і назвіть їх.
Розв’язання: Ізомерія гомологів бензену зумовлена різними структурами, числом і положенням замісників у бензеновому кільці. З восьми атомів Карбону шість атомів утворюють бензенове кільце, а два входять до складу замісників (бокових ланцюгів). Існує два варіанти розподілу двох атомів Карбону по бокових ланцюгах.
1) Один замісник – С2Н5:
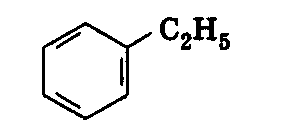
етилбензен
2) Два замісники ‑СН3 (три ізомери — орто-, мета- і пара-):
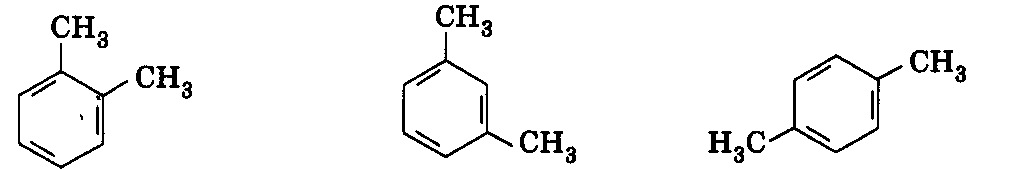
орто- мета- пара-
(1,2-диметилбензен) (1,3-диметилбензен) (1,4-диметилбензен)
Відповідь: чотири ізомери.
