
- •ВСТУП
- •2. ТЕОРЕТИЧНІ ОСНОВИ ОРГАНІЧНОЇ ХІМІЇ
- •2.1. Типи хімічних зв’язків
- •2.2. Характеристики ковалентного зв’язку
- •2.3. Будова атома карбону
- •2.4. Метод валентних зв’язків
- •2.5. Метод МО ЛКАО
- •2.6. Класифікація органічних реакцій
- •2.7. Проміжні частинки в органічних реакціях. Взаємний вплив атомів у молекулах
- •3. АЛКАНИ
- •4. АЛКЕНИ
- •6. АЛКАДІЄНИ
- •7. ЦИКЛОАЛКАНИ
- •8. АРОМАТИЧНІСТЬ
- •9. АРЕНИ
- •11. БАГАТОЯДЕРНІ АРОМАТИЧНІ СПОЛУКИ
- •12. ГАЛОГЕНОПОХІДНІ ВУГЛЕВОДНІВ
- •13. ЕЛЕМЕНТООРГАНІЧНІ СПОЛУКИ
- •14. СУЛЬФОКИСЛОТИ
- •15. СПИРТИ
- •16. ФЕНОЛИ
- •17. ЕТЕРИ. ЕПОКСИСПОЛУКИ
- •18. ТІОСПИРТИ. ТІОЕТЕРИ
- •19. АЛІФАТИЧНІ АЛЬДЕГІДИ ТА КЕТОНИ
- •20. АРОМАТИЧНІ АЛЬДЕГІДИ І КЕТОНИ
- •21. АЛІФАТИЧНІ НІТРОСПОЛУКИ
- •22. АРОМАТИЧНI НIТРОСПОЛУКИ
- •23. АЛІФАТИЧНІ АМІНИ
- •24. АРОМАТИЧНІ АМІНИ
- •25. ДІАЗО– І АЗОСПОЛУКИ
- •26. МОНОКАРБОНОВІ КИСЛОТИ
- •27. ДИКАРБОНОВІ КИСЛОТИ
- •28. АРОМАТИЧНІ КАРБОНОВІ КИСЛОТИ
- •29. ЗАМІЩЕНІ КИСЛОТИ
- •29.1. ГАЛОГЕНЗАМІЩЕНІ КИСЛОТИ
- •29.2. АМІНОКИСЛОТИ
- •29.3. ГІДРОКСИКИСЛОТИ
- •30. АЛЬДЕГІДОКИСЛОТИ І КЕТОКИСЛОТИ
- •31. ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
- •31.1. КЛАСИФІКАЦІЯ ТА НОМЕНКЛАТУРА ГЕТЕРОЦИКЛІЧНИХ СПОЛУК
- •31.2. П’ЯТИЧЛЕННІ ГЕТЕРОЦИКЛІЧНІ СПОЛУКИ
- •31.3. ШЕСТИЧЛЕННІ ГЕТЕРОЦИКЛИ
- •31.4. КОНДЕНСОВАНІ ГЕТЕРОЦИКЛИ
- •31.5. ПОЛІГЕТЕРОЦИКЛИ
- •32. ВУГЛЕВОДИ
- •32.1. МОНОСАХАРИДИ
- •32.2. ПОЛІСАХАРИДИ
- •СПИСОК ЛІТЕРАТУРИ
2.4. Метод валентних зв’язків
Для опису хімічних зв’язків в органічних сполуках використовують два методи – метод валентних зв’язків (ВЗ) та метод молекулярних орбіталей (МО).
Основні положення методу ВЗ:
Хімічний зв’язок між атомами утворюється при перекриванні атомних орбіталей двох електронів.
Пара електронів, яка утворює зв’язок, зосереджена (локалізована) між двома атомами – учасниками зв’язку.
Кожний зв’язок утворюється парою електронів з антипаралельними спінами.
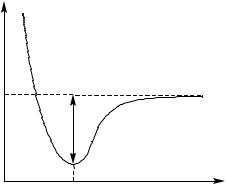
Таким чином, в основі методу ВЗ знаходиться хімічний зв’язок як результат узагальнення двома атомами пари електронів, яка знаходиться на електронній орбіталі, утвореній в результаті перекривання двох атомних орбіталей. При цьому більша частина енергії зв’язку між двома атомами, які знаходяться на рівноважній між’ядерній відстані, реалізується внаслідок швидкого обміну (резонансу) електронів між двома ядрами. Крива потенційної енергії, в залежності від між’ядерної відстані, має глибокий мінімум на міжядерній відстані, що відповідає довжині зв’язку (рис.2.2). В цьому випадку врівноважуються сили електронно-ядерного притягування та ядерноядерного відштовхування.
E
Eзв |
|
l0 |
l, нм |
Рис.2.2. Залежність потенційної енергії двохатомної молекули від між’ядерної відстані; l0 – рівноважна між’ядерна відстань, Езв – енергія зв’язку.
Будь-який зв’язок утворюється в області максимального перекривання атомних орбіталей; із збільшенням ступеню перекривання (інтегралу перекривання) міцність зв’язку зростає. Утворення зв’язку за рахунок напрямлених орбіталей завжди приводить до більш міцного зв’язку, ніж при перекриванні сферичних s-орбіталей.
У методі ВЗ, для пояснення електронної будови молекули застосовують ізольовані АО, власну взаємодію яких між собою не враховують. Метод ВЗ дозволяє пояснити насиченість хімічного зв’язку, його напрямленість у просторі та енергію активації.
24
В рамках методу ВЗ виникла необхідність розглянути природу орбіталей атома карбону, завдяки яким утворюються зв’язки в органічних сполуках. Відомо, що атом карбону в метані СН4 утворює чотири рівноцінних зв’язки С-Н, хоча електронна будова атома С - 1s22s22p2 – вказує на його теоретичну двовалентність. Ця суперечність була усунена за допомогою концепції гібридизації АО (Л.Полінг та Д.Слейтер, 1927-1934 рр.).
Існування чотирьох еквівалентних зв’язків С-Н в метані можна пояснити, застосовуючи таке припущення. При нагріванні або опромінюванні основного стану атома С відбувається перехід одного електрона з 2s-підрівня на 2р-підрівень з утворенням збудженого стану С* з електронною конфігурацією 1s22s12p3 . В подальшому залишкова 2s-орбіталь змішується (гібридизується) з трьома іншими 2р-орбіталями з утворенням чотирьох однакових гібридних орбіталей. Тобто чотири АО атома С (2s, 2px, 2py, 2pz) замінюються набором чотирьох еквівалентних гібридних АО, названих sp3-гібридними АО. Будова атома карбону в основному, збудженому та sp3-гібридному стані (рис.2.3):
1s |
2s |
2p |
1s |
2s |
2p |
1s22s22p2 1s22s12p3
основний стан збуджений стан
1s22(sp3)4 sp3-гібридний стан
Рис.2.3. Стани атома карбону
Це припущення має два важливі наслідки:
1.Атом С має можливість утворювати не два, а чотири ковалентні зв’язки;
2.Гібридні АО, які утворюються, мають осьову симетрію і напрямленність в просторі, що забезпечує більш ефективне перекривання з іншими АО при утворенні хімічних зв’язків. При цьому енергія, необхідна для переходу атома С з основного стану (електронна конфігурація 1s22s22p2) в збуджений (електронна конфігурація 1s22s2p3) з послідуючою гібридизацією (електронна конфігурація 1s22(sp3)4) з лихвою компенсується завдяки утворенню чотирьох більш міцних ковалентних зв’язків.
Утворення хімічних зв’язків в ненасичених органічних сполуках – похідних етилену та ацетилену – пояснюється припущенням, що атом С може існувати також в sp2- та sp-гібридних станах, відповідно.
Для пояснення можливості утворення гібридних орбіталей в методі ВЗ розглянемо принципову схему утворення sp-гібридних орбіталей, як найбільш доступну для розуміння.
Змішування s-орбіталі з px-орбіталлю одного і того ж атома карбону фактично є наслідком комбінації хвильових функцій електронів, які займають ці орбіталі. При цьому, якщо знак хвильових функцій електронів (орбіталей) збігається, результуюча хвильова функція підсилюється, якщо
25
ж знак хвильових функцій протилежний – результуюча хвильова функція послаблюється. Лінійна комбінація s- і рх-орбіталей є наслідком алгебраїчної суми (попарного додавання та віднімання) їх хвильових функцій.
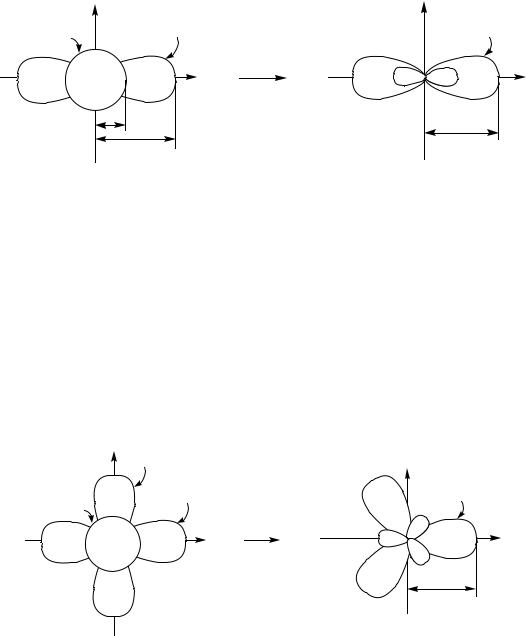
Відповідно, sp-гібридизацію атома С можна зобразити так (рис.2.4):
(s + px) + py + pz 2sp + py + pz
|
|
y |
|
|
|
|
y |
|
|
|
s |
|
|
p |
|
|
|
sp |
|
- |
+ |
|
+ |
x |
+ |
- |
- |
+ |
x |
|
|
1 |
1,73 |
|
|
|
|
1,93 |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
Рис.2.4. Схема sp-гібридизації атома карбону
Висновок: sp-гібридні орбіталі розташовані одна до одної під кутом 180 , sp-гібридний стан атома С є лінійним (дигональним), оскільки вихідні s- та px-орбіталі розташовані на одній прямій; молекули, до складу яких входять лише sp-гібридні атоми С, мають лінійну будову (наприклад, ацетилен). Лінійний стан sp-гібридного атома С можна розглядати як результат електростатичного відштовхування двох заповнених електронами АО.
Утворення sp2-гібридних орбіталей відбувається аналогічно попередньому випадку, за рахунок змішування s-орбіталі з px- та py-орбіталями одного і того ж атома карбону.
sp2-Гібридизацію атома С можна записати так (рис.2.5):
(s + px + px) + pz 3sp2 + pz
|
y |
py |
|
|
y |
|
|
|
|
|
|
|
|
||
s |
+ |
|
px |
+ |
sp2 |
|
|
|
|
|
|
||||
- |
|
|
|
- |
- |
|
|
+ |
+ |
x |
+ |
x |
|||
|
|||||||
|
|
|
|
|
- |
|
|
|
1 |
|
|
+ |
1,99 |
|
|
|
- |
|
|
|
|
|
Рис.2.5. Схема sp2-гібридизації атома карбону
Висновок: sp2-гібридні орбіталі, розташовані одна до одної під кутом 120 , sp2-гібридний стан атома С є плоским (тригональним), оскільки вихідні s-, px- та py-орбіталі знаходяться в одній площині; молекули, до складу яких входять лише sp2-гібридні атоми С, мають плоску будову (наприклад, етилен). Плоский стан sp2-гібридизованого атома С можна також розглядати як результат електростатичного відштовхування трьох заповнених електронами АО.
26
Утворення sp3-гібридних орбіталей відбувається аналогічно за рахунок змішування s-орбіталі з px-, py - та pz-орбіталями одного і того ж атома карбону.
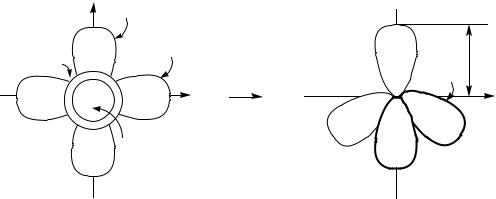
sp3-Гібридизацію атома С можна записати таким чином (рис.2.6):
(s + px + px + pz) 4sp3
y |
py |
|
+ |
|
px |
s |
|
|
- |
+ |
x |
|
|
|
1 |
pz |
|
- |
|
|
 y
y
+
sp3
+ +
+
00 2,
x
Рис.2.6. Схема sp3-гібридизації атома карбону
Висновок: sp3-гібридні орбіталі, розташовані одна до одної під кутом 109 28 , sp3-гібридний стан атома С є об’ємним (тетрагональним, тетраедричним), оскільки вихідні орбіталі мають об’ємне розташування; молекули, до складу яких входять sp3-гібридні атоми С, мають об’ємну будову (наприклад, етан). Об’ємний стан sp3-гібридного атома С можна розглядати як результат електростатичного відштовхування чотирьох заповнених електронами АО, які не знаходяться в одній площині.
При порівнянні sp-, sp2- та sp3-гібридних станів атома С можна дійти до загальних висновків:
1.Радіус гібридних орбіталей зростає в ряду sp < sp2 < sp3, тобто із зменшенням частки s- орбіталі, яка має менший власний радіус та збільшенням частки p-орбіталей, які мають більший власний радіус. В sp-гібридному стані частка s-орбіталі складає 50%, в sp2-33,3%, в sp3-25%. При цьому радіус p-орбіталі менший від радіуса sp-гібридної орбіталі.
2.Електронегативність атома С залежить від його гібридного стану і зменшується в ряду sp(3,2) > sp2(2,75) > sp3(2,5), тобто із зменшенням частки s-орбіталі в відповідному гібридному стані.
Ворганічній хімії за способом перекривання АО розглядають два типи ковалентних зв’язків -
- і -зв’язки.
-Зв’язки утворюються при осьовому перекриванні атомних орбіталей. В цьому випадку максимальне перекривання відбувається вздовж осі, яка з’єднує два ядра. -Зв’язки мають циліндричну симетрію, тобто мають вісь обертання безмежного порядку. Прикладами таких зв’язків можуть бути зв’язки H-H та С-Н (рис.2.7):
27
