- •2) Електрохімічні методи:
- •1 Абсорбційна спектроскопія
- •1.1 Закони світлопоглинання
- •1.2 Фотометричний метод аналізу
- •Вимоги до реакцій утворення забарвлених сполук:
- •Умови проведення реакцій:
- •1.3 Методи визначення концентрації
- •1.4 Вимірювання інтенсивності світлопоглинання
- •Лабораторна робота № 1 Визначення заліза у вигляді роданідного комплексу
- •Лабораторна робота № 2 Визначення заліза(ш) із сульфосаліциловою кислотою диференційним методом
- •2 Рефрактометричний аналІз
- •Лабораторна робота № 3 Контроль якості приготованих розчинів і визначення концентрації калію броміду в водних розчинах рефрактометричним методом
- •3 Хроматографічні методи аналізу
- •3.1 Класифікація методів хроматографії
- •3.2 Іонообмінна хроматографія
- •3.3 Паперова хроматографія
- •3.4 Тонкошарова хроматографія (тшх)
- •Лабораторна робота № 4
- •4 Потенціометричний метод аналізу
- •4.1 Сутність потенціометричного методу
- •4.1.1 Виникнення електродного потенціалу
- •4.1.2 Електроди в потенціометричному методі
- •4.1.3 Дифузійний потенціал
- •4.2. Методи визначення концентрації у потенціометрії
- •4.2.1 Пряма потенціометрія (іонометрія)
- •Визначення рН
- •4.2.2 Способи визначення концентрації в прямій потенціометрії
- •4.2.3 Потенціометричне титрування
- •4.2.3.1 Види потенціометричного титрування в залежності від типу хімічної реакції, що використовується
- •4.2.3.2 Способи визначення точки еквівалентності
- •Лабораторна робота № 5 Потенціометричне визначення рН розчинів
- •Лабораторна робота № 6 Потенціометричне титрування заліза діхроматом калію
- •Лабораторна робота № 7 Визначення хлорид- і йодид-іонів при спільній присутності їх у розчині
- •5 Електрогравіметричний метод
- •5.1 Закони електролізу
- •5.2 Напруга розкладання
- •5.3 Порядок розряду іонів
- •5.4 Електроди в електроваговому аналізі
- •5.5 Вимоги до осадів у електрогравіметрії
- •5.6 Умови проведення електролізу
- •5.6.1 Фізичні умови
- •5.6.2 Хімічні умови електролізу
- •5.7 Методи електролізу
- •II. Внутрішній електроліз (електроліз без накладання напруги)
- •Лабораторна робота № 8 Електролітичне визначення нікелю з сульфатно-аміачного електроліту
- •Лабораторна робота № 9 Визначення міді внутрішнім електролізом.
- •6 Вольтамперометричний метод аналізу
- •6.1. Сутність вольтамперометричного методу
- •6.1.1 Електроди у полярографії
- •6.1.2 Границі поляризації електродів
- •6.1.3 Аналіз вольтамперної кривої
- •6.2 Методи вольтамперометричного аналізу
- •6.2.1 Якісний полярографічний аналіз
- •6.2.2 Кількісний аналіз. Рівняння Ільковича
- •6.2.3 Способи розрахунку концентрацій у поляграфічному аналізі
- •1) Визначення концентрації іонів металів за рівнянням Ільковича
- •2) Визначення концентрації методом стандартних розчинів (аналітичний метод)
- •3) Визначення концентрації речовини за методом калібрувального графіка
- •4) Визначення концентрацій речовин методом добавок
- •6.2.4. Амперметричне титрування
- •Типи кривих титрування
- •Лабораторна робота № 10 Амперометричне титрування заліза ванадатом амонію
- •Лабораторна робота № 11 Вивчення реакції міді з діетилдітіокарбаматом натрію
- •Лабораторна робота № 12 Амперометричне визначення фераміду
- •Список літератури
6.1.1 Електроди у полярографії
а) Мікроелектрод – крапля ртуті, що є катодом. Через те, що його площа S мала, щільність струму велика (і=І/S мА/см2), відбувається значна поляризація катоду, тобто зміна зовнішньої ЕРС витрачається на поляризацію мікроелектрода.
б) Макроелектрод – електрод з великою площею поверхні (донна ртуть або каломельний електрод), який при проходженні невеликого струму не поляризується, потенціал залишається постійним.
Оскільки один електрод не поляризується i для нього потенціал залишається постійним, напруга, яка подається на комірку проявляється в зміні потенціалу тільки мікроелектрода. Якщо потенціал цього електрода вимірювати щодо електрода порівняння, умовно прийнявши його за нуль, то:
Е = Еа – для робочого мікроанода,
Е = –Ек для робочого мікрокатода,
де Е – прикладена ззовні напруга.
6.1.2 Границі поляризації електродів
В полярографії і амперметрії в якості мікроелектродів частіше за все використовують ртутний, платиновий і графітовий.
Переваги ртутного крапаючого електроду:
–поверхня, що постійно оновлюється і добре відтворювані результати;
– високі
значення перенапруги
![]() ,
завдяки чому можливе визначення
електровід’ємних металів.
,
завдяки чому можливе визначення
електровід’ємних металів.
Недоліки:
– ртуть є отрутою;
– при анодній поляризації ртуть розчиняється, тому у вигляді мікроаноду вона не використовується.
Переваги платинового електроду:
– зручний у використанні;
– окиснення Н2О з виділенням О2 проходить при дуже великих значеннях потенціалу;
– платина є інертною.
Недоліки:
– можливість пасивації поверхні;
– маленьке
![]() ,
у випадку використання у якості катоду.
,
у випадку використання у якості катоду.
В цілому Hg-електрод використовують частіше у вигляді мікрокатоду, а Pt-електрод – мікроаноду.
Графічно границі поляризації, тобто область потенціалів використання електродів, можна представити наступним чином: визначають область в якій можливо проводити аналіз, і виділення Н2 і О2 не заважає проведенню аналізу (рис. 6.2).

Рис. 6.2 Вольтамперограми водного розчину кислоти: 1 – на платині; 2 – на ртуті
Відповідно
до рівняння (1) потенціал виділення Н2
залежить від кислотності розчину і
матеріалу електрода. Якщо концентрація
іонів водню Н+
дорівнює 1 моль/л, то на ртутному електроді
![]() ,
на платиновому електроді –0,1В.
,
на платиновому електроді –0,1В.
Для розчинів, в яких [H+]=1 М, границі поляризації, тобто потенціали, за яких можливо проводити аналіз, складають:
для ртуті –1,1 ÷ +0,3 В; для платини –0,1 ÷ +1,4 В.
6.1.3 Аналіз вольтамперної кривої
Умови реєстрації вольтамперних кривих (полярограм):
1. Електрохімічна комірка, що складається з мікро- і мікро електроду.
2. Визначуваний іон повинен давати електродну реакцію (окислюватись або відновлюватись на мікроелектроді).
3. Використання індиферентного фонового електроліту (наприклад KCl, NH4Cl) Сфона більше Сдосл в 100 і більше разів.
4. Концентрація досліджуваного розчину 10–3–10–6 моль/л.
5. Розчин продувають інертним газом (наприклад азотом N2) для видалення розчиненого кисню O2.
6. Іноді додають ПАР. У їх присутності крива більш чітка.
|
|
|
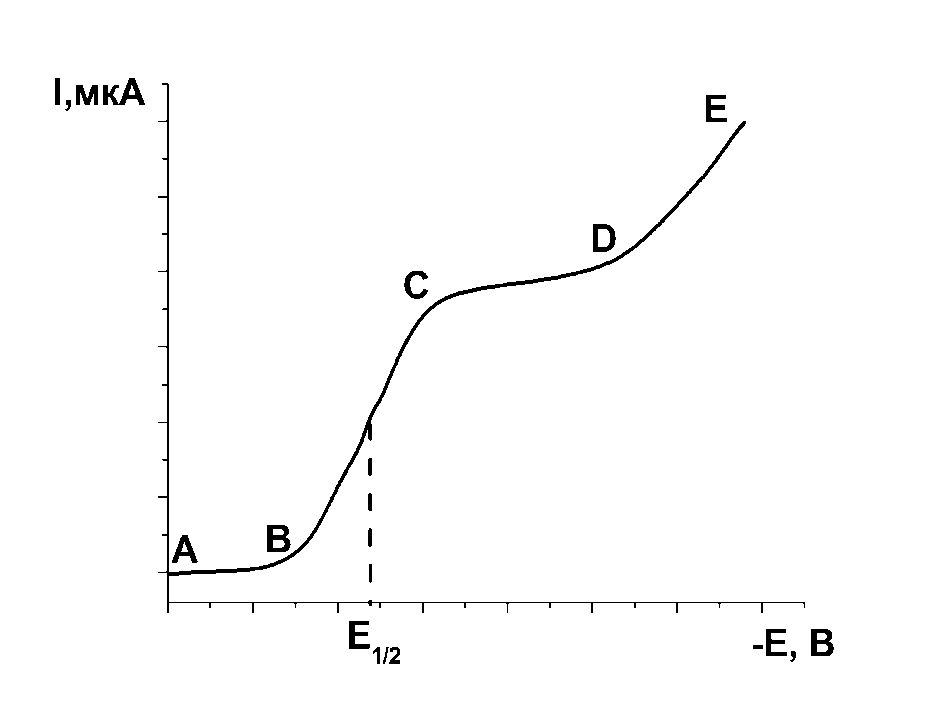
Рис. 6.3 Типовий вигляд вольтамперної кривої |
1) Ділянка АВ (рис. 6.3) відповідає залишковому струму (~10–7–10–5 A):
Ізалишк.=Іфарад+Іконд.,
де Іконд – обумовлений зарядженням подвійного шару на поверхні електроду (як конденсатор);
І
0
О2 + 4е +4Н+ 2Н2О
(перед зняттям полярограми його вилучають додаванням гідразину або продувкою розчину інертним газом).
2) В точці В стає можливим відновлення визначуваних іонів, наприклад
![]() амальгама
кадмію.
амальгама
кадмію.
3) Ділянка ВС – електровідновлення визначуваних іонів на мікрокатоді.
Процес електровідновлення складається з наступних стадій:
1 – дифузія іонів до поверхні електрода;
2 – передача електрона від електрода до іона (розряд);
3 – відведення продуктів реакції з приелектродного шару (шляхом розчинення їх у мaтepiалi електрода (утворення амальгам), або кристалізацією на пoвepxнi електрода, або, якщо продукти розчинні, дифузією їx від поверхні електрода назад у розчин). При виділeннi ioнa, що відновлюється, з комплексу може спостерігатися адсорбція ioнa на поверхні електрода. Можливі й iншi процеси. Кожна з цих стадій може бути уповільненою.
У найпростішому випадку найбільш повільною є швидкість дифузії іона кадмію з розчину до поверхні електрода.
Внаслідок розряду іонів сила струму в ланцюгу буде збільшуватись, концентрація іонів в приелектродному шарі буде зменшуватись, але частково поповнюватись за рахунок дифузії іонів з об’єму розчину. Сила струму залежить від швидкості дифузії, яка прямо пропорційна різниці концентрацій іонів в приелектродному шарі (СS) і в масі розчину (С): І=k(С–СS).
4) В точці С: СS 0 і швидкість розряду іонів прямопропорційна швидкості дифузії.
5) Ділянка СD – сила струму стає постійною, досягається Іграничний або Ідифузійний (далі Іd), його сила прямопропорційна концентрації іонів в розчині, через те що концентрація іонів у приелектродному шарі СS = 0:
Іd =К∙С.
У відсутності індиферентного електроліту іони Сd2+ будуть рухатися до електроду і за рахунок міграції завдяки дії електростатичних сил. Зі збільшенням напруги заряд електроду збільшується, струм зростає і ділянка СD, яка паралельна осі Е, не спостерігається. Тоді струм називається граничним:
![]() .
.
Для запобігання міграційного струму додають полярографічний фон – індиферентний електроліт.
Вимоги до фону:
– він не повинен брати участь ні в хімічній, ні в електродній реакції;
– концентрація фону повинна бути в 1000 разів більша концентрації визначуваного іону, тоді доля електрики, перенесена фоном, в стільки ж разів більша за долю електрики, що перенесена визначуваним іоном. Катіони фону підходячи до електроду екранують його з боку розчину та іони визначуваного металу до металу не йдуть, Іміграційний=0.
При подальшому збільшенні напруги досягається потенціал, при якому починається розкладання води з виділенням Н2, струм знову збільшується (ділянка DЕ).
Ділянка поляризаційної кривої (ВСD) є типовою полярографічною хвилею i використовується в аналітичній хімії для відкриття i визначення речовини, що відновлюється (або окиснюється).