
- •2) Електрохімічні методи:
- •1 Абсорбційна спектроскопія
- •1.1 Закони світлопоглинання
- •1.2 Фотометричний метод аналізу
- •Вимоги до реакцій утворення забарвлених сполук:
- •Умови проведення реакцій:
- •1.3 Методи визначення концентрації
- •1.4 Вимірювання інтенсивності світлопоглинання
- •Лабораторна робота № 1 Визначення заліза у вигляді роданідного комплексу
- •Лабораторна робота № 2 Визначення заліза(ш) із сульфосаліциловою кислотою диференційним методом
- •2 Рефрактометричний аналІз
- •Лабораторна робота № 3 Контроль якості приготованих розчинів і визначення концентрації калію броміду в водних розчинах рефрактометричним методом
- •3 Хроматографічні методи аналізу
- •3.1 Класифікація методів хроматографії
- •3.2 Іонообмінна хроматографія
- •3.3 Паперова хроматографія
- •3.4 Тонкошарова хроматографія (тшх)
- •Лабораторна робота № 4
- •4 Потенціометричний метод аналізу
- •4.1 Сутність потенціометричного методу
- •4.1.1 Виникнення електродного потенціалу
- •4.1.2 Електроди в потенціометричному методі
- •4.1.3 Дифузійний потенціал
- •4.2. Методи визначення концентрації у потенціометрії
- •4.2.1 Пряма потенціометрія (іонометрія)
- •Визначення рН
- •4.2.2 Способи визначення концентрації в прямій потенціометрії
- •4.2.3 Потенціометричне титрування
- •4.2.3.1 Види потенціометричного титрування в залежності від типу хімічної реакції, що використовується
- •4.2.3.2 Способи визначення точки еквівалентності
- •Лабораторна робота № 5 Потенціометричне визначення рН розчинів
- •Лабораторна робота № 6 Потенціометричне титрування заліза діхроматом калію
- •Лабораторна робота № 7 Визначення хлорид- і йодид-іонів при спільній присутності їх у розчині
- •5 Електрогравіметричний метод
- •5.1 Закони електролізу
- •5.2 Напруга розкладання
- •5.3 Порядок розряду іонів
- •5.4 Електроди в електроваговому аналізі
- •5.5 Вимоги до осадів у електрогравіметрії
- •5.6 Умови проведення електролізу
- •5.6.1 Фізичні умови
- •5.6.2 Хімічні умови електролізу
- •5.7 Методи електролізу
- •II. Внутрішній електроліз (електроліз без накладання напруги)
- •Лабораторна робота № 8 Електролітичне визначення нікелю з сульфатно-аміачного електроліту
- •Лабораторна робота № 9 Визначення міді внутрішнім електролізом.
- •6 Вольтамперометричний метод аналізу
- •6.1. Сутність вольтамперометричного методу
- •6.1.1 Електроди у полярографії
- •6.1.2 Границі поляризації електродів
- •6.1.3 Аналіз вольтамперної кривої
- •6.2 Методи вольтамперометричного аналізу
- •6.2.1 Якісний полярографічний аналіз
- •6.2.2 Кількісний аналіз. Рівняння Ільковича
- •6.2.3 Способи розрахунку концентрацій у поляграфічному аналізі
- •1) Визначення концентрації іонів металів за рівнянням Ільковича
- •2) Визначення концентрації методом стандартних розчинів (аналітичний метод)
- •3) Визначення концентрації речовини за методом калібрувального графіка
- •4) Визначення концентрацій речовин методом добавок
- •6.2.4. Амперметричне титрування
- •Типи кривих титрування
- •Лабораторна робота № 10 Амперометричне титрування заліза ванадатом амонію
- •Лабораторна робота № 11 Вивчення реакції міді з діетилдітіокарбаматом натрію
- •Лабораторна робота № 12 Амперометричне визначення фераміду
- •Список літератури
Лабораторна робота № 6 Потенціометричне титрування заліза діхроматом калію
Мета роботи: визначити концентрацію солі заліза(ІІ) методом потенціометричного титрування.
Іони заліза(ІІ) характеризуються відновними властивостями (Е0=0,77 В), тому у розчині легко окислюються такими окисниками, як Cr2O72–, VO3–, MnO4– та інші.
Сумарна реакція взаємодії з біхроматом калію має вигляд:
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
або у іонному вигляді:
6Fe2+ + Cr2O72– + 14H+ = 6Fe3+ + 2Cr3+ + 7H2O.
У якості індикаторного використовують електрод з інертного металу, потенціал якого буде залежати від концентрації іонів у розчині як описано у розділі 4.2.3.1 пункт 2) та на кривій титрування буде спостерігатися один стрибок титрування.
У реальних системах, що необхідно проаналізувати, іони заліза знаходяться у трьохвалентному стані, тому їх спочатку відновлюють станум(ІІ) хлоридом, додаючи до гарячого досліджуваного розчину, підкисленого HCl. Розчин буде містити іони Fe2+ та надлишок іонів Sn2+, таким чином на кривій титрування біхроматом калію буде спостерігатися два стрибки титрування: перший обумовлений окисненням Sn2+ до Sn4+, другий – Fe2+ до Fe3+.
Обладнання та реактиви
1. Потенціометр.
2. Платиновий та хлорсрібний електроди.
3. Розчини солі Мора та K2Cr2O7, 0.1 моль-екв/л.
4. Сульфатна кислота, 1:4.
5. Бюретка, мірні стакани та циліндри, хімічні стакани на 100 мл.
6. Магнітна мішалка.
Методика виконання роботи
У викладача отримують хімічний стакан, що містить розчин з невідомою кількістю Fe2+. Додають приблизно 25 мл розчину сульфатної кислоти та дистильовану воду (≈25 мл). Опускають у розчин магнітну мішалку та занурюють закріплені на штативі електроди таким чином, щоб вони не торкались мішалки на дні стакану. Після додавання кожної порції титранту K2Cr2O7 (0,2 мл) вимірюють значення ЕРС та заносять до таблиці. Будують криві титрування та знаходять точку еквівалентності як показано у розділі 4.2.3.2.
 ,
,
де
![]() – об’єм точки еквівалентності.
– об’єм точки еквівалентності.
Лабораторна робота № 7 Визначення хлорид- і йодид-іонів при спільній присутності їх у розчині
Мета роботи: визначити концентрацію галогенід-іонів при спільній їх присутності у розчині.
Визначення галогенідів проводять методом осадового титрування розчином арґентум нітрату (розділ 4.2.3.1 пункт 1) ).
При
титруванні суміші галогенідів першою
в осад випадає менш розчинна сполука
– йодид срібла, потім хлорид срібла
(![]() ;
;![]() ).
Концентрація іонів арґентуму [Ag+],
необхідна для утворення осаду AgJ,
дорівнює
).
Концентрація іонів арґентуму [Ag+],
необхідна для утворення осаду AgJ,
дорівнює
![]() .
Поступово протягом титрування
концентрація
.
Поступово протягом титрування
концентрація![]() зменшується. Таким чином концентрація
[Ag+],
необхідна для утворення осаду,
збільшується.
зменшується. Таким чином концентрація
[Ag+],
необхідна для утворення осаду,
збільшується.
Утворення
хлориду срібла почнеться, коли
![]() тобто одночасне утворення двох осадів
почнеться за умови, коли:
тобто одночасне утворення двох осадів
почнеться за умови, коли:
![]() .
.
Виходячи з наведеної рівності можна розрахувати за якої концентрації йодид-іонів починається утворення осаду арґентум хлориду. Якщо концентрація хлорид-іонів у розчині складає порядку 0,1 моль/л, то
![]() .
.
Прийнято,
що іон практично повністю осаджений
при концентрації його в розчині порядку
10–5–10–6
М. Таким чином досягається повнота
осадження йодид-іонів та помилка
визначення при
![]() M
складає 10–2%.
M
складає 10–2%.
Потенціометричне
титрування арґентум нітратом проводять
з срібним індикаторним електродом на
фоні електроліту
![]() ,
який додають для коагуляції осадів і
підтримки постійної іонної сили розчину.
Електрод порівняння (каломельний або
хлорсеребряний) занурюють в додатковий
стаканчик і сполучають з досліджуваним
розчином за допомогою сольового містка,
заповненого KNO3.
На кривій потенціометричного титрування
спостерігають два стрибки титрування
(пункт 1) розділ 4.2.3.1): I – точка
еквівалентності для йодиду; II – точка
еквівалентності для хлориду.
,
який додають для коагуляції осадів і
підтримки постійної іонної сили розчину.
Електрод порівняння (каломельний або
хлорсеребряний) занурюють в додатковий
стаканчик і сполучають з досліджуваним
розчином за допомогою сольового містка,
заповненого KNO3.
На кривій потенціометричного титрування
спостерігають два стрибки титрування
(пункт 1) розділ 4.2.3.1): I – точка
еквівалентності для йодиду; II – точка
еквівалентності для хлориду.
Обладнання та реактиви:
Потенціометр.
Срібний та хлорсрібний (або каломельний) електроди.
Розчин суміші KJ та KCl; 0,1М розчин
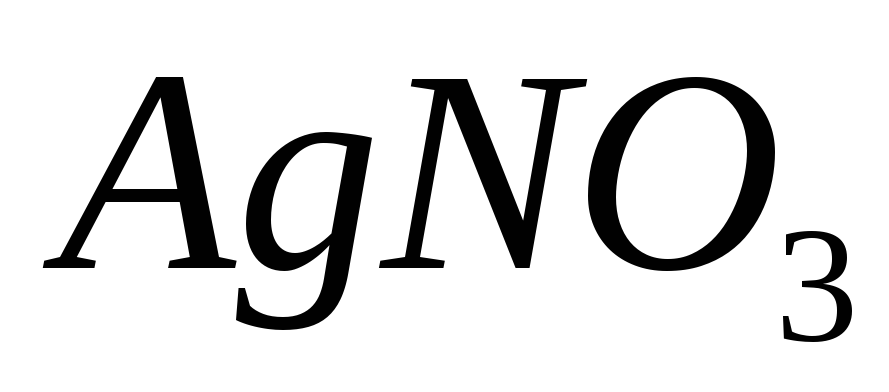 .
.10% розчин
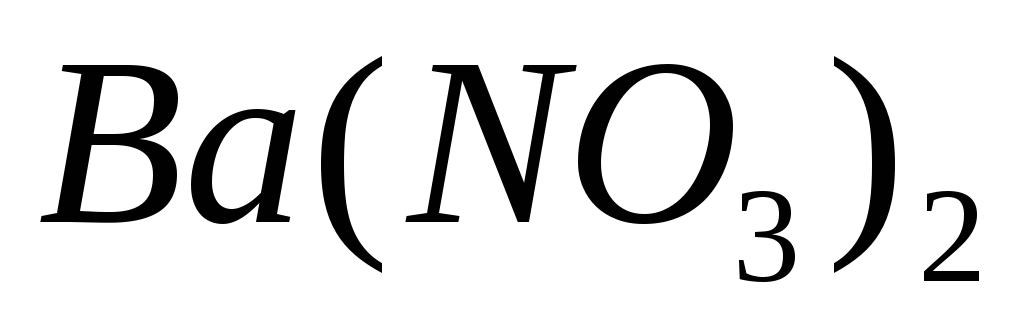 .
.Бюретка, мірний циліндр, хімічні стакани на 100 мл.
Магнітна мішалка та сольовий місток.
Методика виконання роботи
До отриманого розчину суміші солей галогенідів, що аналізують, додають приблизно 25 мл розчину фонового електроліту барій нітрату. Занурюють магнітну мішалку та опускають індикаторний електрод – срібну дротину – таким чином, щоб він не торкався мішалки. За допомогою сольового містка з’єднують досліджуваний розчин з електродом порівняння – каломельним електродом. Титрують 0,1М розчином азотнокислого срібла при постійному перемішуванні. Після кожного додавання реагенту (0,2 мл) вимірюють ЕРС. Перший стрибок титрування (значна зміна потенціалу) відповідає закінченню титрування йодид-іонів. При цьому відбувається зміна знаку рівноважного потенціалу, тобто переполюсовка срібного електроду. Продовжують титрування та спостерігають другий стрибок, що відповідаю закінченню титрування хлорид-іонів. Після стрибка додають ще 3–4 порції титранта. Результати вимірювання ЕРС заносять в таблицю, будують криві титрування та визначають точки еквівалентності, обчислюють вміст йодид- і хлорид-іонів за формулами:
![]() ;
;
![]() ,
,
де
![]() .
.
