- •2) Електрохімічні методи:
- •1 Абсорбційна спектроскопія
- •1.1 Закони світлопоглинання
- •1.2 Фотометричний метод аналізу
- •Вимоги до реакцій утворення забарвлених сполук:
- •Умови проведення реакцій:
- •1.3 Методи визначення концентрації
- •1.4 Вимірювання інтенсивності світлопоглинання
- •Лабораторна робота № 1 Визначення заліза у вигляді роданідного комплексу
- •Лабораторна робота № 2 Визначення заліза(ш) із сульфосаліциловою кислотою диференційним методом
- •2 Рефрактометричний аналІз
- •Лабораторна робота № 3 Контроль якості приготованих розчинів і визначення концентрації калію броміду в водних розчинах рефрактометричним методом
- •3 Хроматографічні методи аналізу
- •3.1 Класифікація методів хроматографії
- •3.2 Іонообмінна хроматографія
- •3.3 Паперова хроматографія
- •3.4 Тонкошарова хроматографія (тшх)
- •Лабораторна робота № 4
- •4 Потенціометричний метод аналізу
- •4.1 Сутність потенціометричного методу
- •4.1.1 Виникнення електродного потенціалу
- •4.1.2 Електроди в потенціометричному методі
- •4.1.3 Дифузійний потенціал
- •4.2. Методи визначення концентрації у потенціометрії
- •4.2.1 Пряма потенціометрія (іонометрія)
- •Визначення рН
- •4.2.2 Способи визначення концентрації в прямій потенціометрії
- •4.2.3 Потенціометричне титрування
- •4.2.3.1 Види потенціометричного титрування в залежності від типу хімічної реакції, що використовується
- •4.2.3.2 Способи визначення точки еквівалентності
- •Лабораторна робота № 5 Потенціометричне визначення рН розчинів
- •Лабораторна робота № 6 Потенціометричне титрування заліза діхроматом калію
- •Лабораторна робота № 7 Визначення хлорид- і йодид-іонів при спільній присутності їх у розчині
- •5 Електрогравіметричний метод
- •5.1 Закони електролізу
- •5.2 Напруга розкладання
- •5.3 Порядок розряду іонів
- •5.4 Електроди в електроваговому аналізі
- •5.5 Вимоги до осадів у електрогравіметрії
- •5.6 Умови проведення електролізу
- •5.6.1 Фізичні умови
- •5.6.2 Хімічні умови електролізу
- •5.7 Методи електролізу
- •II. Внутрішній електроліз (електроліз без накладання напруги)
- •Лабораторна робота № 8 Електролітичне визначення нікелю з сульфатно-аміачного електроліту
- •Лабораторна робота № 9 Визначення міді внутрішнім електролізом.
- •6 Вольтамперометричний метод аналізу
- •6.1. Сутність вольтамперометричного методу
- •6.1.1 Електроди у полярографії
- •6.1.2 Границі поляризації електродів
- •6.1.3 Аналіз вольтамперної кривої
- •6.2 Методи вольтамперометричного аналізу
- •6.2.1 Якісний полярографічний аналіз
- •6.2.2 Кількісний аналіз. Рівняння Ільковича
- •6.2.3 Способи розрахунку концентрацій у поляграфічному аналізі
- •1) Визначення концентрації іонів металів за рівнянням Ільковича
- •2) Визначення концентрації методом стандартних розчинів (аналітичний метод)
- •3) Визначення концентрації речовини за методом калібрувального графіка
- •4) Визначення концентрацій речовин методом добавок
- •6.2.4. Амперметричне титрування
- •Типи кривих титрування
- •Лабораторна робота № 10 Амперометричне титрування заліза ванадатом амонію
- •Лабораторна робота № 11 Вивчення реакції міді з діетилдітіокарбаматом натрію
- •Лабораторна робота № 12 Амперометричне визначення фераміду
- •Список літератури
4.2.3.2 Способи визначення точки еквівалентності
|
|
1) Через експериментальні точки відрізків a і b проводять дві паралельні прямі, проводять перпендикуляр с до них та знаходять середину цього перпендикуляру m. Опускають перпендикуляр d до точки m. Точка k перетину перпендикуляру d з кривою титрування і є точною еквівалентності. Об’єм Vт.е. є еквівалентним об’ємом (рис. 4.3).
|
|
| |
|
а |
б | |
|
Рис. 4.4 Криві потенціометричного титрування: а – диференційна крива; б – крива Грана | ||
2) Більш точний спосіб – знайти максимум на кривій у координатах ΔЕ/ΔV – V, де ΔЕ – це зміна потенціалу після кожного доливання титранту, тобто різниця потенціалу між двома сусідніми точками, ΔV – різниця об’ємів між двома сусідніми точками (рис. 4.4,а).
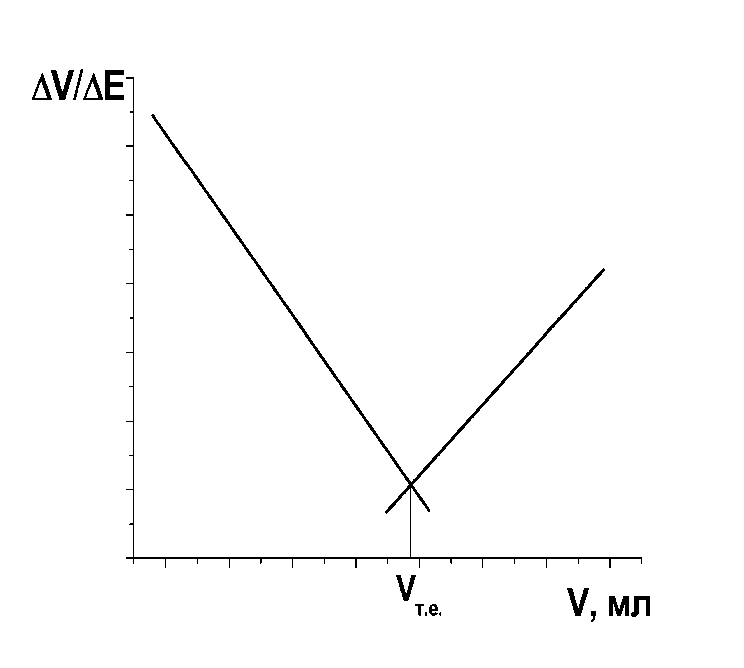
3) Простим і зручним є метод Грана, де точка еквівалентності знаходиться на перетині прямих на графіку у координатах ΔV/ΔE–V (рис. 4.4,б).
Лабораторна робота № 5 Потенціометричне визначення рН розчинів
Мета роботи: калібрувати прилад для вимірювання рН за стандартними буферними розчинами та виміряти рН досліджуваного розчину.
|
|
Найчастіше на практиці використовують скляний електрод та хлорсрібний електрод порівняння, вимірюючи ЕРС за допомогою іономера універсального (рис. 4.5). Цей прилад дозволяє вимірювати безпосередньо значення рН, а не ЕРС. Перед вимірюваннями іономер необхідно відкалібрувати за розчинами з відомим значенням рН.
Обладнання та реактиви:
Іономер універсальний.
Скляний та хлорсрібний електроди.
Буферні розчини з рН 1,64; рН 9,18; рН 4,01.
Хімічні стакани.
Методика виконання роботи
1) Калібрування приладу. Переключають іономер у режим рХ, діапазон вимірювань -1÷4. Електроди споліскують дистильованою водою, скляний електрод обережно протирають фільтрувальним папером. Занурюють електроди у кислий буферний розчин (рН 1,64). Ручкою «Калибровка» на шкалі приладу встановлюють значення 1,64. Виймають електроди, ретельно ополіскують дистильованою водою, протирають папером, встановлюють діапазон вимірювань 9÷14, та занурюють електроди у лужний буферний розчин (рН 9,18). Ручкою «Крутизна» встановлюють на шкалі приладу значення 9,18. Повторюють ці операції декілька разів, доки показники шкали не будуть відрізнятися не більше ніж на ±0,04 одиниці від значень рН кислого та лужного буферних розчинів. Перевіряють прилад за буферним розчином з рН 4,01 у діапазоні 4÷9.
2) Вимірювання рН досліджуваного розчину. На приладі встановлюють діапазон -1÷19. Електроди, що були попередньо промиті та протерті фільтрувальним папером, занурюють у досліджуваний розчин. Знімають показання шкали приладу грубо. Переключають іономер у діапазон вимірюваних рН та знімають показання більш точно.

 Рис. 4.3 Крива потенціометричного
титрування
Рис. 4.3 Крива потенціометричного
титрування