
- •2) Електрохімічні методи:
- •1 Абсорбційна спектроскопія
- •1.1 Закони світлопоглинання
- •1.2 Фотометричний метод аналізу
- •Вимоги до реакцій утворення забарвлених сполук:
- •Умови проведення реакцій:
- •1.3 Методи визначення концентрації
- •1.4 Вимірювання інтенсивності світлопоглинання
- •Лабораторна робота № 1 Визначення заліза у вигляді роданідного комплексу
- •Лабораторна робота № 2 Визначення заліза(ш) із сульфосаліциловою кислотою диференційним методом
- •2 Рефрактометричний аналІз
- •Лабораторна робота № 3 Контроль якості приготованих розчинів і визначення концентрації калію броміду в водних розчинах рефрактометричним методом
- •3 Хроматографічні методи аналізу
- •3.1 Класифікація методів хроматографії
- •3.2 Іонообмінна хроматографія
- •3.3 Паперова хроматографія
- •3.4 Тонкошарова хроматографія (тшх)
- •Лабораторна робота № 4
- •4 Потенціометричний метод аналізу
- •4.1 Сутність потенціометричного методу
- •4.1.1 Виникнення електродного потенціалу
- •4.1.2 Електроди в потенціометричному методі
- •4.1.3 Дифузійний потенціал
- •4.2. Методи визначення концентрації у потенціометрії
- •4.2.1 Пряма потенціометрія (іонометрія)
- •Визначення рН
- •4.2.2 Способи визначення концентрації в прямій потенціометрії
- •4.2.3 Потенціометричне титрування
- •4.2.3.1 Види потенціометричного титрування в залежності від типу хімічної реакції, що використовується
- •4.2.3.2 Способи визначення точки еквівалентності
- •Лабораторна робота № 5 Потенціометричне визначення рН розчинів
- •Лабораторна робота № 6 Потенціометричне титрування заліза діхроматом калію
- •Лабораторна робота № 7 Визначення хлорид- і йодид-іонів при спільній присутності їх у розчині
- •5 Електрогравіметричний метод
- •5.1 Закони електролізу
- •5.2 Напруга розкладання
- •5.3 Порядок розряду іонів
- •5.4 Електроди в електроваговому аналізі
- •5.5 Вимоги до осадів у електрогравіметрії
- •5.6 Умови проведення електролізу
- •5.6.1 Фізичні умови
- •5.6.2 Хімічні умови електролізу
- •5.7 Методи електролізу
- •II. Внутрішній електроліз (електроліз без накладання напруги)
- •Лабораторна робота № 8 Електролітичне визначення нікелю з сульфатно-аміачного електроліту
- •Лабораторна робота № 9 Визначення міді внутрішнім електролізом.
- •6 Вольтамперометричний метод аналізу
- •6.1. Сутність вольтамперометричного методу
- •6.1.1 Електроди у полярографії
- •6.1.2 Границі поляризації електродів
- •6.1.3 Аналіз вольтамперної кривої
- •6.2 Методи вольтамперометричного аналізу
- •6.2.1 Якісний полярографічний аналіз
- •6.2.2 Кількісний аналіз. Рівняння Ільковича
- •6.2.3 Способи розрахунку концентрацій у поляграфічному аналізі
- •1) Визначення концентрації іонів металів за рівнянням Ільковича
- •2) Визначення концентрації методом стандартних розчинів (аналітичний метод)
- •3) Визначення концентрації речовини за методом калібрувального графіка
- •4) Визначення концентрацій речовин методом добавок
- •6.2.4. Амперметричне титрування
- •Типи кривих титрування
- •Лабораторна робота № 10 Амперометричне титрування заліза ванадатом амонію
- •Лабораторна робота № 11 Вивчення реакції міді з діетилдітіокарбаматом натрію
- •Лабораторна робота № 12 Амперометричне визначення фераміду
- •Список літератури
4.2.2 Способи визначення концентрації в прямій потенціометрії
1) Розрахунковий
Вимірюють електрорушійну силу (ЕРС) гальванічного елемента та знаходять величину потенціалу індикаторного електроду Еінд (значення потенціалу електроду порівняння Eст відоме): Е=Ест–Еінд.
Наприклад, концентрацію іонів срібла розраховують за рівнянням Нернста:
![]() ,
,
![]() .
.
Метод трудомісткий через те, що в реальних умовах Е0 відрізняється від табличної величини, тому необхідно попередньо визначити реальне Е0 для стандартного розчину з відомою концентрацією визначуваної речовини.
2) Метод градуювального графіка. Готують серію стандартних розчинів визначуваного іона, вимірюють ЕРС і будують градуювальник графік в координатах Е–lgC, який є лінійним. Вимірюють потенціал індикаторного електрода у досліджуваному розчині та за градуювальник графіком знаходять концентрацію визначуваного іону (рис. 4.2).

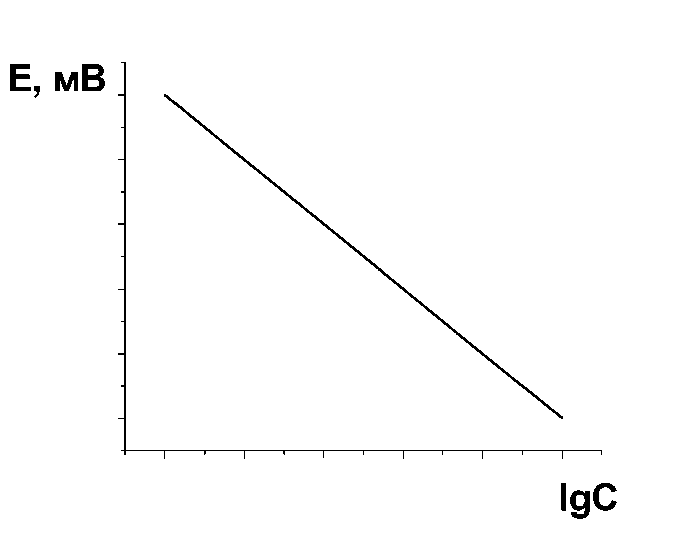
Рис. 4.2. Градуювальні графіки
3) Метод
добавок.
Спочатку вимірюють потенціал індикаторного
електроду Ex,
зануреного у певний об’єм V0
розчину невідомої концентрації
визначуваної речовини Сх.
Потім додають певний об’єм Vст
стандартного розчину Сст
тієї ж речовини таким чином, щоб в
отриманому розчині концентрація добавки
була відома:
![]() .
Вимірюють потенціал електроду в
отриманому розчині Ex+cт.
Записавши рівняння Нернста для Ex+cт
та Ех
та віднявши від першого рівняння друге
для випадку, наприклад, електроду
першого роду матимемо рівняння з однією
невідомою:
.
Вимірюють потенціал електроду в
отриманому розчині Ex+cт.
Записавши рівняння Нернста для Ex+cт
та Ех
та віднявши від першого рівняння друге
для випадку, наприклад, електроду
першого роду матимемо рівняння з однією
невідомою:
![]() ,
,
 .
.
4.2.3 Потенціометричне титрування
В процесі потенціометричного титрування вимірюють ЕРС гальванічного елементу, величина якої прямопропорційна потенціалу індикаторного електрода та концентрації визначуваної речовини А:
![]() ,
,
ЕРС= Ест – Еінд; Ест = const.
За отриманими даними будують криву титрування в координатах ЕРС–VR і графічно знаходять точку еквівалентності та VR – еквівалентний об’єм розчину титранту. Розрахунки вмісту досліджуваної речовини ведуть за формулами:
 або
або
![]() .
.
У цьому методі використовуються всі типи хімічних реакцій.
4.2.3.1 Види потенціометричного титрування в залежності від типу хімічної реакції, що використовується
Вибір індикаторного електроду залежить від типу хімічної реакції, що перебігає в розчині:
осадження – індикаторні електроди з металу, катіон якого входить до складу осаду.
окисно-відновна реакція – електроди з благородних інертних металів;
нейтралізація – електроди, потенціал яких залежить від рН розчину.
1) Осадове титрування. Метод базується на використанні реакцій осадження. Наприклад, а) визначення концентрації іонів срібла титруванням калій йодидом або б) визначення концентрації іонів йоду титруванням розчином арґентум нітратом.
![]() .
.
ДРAgI=10–16; індикаторний електрод – Ag0; електрод порівняння – НКЕ (нормальний каломельний електрод) (ЕНКЕ=0,245 В).
У випадку а) до точки еквівалентності потенціал електроду буде залежати від концентрації іонів срібла відповідно до рівняння Нернста:
![]() .
.
Після точки еквівалентності концентрація іонів срібла та відповідно потенціал електроду буде визначатися концентрацією іонів йоду:
![]() ;
;
 або
або
![]() .
.
У випадку б) відповідно навпаки: до точки еквівалентності потенціал визначається концентрацією I–, після – Ag+.
У точці
еквівалентності:
![]() ,
,
![]() .
.
Величина стрибка титрування залежить: від величини ДР – чим менший добуток розчинності, тим більший стрибок на кривій титрування; від концентрацій речовин – чим більше концентрація, тим більше стрибок.
У присутності в розчині декількох іонів, які утворюють з титрантом малорозчинні сполуки, титрування можна провести послідовно, якщо добутки розчинності (ДР) утворюваних сполук відрізняються хоча б на 4 порядки. Першим титрується іон, що утворює осад з меншим ДР. Наприклад при титруванні суміші хлорид і йодид іонів розчином арґентум нітрату спочатку утворюється осад AgI↓ (ДРAgI=10–16), потім AgCl↓ (ДРAgCl=10–10). В результаті на кривій титрування спостерігаються два стрибки.


2) Титрування з використанням окисно-відновних реакцій. Метод використовують для визначення іонів, що мають перемінну валентність (Fe, Mn, Cr, Sb, As тощо). В якості індикаторних електродів використовують благородні метали.
У якості приклада можна привести визначення концентрації іонів Fe2+ титруванням стандартним розчином калій біхромату.
![]() .
.
До точки еквівалентності у розчині будуть присутні іони Fe2+, Fe3+ та Cr3+. Потенціал електроду буде визначатися співвідношенням концентрацій [Fe3+]/[Fe2+]:
 .
.
Після точки еквівалентності у розчині будуть присутні іони Cr2O72–, Cr3+ та Fe3+. Потенціал електроду буде визначатися співвідношенням концентрацій [Cr2O72–]/[Cr3+] та рН розчину, оскільки іони водню приймають участь у цій напівреакції:
![]()
 .
.
У точці еквівалентності:
 .
.
Величина стрибка титрування залежить від різниці стандартних окисно-відновних потенціалів двох пар (чим більша різниця, тим більша величина стрибка).
Якщо в розчині присутні декілька окисників, що реагують з відновником (та навпаки), то їх можна відтитрувати послідовно. Наприклад суміш MnO4– та VO3– титрують розчином Fe2+: спочатку буде відновлюватись MnO4– до Mn2+, потім VO3– до VO2+.
Н а
кривій титрування будуть спостерігатись
два стрибки:
а
кривій титрування будуть спостерігатись
два стрибки:
3) Потенціометричне титрування з використанням реакцій нейтралізації – використовують для визначення концентрації кислот, основ та їх сумішей.
H+ + OH– ↔ H2O.
Потенціал індикаторного електроду прямо пропорційно залежить від концентрації іонів водню. У випадку титрування кислоти лугом до точки еквівалентності:
![]() або
або
![]() .
.
Після
точки еквівалентності у надлишку іонів
ОН–
:
![]()
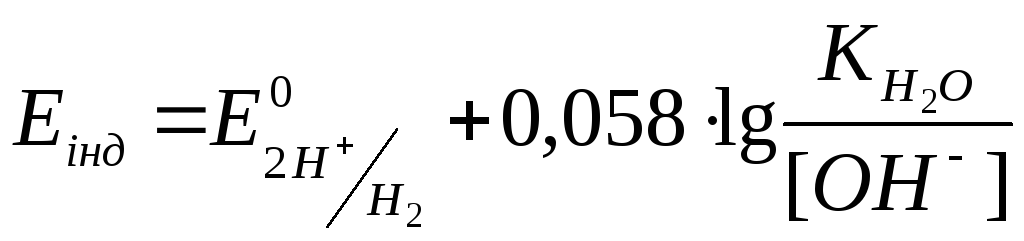 .
.
Можливе визначення концентрацій суміші декількох кислот за умови, що їх константи дисоціації відрізняються хоча б на 3 порядки. Першою буде титруватися більш сильна кислота, та на кривій титрування буде спостерігатися декілька стрибків титрування. Наприклад, у суміші оцтової (Кд=1,7∙10–5) та хлоридної (сильний електроліт) кислот першою реагує з лугом хлоридна кислота, потім оцтова, та на кривій титрування спостерігається два стрибки.
