
- •2) Електрохімічні методи:
- •1 Абсорбційна спектроскопія
- •1.1 Закони світлопоглинання
- •1.2 Фотометричний метод аналізу
- •Вимоги до реакцій утворення забарвлених сполук:
- •Умови проведення реакцій:
- •1.3 Методи визначення концентрації
- •1.4 Вимірювання інтенсивності світлопоглинання
- •Лабораторна робота № 1 Визначення заліза у вигляді роданідного комплексу
- •Лабораторна робота № 2 Визначення заліза(ш) із сульфосаліциловою кислотою диференційним методом
- •2 Рефрактометричний аналІз
- •Лабораторна робота № 3 Контроль якості приготованих розчинів і визначення концентрації калію броміду в водних розчинах рефрактометричним методом
- •3 Хроматографічні методи аналізу
- •3.1 Класифікація методів хроматографії
- •3.2 Іонообмінна хроматографія
- •3.3 Паперова хроматографія
- •3.4 Тонкошарова хроматографія (тшх)
- •Лабораторна робота № 4
- •4 Потенціометричний метод аналізу
- •4.1 Сутність потенціометричного методу
- •4.1.1 Виникнення електродного потенціалу
- •4.1.2 Електроди в потенціометричному методі
- •4.1.3 Дифузійний потенціал
- •4.2. Методи визначення концентрації у потенціометрії
- •4.2.1 Пряма потенціометрія (іонометрія)
- •Визначення рН
- •4.2.2 Способи визначення концентрації в прямій потенціометрії
- •4.2.3 Потенціометричне титрування
- •4.2.3.1 Види потенціометричного титрування в залежності від типу хімічної реакції, що використовується
- •4.2.3.2 Способи визначення точки еквівалентності
- •Лабораторна робота № 5 Потенціометричне визначення рН розчинів
- •Лабораторна робота № 6 Потенціометричне титрування заліза діхроматом калію
- •Лабораторна робота № 7 Визначення хлорид- і йодид-іонів при спільній присутності їх у розчині
- •5 Електрогравіметричний метод
- •5.1 Закони електролізу
- •5.2 Напруга розкладання
- •5.3 Порядок розряду іонів
- •5.4 Електроди в електроваговому аналізі
- •5.5 Вимоги до осадів у електрогравіметрії
- •5.6 Умови проведення електролізу
- •5.6.1 Фізичні умови
- •5.6.2 Хімічні умови електролізу
- •5.7 Методи електролізу
- •II. Внутрішній електроліз (електроліз без накладання напруги)
- •Лабораторна робота № 8 Електролітичне визначення нікелю з сульфатно-аміачного електроліту
- •Лабораторна робота № 9 Визначення міді внутрішнім електролізом.
- •6 Вольтамперометричний метод аналізу
- •6.1. Сутність вольтамперометричного методу
- •6.1.1 Електроди у полярографії
- •6.1.2 Границі поляризації електродів
- •6.1.3 Аналіз вольтамперної кривої
- •6.2 Методи вольтамперометричного аналізу
- •6.2.1 Якісний полярографічний аналіз
- •6.2.2 Кількісний аналіз. Рівняння Ільковича
- •6.2.3 Способи розрахунку концентрацій у поляграфічному аналізі
- •1) Визначення концентрації іонів металів за рівнянням Ільковича
- •2) Визначення концентрації методом стандартних розчинів (аналітичний метод)
- •3) Визначення концентрації речовини за методом калібрувального графіка
- •4) Визначення концентрацій речовин методом добавок
- •6.2.4. Амперметричне титрування
- •Типи кривих титрування
- •Лабораторна робота № 10 Амперометричне титрування заліза ванадатом амонію
- •Лабораторна робота № 11 Вивчення реакції міді з діетилдітіокарбаматом натрію
- •Лабораторна робота № 12 Амперометричне визначення фераміду
- •Список літератури
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДЕРЖАВНИЙ ВИЩИЙ НАВЧАЛЬНИЙ ЗАКЛАД
«УКРАЇНСЬКИЙ ДЕРЖАВНИЙ ХІМІКО-ТЕХНОЛОГІЧНИЙ
УНІВЕРСИТЕТ»
МЕТОДИЧНІ ВКАЗІВКИ
ДО лабораторних РОБІТ З КУРСУ
“АНАЛІТИЧНА ХІМІЯ ТА ІНСТРУМЕНТАЛЬНІ МЕТОДИ АНАЛІЗУ”
ДЛЯ СТУДЕНТІВ III КУРСУ СПЕЦІАЛЬНОСТІ
«ХІМІЧНА ТЕХНОЛОГІЯ ФАРМАЦЕВТИЧНИХ ПРЕПАРАТІВ»
Затверджено на засіданні кафедри аналітичної хімії.
Протокол № 10 від 30.06.2009.
Дніпропетровськ УДХТУ 2010
Методичні вказівки до лабораторних робіт з курсу “Аналітична хімія та інструментальні методи аналізу” для студентів iii курсу спеціальності «Хімічна технологія фармацевтичних препаратів» / Укл.: Т.О. Бубель, А.О. Гиренко, І.Д. Головко. – Дніпропетровськ: ДВНЗ УДХТУ, 2010. – 69 с.
Укладачі: Т.О. Бубель, канд. хім. наук
А.О. Гиренко, канд. хім. наук
І.Д. Головко
Відповідальний за випуск В.І. Ткач, д-р хім. наук
Навчальне видання
Методичні вказівки
до лабораторних робіт
з курсу “Аналітична хімія та інструментальні методи аналізу”
для студентів iii курсу спеціальності
«Хімічна технологія фармацевтичних препаратів»
Укладачі: Бубель Тетяна Олександрівна
Гиренко Альона Олександрівна
ГОЛОВКО Ігор Дмитрович
Редактор Л.М. Тонкошкур
Коректор В.П. Синицька
Підписано до друку 04.10.10. Формат 60841/16. Папір ксерокс. Друк різограф. Ум.-друк. акр. 3,14. Обл.-вид. арк. 3,21. Тираж 70 прим. Зам. № 50. Свідоцтво ДК № 303 від 27.12.2000.
Д ВНЗ
УДХТУ, 49005, м. Дніпропетровськ-5, просп.
Гагаріна, 8.
ВНЗ
УДХТУ, 49005, м. Дніпропетровськ-5, просп.
Гагаріна, 8.
В идавничо-поліграфічний
комплекс ІнКомЦентру
идавничо-поліграфічний
комплекс ІнКомЦентру
Зміст
Зміст 3
ВСТУП 4
1 Абсорбційна спектроскопія 5
1.2 Фотометричний метод аналізу 10
1.3 Методи визначення концентрації 11
1.4 Вимірювання інтенсивності світлопоглинання 14
Лабораторна робота № 1 16
Визначення заліза у вигляді роданідного комплексу 16
Лабораторна робота № 2 18
Визначення заліза(Ш) із сульфосаліциловою кислотою диференційним методом 18
2 Рефрактометричний аналІз 20
Лабораторна робота № 3 22
Контроль якості приготованих розчинів і визначення концентрації калію броміду в водних розчинах рефрактометричним методом 22
3 ХРОМАТОГРАФІЧНІ МЕТОДИ АНАЛІЗУ 23
3.1 Класифікація методів хроматографії 23
3.2 Іонообмінна хроматографія 26
3.3 Паперова хроматографія 27
3.4 Тонкошарова хроматографія (ТШХ) 29
Лабораторна робота № 4 29
Розділення і виявлення іонів Hg22+, Вi3+, Ni2+ методом осадової хроматографії на папері 29
4 Потенціометричний метод аналізу 30
4.1 Сутність потенціометричного методу 30
4.1.1 Виникнення електродного потенціалу 31
4.1.2 Електроди в потенціометричному методі 32
4.1.3 Дифузійний потенціал 34
4.2. Методи визначення концентрації у потенціометрії 35
4.2.1 Пряма потенціометрія (іонометрія) 35
4.2.2 Способи визначення концентрації в прямій потенціометрії 37
4.2.3 Потенціометричне титрування 38
4.2.3.1 Види потенціометричного титрування в залежності від типу хімічної реакції, що використовується 38
4.2.3.2 Способи визначення точки еквівалентності 41
Лабораторна робота № 5 42
Потенціометричне визначення рН розчинів 42
Лабораторна робота № 6 43
Потенціометричне титрування заліза діхроматом калію 43
Лабораторна робота № 7 44
Визначення хлорид- і йодид-іонів при спільній присутності їх у розчині 44
5 Електрогравіметричний метод 45
5.1 Закони електролізу 46
5.2 Напруга розкладання 47
5.3 Порядок розряду іонів 47
5.4 Електроди в електроваговому аналізі 48
5.5 Вимоги до осадів у електрогравіметрії 48
5.6 Умови проведення електролізу 48
5.6.1 Фізичні умови 48
5.6.2 Хімічні умови електролізу 49
5.7 Методи електролізу 49
Лабораторна робота № 8 52
Електролітичне визначення нікелю з сульфатно-аміачного електроліту 52
Лабораторна робота № 9 53
Визначення міді внутрішнім електролізом. 53
6 ВОЛЬТАМПЕРОМЕТРИЧНИЙ МЕТОД АНАЛІЗУ 55
6.1. Сутність вольтамперометричного методу 55
6.1.1 Електроди у полярографії 56
6.1.2 Границі поляризації електродів 56
6.1.3 Аналіз вольтамперної кривої 57
6.2 Методи вольтамперометричного аналізу 59
6.2.1 Якісний полярографічний аналіз 59
6.2.2 Кількісний аналіз. Рівняння Ільковича 61
6.2.3 Способи розрахунку концентрацій у поляграфічному аналізі 62
6.2.4. Амперметричне титрування 63
Лабораторна робота № 10 67
Амперометричне титрування заліза ванадатом амонію 67
Лабораторна робота № 11 68
Вивчення реакції міді з діетилдітіокарбаматом натрію 68
Лабораторна робота № 12 70
Амперометричне визначення фераміду 70
ВСТУП
Всі методи аналізу засновані на залежності фізико-хімічної властивості (аналітичного сигналу (АС)) від природи речовини та її вмісту в пробі, яку аналізують. В класичних методах хімічного аналізу в якості такої властивості використовується маса осаду (гравіметричний метод) чи об’єм реактиву витрачений на реакцію (титриметричний метод).
Інструментальні або фізико-хімічні методи аналізу базуються на вимірюванні за допомогою приладів певних фізичних властивостей системи як функції кількості визначуваної речовини в аналізованій пробі.
Інструментальні методи порівняно з хімічними методами мають ряд переваг:
низька межа визначення (10–5–10–10%);
експресність (час аналізу – декілька хвилин);
можливість проведення аналізу на відстані (аналіз Місячного ґрунту, атмосфери Венери, аналіз морської води на великій глибині);
можливість автоматизації процесу аналізу;
аналіз може бути проведений без руйнування аналізованого зразка.
Загальна кількість фізико-хімічних методів аналізу достатньо велика і складає кілька десятків. Найбільше практичне значення серед них мають наступні:
Спектральні та інші оптичні методи:
Залежно від характеру взаємодії речовини з електромагнітним випромінювання оптичні методи аналізу розділяють на:
|
а) атомно-абсорбційна спектроскопія; б) інфрачервона спектроскопія; в) спектрофотометрія; г) фотоколориметрія; |
– абсорбційні (базуються на вимірюванні поглинання речовиною світлового випромінювання) |
|
д) емісійна атомна спектроскопія; е) люмінесцентний аналіз; ж) рентгеноспектральні методи |
– емісійні (засновані на вимірюванні інтенсивності світла, яке випромінюється речовиною) |
|
з) турбидиметрія |
АС – інтенсивність світла, яке поглинається незабарвленою суспензією |
|
і) нефелометрія |
АС – інтенсивність світла відбитого або розсіяного суспензією |
|
й) рефрактометрія к) поляриметрія |
АС – показник заломлення АС – кут обертання площини поляризації |
2) Електрохімічні методи:
|
Метод |
Аналітичний сигнал |
|
потенціометрія вольтамперометрія електрогравіметрія кондуктометрія кулонометрія |
потенціал сила струму маса осаду електропровідність кількість електрики |
Хроматографічні методи.
В запропонованих методичних вказівках наведені деякі теоретичні основи і практичне застосування найбільш важливих методів аналізу.
1 Абсорбційна спектроскопія
Абсорбційна спектроскопія базується на вимірюванні зменшення (або ослаблення) інтенсивності випромінювання після проходження його через речовину, яку аналізують.
Розглянемо, що відбувається при взаємодії електромагнітного випромінювання з хімічною сполукою.
Атоми або молекули мають обмежене число дискретних, або квантових, рівнів енергії, нижчий з яких відповідає основному стану. Якщо системі передати достатню кількість енергії, то атоми або молекули збуджуються, тобто переходять на більш високий енергетичний рівень. Таким чином, при проходженні випромінювання через шар твердого тіла, рідини або газу відбувається селективне поглинання випромінювання з певними частотами. Електромагнітна енергія в цьому випадку передається атомам або молекулам речовини і переводить частки із нормального або основного стану у збуджений.
Залежно від довжини хвилі виділяють наступні області електромагнітного спектра (табл. 1.1).
Таблиця 1.1
Електромагнітний спектр і методи аналізу
|
Назва області |
Межі довжин хвиль |
Переходи |
Метод |
|
Дальня УФ |
30–200 нм |
Середні електрони |
|
|
Ближня УФ Видима |
200–400 нм 400–760 нм |
Валентні електрони |
УФ-спектроскопія Спектрофотометрія |
|
Ближня ІЧ
Середня ІЧ |
760–1100 нм (13000–9000 см–1) 2000–50000 нм (5000–200 см–1) |
Молекулярні коливання |
ІЧ-спектроскопія |
|
Дальня ІЧ |
>105 нм |
Молекулярні обертання |
Мікрохвильова спектроскопія, ЕПР |
С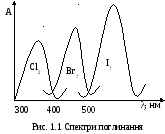 вітло
поглинається розчином вибірково, при
певних довжинах хвиль світлопоглинання
відбувається інтенсивно, а при деяких
світло не поглинається. Інтенсивно
поглинаються кванти світла, енергія
яких дорівнює енергії збудження частки.
Залежність інтенсивності світлопоглинання
від довжини хвилі падаючого світла
називають спектром
поглинання
або спектральною
характеристикою (рис.
1.1).
вітло
поглинається розчином вибірково, при
певних довжинах хвиль світлопоглинання
відбувається інтенсивно, а при деяких
світло не поглинається. Інтенсивно
поглинаються кванти світла, енергія
яких дорівнює енергії збудження частки.
Залежність інтенсивності світлопоглинання
від довжини хвилі падаючого світла
називають спектром
поглинання
або спектральною
характеристикою (рис.
1.1).
Довжина хвилі, яка відповідає максимуму поглинання є якісною характеристикою речовини, а інтенсивність поглинання – кількісною.
1.1 Закони світлопоглинання
Д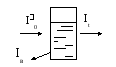 ля
кількісних визначень краще використовувати
монохроматизоване світло, а саме світло
з визначеною довжиною хвилі. Якщо на
розчин, який міститься в кюветі, спрямувати
монохроматизоване світло певної
інтенсивності І0,
то частина світла пройде (It),
частина віддзеркалиться (Iв),
частина поглинається.
ля
кількісних визначень краще використовувати
монохроматизоване світло, а саме світло
з визначеною довжиною хвилі. Якщо на
розчин, який міститься в кюветі, спрямувати
монохроматизоване світло певної
інтенсивності І0,
то частина світла пройде (It),
частина віддзеркалиться (Iв),
частина поглинається.
Щоб врахувати втрати світла на віддзеркалення і розсіяння порівнюють інтенсивність світла, яке пройшло через досліджуваний розчин і розчинник. При однаковій товщині шару в кюветах із однакового матеріалу, які містять один і той самий розчинник, втрати на віддзеркалення та розсіяння світла будуть приблизно однаковими у обох пучків і зменшення інтенсивності буде залежати від концентрації речовини.
Зменшення інтенсивності світла, яке пройшло через розчин характеризується коефіцієнтом пропускання або просто пропусканням Т:
![]() ,
,
де І і І0 відповідно інтенсивності світла, яке пройшло через розчин і розчинник (рис. 1.2).
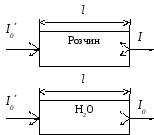
Рис. 1.2 Проходження світла
через забарвлений розчин і розчинник
Взятий зі зворотним знаком логарифм Т називається оптичною густиною А:
![]() .
.
Світлопропускання змінюється від 0 до 100%, а оптична густина від ∞ (практично 2) до 0.
Закон Бугера-Ламберта-Бера: Кількість електромагнітного випромінювання, поглинутого розчином, пропорційно концентрації поглинаючих часток і товщині шару розчину.
I=I0∙10–ε∙с∙l.
Зробивши перетворення отримуємо:
–lg![]() =A=εlc, (1)
=A=εlc, (1)
де ε – молярний коефіцієнт поглинання, л/моль∙см;
l – товщина світлопоглинаючого шару (см);
с – концентрація розчину (моль/л);
А – оптична густина розчину.
Фізичний зміст “ε” стає зрозумілим, якщо прийняти l=1 см, с=1 моль/л, тоді А=ε. Отже, молярний коефіцієнт поглинання дорівнює оптичній густині одномолярного розчину при товщині шару 1 см та характеризує інтенсивність забарвлення та чутливість визначення Відповідно до цього закону – оптична густина прямо пропорційна кількості речовини і товщині поглинаючого шару.
Молярний коефіцієнт поглинання залежить:
від природи речовини;
від довжини хвилі падаючого світла.
Відповідно рівнянню (1) залежність оптичної густини від концентрації графічно виражається прямою лінією, яка виходить з початку координат. Але лінійна залежність спостерігається у випадку виконання наступних умов:
Рис. 1.3 Відхилення від закону Бугера-Ламберта-Бера
м
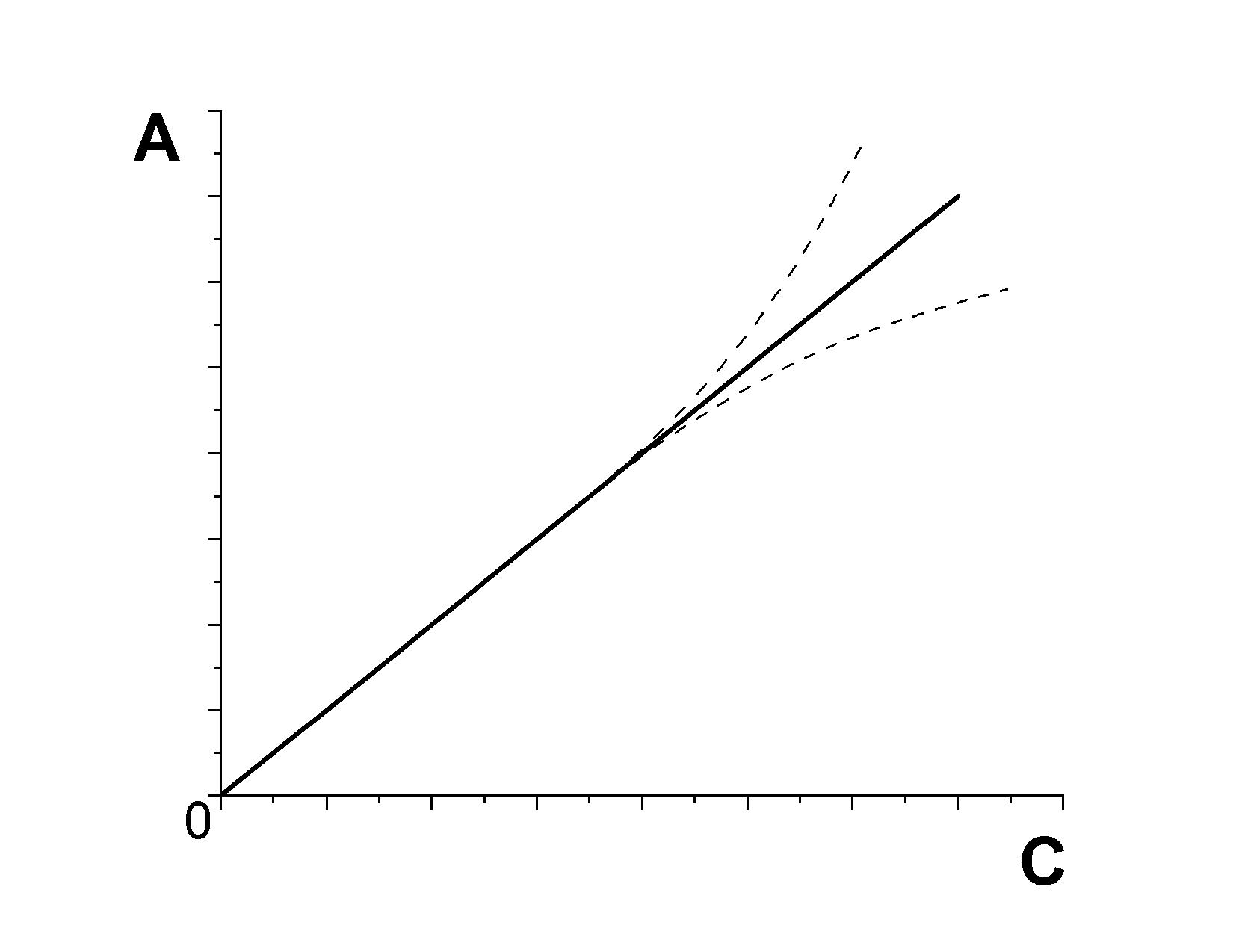 онохроматичне
світло;
онохроматичне
світло;постійність показника заломлення середовища;
постійна температура 2С;
пучок світла повинен бути паралельним;
поглинають частки одного сорту (при зміні концентрації не повинна змінюватись природа часток).
У випадку невиконання цих умов спостерігається відхилення від лінійної залежності закону Бугера-Ламберта-Бера (рис. 1.3).
Закон адитивності оптичних густин. Якщо в розчині присутні декілька світлопоглинаючих компонентів, що не вступають один з одним у хімічну реакцію, то за умови дотримання закону Бугера-Ламберта-Бера, оптична густина такого розчину буде дорівнювати сумі порційних оптичних густин усіх світлопоглинаючих компонентів, які знаходяться у розчині. В цьому проявляється принцип (або правило) адитивності.
![]() .
.
На використанні принципу адитивності засновані всі кількісні методи спектрофотометричного аналізу багатокомпонентних систем.
