
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Вязкость растворов полимеров
По вязкости растворы высокомолекулярных соединений резко отличаются от растворов низкомолекулярных веществ и золей. При одной и той же весовой концентрации вязкость растворов полимеров значительно больше вязкости растворов низкомолекулярных веществ и лиофобных золей (рис. 77), и с увеличением концентрации она резко возрастает.
Такая высокая вязкость растворов полимеров объясняется наличием в системе макромолекул, которые увеличивают силу трения при передвижении одного слоя жидкости относительно другого. Причем с уменьшение гибкости макромолекул, с возрастанием их размеров и концентрации в растворе увеличение силы трения становится все более существенным.
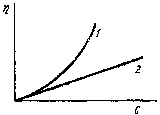
Рис. 77. Зависимость вязкости от концентрации: 1– раствора полимера;2– золя
Увеличение вязкости жидкости, связанное с присутствием в ней макромолекул полимера, принято характеризовать удельной вязкостью:
уд.=
где ηр – вязкость раствора;
η0 – вязкость чистого растворителя.
Герман
Штаудингер (1881
– 1965)
получил образование в Галле (по ботанике)
и Дармштадте и Мюнхене (по химии). С 1903
г. был ассистентом в Галле и Страсбурге,
а с 1907 г. – профессор в Карлсруэ, где вел
работы по органической химии. В 1912 г. он
переехал в Цюрих, а в 1926 г. стал руководителем
химической лаборатории в Фрейбурге,
где в 1940 г. основал Институт высокомолекулярных
соединений. Здесь были выполнены его
важнейшие исследования в этой области.
Г. Штаудингер основал новое направление
– химию высокомолекулярных соединений
на стыке органической и коллоидной
химии. После 1930 г. эта новая область
получила быстрое развитие как в части
синтеза многих практически ценных
высокополимеров, так и в отношении
изучения особенностей их структуры.
Штаудингером установлена математическая зависимость удельной вязкости раствора полимера от его молярной массы:
ηуд.=KMC
где K – константа, характерная для полимеров данного класса; С – концентрация полимера в растворе; М – молярная масса полимера.
Уравнение Штаудингера можно использовать в таком виде для разбавленных растворов полимеров, макромолекулы которых линейны, не взаимодействуют друг с другом и имеют небольшую молярную массу (меньше 80000).
При увеличении длины макромолекулы и ее гибкости используется модифицированная форма уравнения Штаудингера:
[η] = KMα
где [η] – характеристическая вязкость раствора, определяемая как lim ηуд./с; α – величина, учитывающая свертывание макромолекул, (т.е. гибкость их цепи). Она определяется опытным путем и принимает значения от 0,5 (когда форма макромолекул близка к сферической (рис. 78)), до 1 (для жестких, вытянутых в виде палочки макромолекул).

Рис. 78. Схематическое изображение молекулярного клубка в растворе
В растворах с достаточно высокой концентрацией полимера появляются ассоциаты макромолекул, которые, взаимодействуя друг с другом, могут образовывать различные пространственные структуры, затрудняющие течение жидкости. В этом случае вязкость раствора становится аномально высокой и уравнение Штаудингера к нему применять нельзя.
При увеличении скорости течения жидкости пространственные структуры полимеров могут разрушаться. В этом случае вязкость растворов полимеров уменьшается.
