
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Набухание и растворение вмс
Растворение высокомолекулярных соединений представляет собой сложный процесс, отличающийся от растворения низкомолекулярных веществ. Так, при растворении последних происходит взаимное смешение растворителя и растворяемого вещества, т.к. они имеют близкие по размерам и по скорости диффузии молекулы.
Подробно этот процесс рассматривался нами выше.
При растворении полимеров вначале происходит процесс их набухания, т.е. одностороннее проникновение небольших и подвижных молекул растворителя в полимер. Набухание сопровождается увеличением массы и размеров твердого образца полимера и является начальным этапом растворения высокомолекулярных веществ. Различаютограниченное и неограниченное набухание.
При ограниченном набуханииобъем и масса растворяемого образца полимера увеличивается до определенных пределов и дальнейший его контакт с растворителем не приводит к каким-либо изменениям. В результате ограниченного набухания полимер превращается в студень.
При неограниченном набуханииотсутствует предел набухания. Со временем образец полимера поглощает все большее количество жидкости и в результате в конечном итоге происходит его постепенное растворение.
Ограниченное набухание происходит, например, при помещении резины в гексан. Каучук в этом же растворителе набухает неограниченно.
Причиной набухания является, как уже было сказано выше, односторонняя диффузия низкомолекулярного растворителя в полимер.
Между его макромолекулами в твердом образце всегда имеются небольшие промежутки (полости или пустоты), размеры которых соизмеримы с размером молекул растворителя. Благодаря этому, последние достаточно быстро проникают в них, раздвигая молекулярные цепи. Происходит этот процесс постепенно, соседние макромолекулы удаляются друг от друга не сразу, а небольшими участками. Если макромолекулы полимера гибкие, то, благодаря их тепловому движению, диффузия растворителя облегчается. Полимеры с жесткими молекулярными цепями набухают значительно хуже.
Для многих веществ набухание включает не только диффузию жидкости в полимер, но и сольватацию его молекул. Обычно при этом сольватируется не вся макромолекула, а отдельные ее участки.
У биополимеров, макромолекулы которых состоят из полярных и неполярных групп, сольватируются полярные группы, если растворитель полярен. В неполярном растворителе, соответственно, сольватируются неполярные участки макромолекул.
В зависимости от того, каких групп в молекуле больше, полимер будет лучше набухать в том или ином растворителе. Обычно он хорошо набухает в жидкости, близкой к нему по химическому строению. Так, углеводородные полимеры типа каучуков набухают в неполярных жидкостях: гексане, бензоле. Биополимеры, в состав молекул которых входит большое количество полярных функциональных групп, например, белки, полисахариды, лучше набухают в полярных растворителях: воде, спиртах и т.д.
Процесс сольватации сопровождается разрывом межмолекулярных связей соседних макромолекул, что, в свою очередь, способствует их удалению друг от друга при набухании.
Образование сольватной оболочки молекулы полимера сопровождается выделением энергии, которая называется теплотой набухания.
Теплота набуханиязависит от природы веществ. Она максимальна при набухании в полярном растворителе ВМС, содержащего большое количество полярных групп и минимальна при набухании в неполярном растворителе углеводородного полимера.
Молекулы растворителя в сольватной оболочке более плотно упакованы (благодаря ориентации их около сольватируемых групп макромолекул) чем в самой жидкости. В результате сжатия растворителя в сольватных оболочках на первой стадии набухания, наряду с увеличение объема полимера, наблюдается уменьшение суммарного объема всей системы (рис. 73б). Данное явление называется внутренним сжатием или контракцией. В принципе оно наблюдается и в растворах низкомолекулярных соединений (особенно в концентрированных растворах).
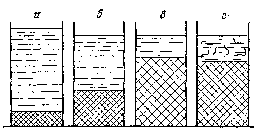
Рис. 73. Стадии ограниченного набухания: а – система полимер – растворитель до набухания;б – первая стадия набухания;в – вторая стадия набухания;г– вторая стадия набухания с частичным растворением полимера
После сольватации полимера процесс его набухания протекает быстрее, т.к. сольватированые макромолекулы легче отодвинуть друг от друга. На этой второй стадии набухания происходит основное увеличение объема твердого образца.
В конце этой стадии может происходить переход некоторого числа макромолекул полимера в растворитель (рис. 73г). Обычно на этой стадии заканчивается ограниченное набухание. Неограниченное набухание идет дальше и приводит к полному растворению полимера и образованию гомогенной системы (рис. 74).

Рис. 74. Образование истинного раствора ВМС при неограниченном набухании
Процесс набухания количественно характеризуется степенью набухания, α:
=
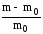 ;=
;=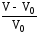
где m0, V0 – соответственно, масса и объем образца полимера до набухания; m и V – масса и объем образца полимера после набухания.
Степень и, соответственно, вид набухания зависят от многих факторов. Главными из них являются прочность межмолекулярных связей в полимере и энергия его сольватации. Если для линейного полимера на разрыв межмолекулярных связей затрачивается энергии значительно меньше, чем выделяется при сольватации, то его набухание, как правило, будет неограниченным, в противном случае полимер будет набухать ограниченно.
Поперечные (мостичные) связи между молекулами полимера приводят к ограниченному набуханию, т.к. энергии сольватации обычно недостаточно для их разрыва. Так, натуральный каучук (линейный полимер) неограниченно набухает (растворяется) в гексане, резина (вулканизированный каучук) набухает ограниченно, эбонит совершенно не набухает (т.к. в нем присутствует особенно много мостичных связей).
На степень набухания влияет также разветвленность макромолекул и их масса. Значительное воздействие оказывает температура. При ее повышении степень набухания, как правило, увеличивается. Так, желатин и агар-агар в холодной воде набухают до определенного предела, т.е. ограниченно. При нагревании они же набухают неограниченно и образуют истинные растворы.
На набухание могут влиять также такие факторы, как рН среды, присутствие в растворителе электролитов. Влияние данных факторов особенно усиливается, если их воздействие приводит к образованию или исчезновению на макромолекуле ВМС электрического заряда. Причем в первом случае интенсивность и степень набухания возрастают пропорционально заряду макромолекулы, а во втором, наоборот, – уменьшаются.
Особенно чувствительны к изменению рН среды и концентрации в растворе электролитов полимеры, содержащие в своем составе ионогенные функциональные группы. Из природных биополимеров к ним относятся белки, нуклеиновые кислоты, некоторые полисахариды.
Растворимость и степень набухания в значительной мере зависят от гибкости цепи полимера и от его молекулярной массы.
Наибольшей гибкостью обладают углеводородные цепи, не содержащие полярных группировок атомов. В неполярных растворителях многие такие вещества способны растворяться практически неограниченно.
Макромолекулы, содержащие большое число полярных групп, вследствие возникновения межмолекулярных водородных связей являются жесткими, способны образовывать небольшое число конформаций и очень часто в полярных растворителях могут только ограниченно набухать, несмотря на то, что при их сольватации выделяется значительное количество энергии.
Увеличение молекулярной массы негативно сказывается на процессе набухания и растворения полимера, т.к. при этом увеличиваются Ван-дер-Ваальсовые силы притяжения между макромолекулами. Следовательно, возрастает и энергия, затрачиваемая на их расталкивание друг от друга.
