
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Компенсационный диализ и вивидиализ
Для очистки биологических жидкостей, представляющих собой коллоидные системы, применяют компенсационный диализ,в котором вместо чистого растворителя используют физиологические растворы, содержащие в своем составе те же низкомолекулярные вещества (и в том же количестве), что в норме должны присутствовать в дисперсной системе. В результате из крови удаляются только чужеродные «шлаки», т.е. продукты метаболизма, распада тканей.
Компенсационный диализ используется для исследования состава биологических жидкостей, избирательной очистки их от строго определенных низкомолекулярных примесей. В этом случае омываемый раствор содержит только те вещества, которые нужно сохранить в исходной системе.
С помощью компенсационного диализа можно не только определить природу тех или иных примесей в биологической жидкости, но и установить их концентрацию. Разновидностью компенсационного диализа является вивидиализ, в ходе которого очистку биологической жидкости (крови) осуществляют «вживую». При этом в концы перерезанного кровеносного сосуда вставляются стеклянные канюли. Их разветвленные части соединяются между собой трубочками, стенки которых образованы полупроницаемым материалом. Вся система снаружи омывается физиологическим раствором (рис. 55).
 Рис.
55. Схема аппарата для вивидиализа
Рис.
55. Схема аппарата для вивидиализа
Сочетание вивидиализа и ультрафильтрации используется в аппарате «искусственная почка», предназначенном для очистки крови при острой почечной недостаточности.
Данное устройство оперативным путем подключают к системе кровообращения больного. Кровь под давлением, создаваемым специальным насосом, протекает в узком зазоре между двумя мембранами, омываемыми снаружи физиологическим раствором. Благодаря большой рабочей поверхности мембран (~15 000 см2) «шлаки» достаточно быстро (в течение нескольких часов) удаляются из крови, а жизненно необходимые низкомолекулярные вещества (неорганические соли, глюкоза, аминокислоты и т.п.) остаются в ней.
Молекулярно-кинетические свойства золей
На начальном этапе развития коллоидной химии утверждалось, что дисперсным системам, в отличие от истинных растворов не присущи такие молекулярно-кинетические свойства, как тепловое движение частиц дисперсной фазы, диффузия и осмос.
Эта особенность золей считалась одним из отличительных признаков. Однако использование более точных методов исследования показало, что это не так. Более того, изобретение ультрамикроскопа (1903 г.) позволило непосредственно наблюдать движение коллоидных частиц, связать интенсивность этого движения с коэффициентом диффузии.
Полученные данные показали, что в этом плане золи принципиально ничем не отличаются от истинных растворов. Только при одинаковой весовой концентрации растворенного вещества молекулярно-кинетические свойства золей в количественном соотношении выражены значительно слабее. Это объясняется бóльшими размерами коллоидных частиц и меньшей их концентрацией по сравнению с молекулами и ионами истинных растворов.
Броуновское движение
Важнейшим фактором, влияющим на молекулярно-кинетические свойства золей, является броуновское движениечастиц дисперсной фазы. Оно названо в честь английского ботаника Роберта Броуна, который впервые наблюдал его в 1827 г., исследуя под световым микроскопом взвесь цветочной пыльцы в воде. Ученый обнаружил, что частицы пыльцы непрерывно двигаются по сложным траекториям, ни на мгновение не оставаясь в покое. Причину данного движения долгое время установить не могли и считали его проявлением особенностей исключительно живой материи. Однако такое объяснение вскоре было отвергнуто, т.к. обнаружили, что подобное непрерывное движение могут совершать и неорганические частицы, взвешенные в жидкости или газе.
Таким образом, была установлена универсальность броуновского движения.
Дальнейшие исследования показали, что отдельные частицы двигаются совершенно независимо одна от другой. Их перемещение происходит тем интенсивнее, чем меньше размеры частиц и вязкость среды и совершенно не зависят от природы измельченного вещества.
В свободно-дисперсных системах с газовой или жидкой дисперсионной средой коллоидные частицы также не зафиксированы в каких-то определенных позициях. Они участвуют в броуновском движении, которое является прямым следствием теплового движения молекул растворителя и их беспорядочных ударов о данную частицу. Причем чем меньше размеры частицы, тем меньшее число молекул ударяется о ее поверхность. Это, в свою очередь, приводит к тому, что различия по числу и силе ударов с каждой стороны частицы становятся более значительными. Частица в любой момент времени движется в ту сторону, с которой результирующая величина ударов меньше. Само ее движение является скачкообразным и хаотическим. Скачки совершаются с большой частотой и в произвольном направлении, то есть независимо от того, каким был предшествующий скачок. Кроме того, скачки имеют разную длину. Установлено, что коллоидная частица изменяет направление своего движения приблизительно 1012раз за 1 секунду. Проследить действительный путь частицы при
Мариан
Смолуховский (1872 – 1917),
польский физик-теоретик. Окончил
университет в Вене (1894), в 1896-1897 работал
в университетах Парижа, Глазго и Берлина.
С 1900 профессор Львовского университета
(позднее ректор), с 1913 профессор Краковского
университета. Основные труды по
статистической физике. Работы Смолуховского
по теории флуктуаций (1904) и броуновского
движения (1906) наряду с работами Альберта
Эйнштейна являются основополагающими
в этой области. Смолуховский создал на
основе теории броуновского движения
кинетическую теорию коагуляции коллоидов,
теорию электрокинетических явлений,
заложив фундамент кинетической теории
коллоидных систем. 
таком движении не представляется возможным. Поэтому за меру, характеризующую интенсивность броуновского движения, принимают так называемое смещение частицы или ее сдвиг (∆Х).Это проекция расстояния между двумя положениями частицы (А и В) за времяt, разделяющее два смежных наблюдения (рис. 56).
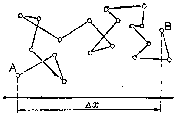
Рис. 56. Схема броуновского движения частицы
Смещения частицы
за одинаковые промежутки времени tобычно не совпадают как по величине,
так и по направлению, поэтому на практике
используют так называемый среднеквадратичный
сдвиг частицы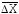 :
:
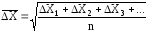
где ∆Х1, ∆Х2, ∆Х3, … – отдельные проекции смещения частицы за одно и то же время t; n – число определяемых проекций смещения частицы за определенное время t.
Точную количественную оценку броуновского движения частицы можно дать с помощью уравнения Смолуховского-Эйнштейна:
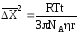
где NА – число Авогадро;
η – вязкость дисперсионной среды;
r – радиус частицы дисперсной фазы;
T – температура раствора;
t – время, за которое происходит смещение частицы.
Таким образом, скорость броуновского движения коллоидных частиц изменяется лишь в зависимости от их радиуса и вязкости дисперсионной среды. При этом природа самой частицы на ее движение влияния не оказывает.
Если размеры и масса частиц дисперсной фазы превышают определенные пределы, вероятность взаимной компенсации ударов с различных направлений оказывается значительно выше.
Так, частицы размером 4 · 10–6 м ÷ 5 · 10–6 м совершают только небольшие колебательные движения около некоторого центра. При более крупных размерах частиц их броуновское движение в любом виде не наблюдается.
В связи с этим грубодисперсные системы не обладают молекулярно-кинетическими свойствами. Именно на этом отличии базируется классификация дисперсных систем на высокодисперсные и грубодисперсные.
Основной причиной движения крупных дисперсных частиц служит различие плотностей дисперсной фазы (ρф) и дисперсионной среды (ρс). Если плотность дисперсной фазы больше (ρф> ρс), то частицы постепенно оседают вниз под действием силы тяжести. Этот процесс называютседиментацией. Более легкие дисперсные частицы (ρс> ρф), наоборот, постепенно всплывают вверх. Этот процесс называютобратной седиментацией.
