
- •Предисловие
- •Химическая термодинамика, как теоретическая основа биоэнергетики Предмет, методы и основные понятия химической термодинамики
- •Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные
- •Термодинамические параметры
- •Внутренняя энергия системы
- •Форма обмена энергии с окружающей средой
- •Первое начало термодинамики. Тепловые эффекты химических реакций
- •1. В изолированной системе сумма всех видов энергии есть величина постоянная.
- •Изобарный и изохорный процессы. Энтальпия. Тепловые эффекты химических реакций
- •Термохимия. Закон Гесса
- •Влияние температуры и давления на тепловой эффект реакции
- •Использование закона Гесса в биохимических исследованиях
- •Энтропия. Второй закон термодинамики Энтропия
- •Второе начало термодинамики. Свободная энергия Гиббса
- •Принцип энергетического сопряжения
- •Химическое равновесие Обратимые и необратимые реакции. Константа равновесия
- •Смещение химического равновесия. Принцип Ле-Шателье
- •Учение о растворах Растворы
- •Физические свойства н2о и строение ее молекул
- •Механизм образования растворов
- •Растворимость веществ. Факторы, влияющие на растворимость
- •Влияние природы веществ на растворимость
- •Влияние давления на растворимость веществ
- •Влияние температуры на растворимость веществ
- •Влияние электролитов на растворимость веществ
- •Взаимная растворимость жидкостей
- •Способы выражения состава растворов
- •Термодинамические аспекты процесса растворения. Идеальные растворы
- •Коллигативные свойства разбавленных растворов
- •Диффузия и осмос в растворах
- •Роль осмоса в биологических процессах
- •Давление насыщенного пара растворителя над раствором. Закон Рауля
- •Следствия из закона Рауля
- •1) Растворы кипят при более высокой температуре, чем чистый растворитель;
- •2) Растворы замерзают при более низкой температуре, чем чистый растворитель.
- •Применение методов криоскопии и эбуллиоскопии
- •Коллигативные свойства растворов электролитов. Изотонический коэффициент Вант-Гоффа
- •Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Диссоциация воды. Водородный показатель
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Буферные системы человеческого организма
- •Нарушения кислотно-оснóвного равновесия крови. Ацидоз. Алкалоз
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скорости химической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
- •Физическая химия дисперсных систем Определение дисперсных систем
- •Классификация дисперсных систем и их общая характеристика
- •Классификация дисперсных систем по агрегатному состоянию вещества дисперсной фазы и дисперсионной среды
- •Классификация по взаимодействию между частицами дисперсной фазы или степени структурированности системы
- •Классификация по характеру взаимодействия дисперсной фазы с дисперсионной средой
- •Методы получения дисперсных систем
- •Диспергирование жидкостей
- •Диспергирование газов
- •Конденсационные методы
- •Методы физической конденсации
- •Методы химической конденсации
- •Очистка золей
- •Компенсационный диализ и вивидиализ
- •Молекулярно-кинетические свойства золей
- •Броуновское движение
- •Диффузия
- •Седиментация в золях
- •Осмотическое давление в золях
- •Оптические свойства золей
- •Рассеяние света (опалесценция)
- •Оптические методы исследования коллоидных систем Ультрамикроскоп
- •Механизм образования и строение коллоидной частицы – мицеллы
- •1. Получение золя берлинской лазури:
- •2. Получение с помощью гидролиза FeCl3 золя гидроксида железа (III).
- •3. Получение золя As2s3:
- •Электрокинетические свойства золей
- •Устойчивость гидрофобных коллоидных систем. Коагуляция золей Виды устойчивости золей
- •Теория коагуляции Дерягина-Ландау-Фервея-Овербека
- •Влияние электролитов на устойчивость золей. Порог коагуляции. Правило Шульца-Гарди
- •Чередование зон коагуляции
- •Коагуляции золей смесями электролитов
- •Скорость коагуляции
- •Коллоидная защита
- •Роль процессов коагуляции в промышленности, медицине, биологии
- •Растворы высокомолекулярных соединений
- •1) Своеобразное тепловое движение частиц растворенного вещества, схожее с броуновским движением мицелл в золях;
- •Общая характеристика высокомолекулярных соединений
- •Классификация полимеров
- •Набухание и растворение вмс
- •Термодинамические аспекты процесса набухания
- •Давление набухания
- •Свойства растворов высокомолекулярных соединений
- •Осмотическое давление растворов вмс
- •Онкотическое давление крови
- •Вязкость растворов полимеров
- •Свободная и связанная вода в растворах
- •Полиэлектролиты
- •Факторы, влияющие на устойчивость растворов полимеров. Высаливание
- •Электрохимия растворы электролитов как проводники второго рода. Электропроводность растворов электролитов
- •Эквивалентная электропроводность растворов
- •Практическое применение электропроводности
- •Равновесные электродные процессы
- •Металлический электрод
- •Измерение электродных потенциалов
- •Окислительно-восстановительные электроды
- •1. Переход окисленной формы в восстановленную и наоборот заключается только в обмене между ними электронами:
- •Диффузионный и мембранный потенциалы
- •Химические источники электрического тока. Гальванические элементы
- •Потенциометрия
- •Содержание
Диспергирование жидкостей
Для диспергирования жидкостей и получения мелких капель в аэрозолях и эмульсиях используют преимущественно механические методы: встряхивание, быстрое перемешивание, сопровождаемое кавитационными разрывами, воздействие ультразвука. Применяют также распыление при быстром течении жидкости через тонкие отверстия.
Процессы диспергирования жидкостей имеют большое прикладное значение в энергетике – для обеспечения эффективного сжигания жидкого топлива; в медицине – при приготовлении эмульсионных систем.
Диспергирование газов
Для получения газовых пузырьков в жидкости применяют несколько вариантов диспергирования:
1) барботирование–прохождение газовой струи через жидкость с достаточно большой скоростью;при этом струя становится неустойчивой и начинает дробиться на отдельные небольшие пузырьки;
2) одновременное течение жидкости и газа через устройства, которые смешивают эти потоки,в результате чего формируются газовые пузырьки; в качестве диспергирующих устройств используют пористые перегородки, узкие трубки, мембраны, сопла и т.п.
Процессы диспергирования активно протекают в природе. Приливно-отливные явления океанов и морей, разрушающее действие прибоя, резкие колебания температур, ветер и другие явления развивают колоссальные силы, которые дробят горные породы до дисперсных частиц. Постоянное действие ледников и рек также приводит к интенсивным процессам измельчения слагающих пород.
Мощным фактором механического диспергирования является расширение воды при ее замерзании. Проникая глубоко в трещины породы и замерзая там, вода вызывает дробление ее на частицы различного размера (в том числе и коллоидного).
Громадные массы осадочных отложений, которые мы встречаем в природе – это результат длительного диспергирования твердых горных образований.
Конденсационные методы
Эти методы позволяют получить дисперсные частицы с любыми размерами, в том числе и 10–8– 10–9м. Поэтому они широко применяются в нанотехнологиях, коллоидной химии. Различаютметоды физической конденсациииметоды химической конденсации. И в том, и в другом случае дисперсные частицы образуются в виде новой фазы из исходной гомогенной среды. Общим условием для их возникновения является состояние пресыщения раствора или пара, которое достигается изменением параметров равновесной системы (температуры, давления). Чем больше возникает в исходной системе зародышей новой фазы и чем меньше скорость их образования, тем выше степень дисперсности получаемых частичек.
Методы физической конденсации
Конденсацией паров различных веществ в газовой среде получают аэрозоли.В природных условиях таким образом образуются туман, облака.Совместной конденсацией нерастворимых друг в друге веществ можно получать лиозоли, например, коллоидный раствор натрия в бензоле.
Лиозоли металловполучают и с помощью электрического метода. Сущность его заключается в образовании вольтовой (электрической) дуги между электродами из металла, которые погружены в охлаждаемую жидкость с высокой диэлектрической проницаемостью (например, в Н2О). В дуге под действием высокой температуры металл электродов испаряется, а затем его пары конденсируются в жидкости с образованием коллоидных частиц (рис. 50).
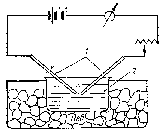
Рис. 50. Схема прибора для электрического диспергирования: 1 – металлические электроды; 2 – сосуд с охлаждаемой водой
Для получения твердых дисперсных частиц с помощью кристаллизации из раствора используют метод замены растворителя. Он заключается в том, что истинный раствор вещества при постоянном перемешивании приливают к растворителю, в котором исходное вещество практически нерастворимо. Возникающее пресыщение приводит к образованию дисперсных частиц.
Так, если спиртовой раствор канифоли небольшими порциями прибавлять в Н2О, то образуется коллоидный раствор канифоли в воде. В данном случае спирт хорошо смешивается с Н2О, а канифоль плохо в ней растворяется и поэтому выделяется в виде высокодисперсной фазы. Кроме канифоли, этим методом можно получить золи серы, фосфора, мастики и т.п.
Растворители, используемые в данном методе, должны неограниченно смешиваться друг с другом.
