
MolFiz_2012_v2
.pdfСистема с P=const и S=const
Неравенство Клаузиуса δQ<TdS и первое начало термодинамики позволяют записать
dU PdV TdS 0.
Поскольку для рассматриваемой системы
P=const и S=const, значит
dU PdV d U PV dH 0,
т.е. в системе могут самопроизвольно
происходить лишь процессы с уменьшением
энтальпии. Следовательно, устойчивым является состояние при минимуме энтальпии.
231
Система с T=const и P=const
Неравенство Клаузиуса δQ<TdS и первое начало термодинамики позволяют записать
dU PdV TdS 0.
Поскольку для рассматриваемой системы
T=const и P=const, значит
dU PdV TdS d H TS dG 0,
т.е. в системе могут самопроизвольно
происходить лишь процессы с уменьшением
функции Гиббса. Следовательно, устойчивым является состояние при
минимуме функции Гиббса.
232
Принцип Ле Шателье – Брауна
Принцип Ле Шателье — Брауна: если на систему, находящуюся в устойчивом
термодинамическом равновесии,
воздействуют внешние факторы,
стремящиеся вывести ее из этого состояния,
то в системе возникают процессы, стремящиеся уничтожить изменения,
вызываемые внешними воздействиями.
233
Молекулярная физика
Тема 16:
Реальный газ
234
Содержание
•Силы межмолекулярного взаимодействия. Потенциал межмолекулярного взаимодействия.
•Уравнение Ван-дер-Ваальса. Вириальное уравнение состояния.
•Изотермы газа Ван-дер-Ваальса. Метастабильные состояния. Критическое состояние.
•Приведенное уравнение состояния. Закон соответственных состояний.
•Экспериментальные изотермы. Сравнение уравнения Ван-дер-Ваальса с экспериментальными данными.
•Внутренняя энергия газа Ван-дер-Ваальса.
•Эффект Джоуля-Томсона. Сжижение газов.
235
Силы межмолекулярного взаимодействия
Существует в основном два типа связей атомов в молекуле.
1. Ионная связь. В некоторых случаях имеются электрон или несколько электронов, которые очень слабо связаны с атомом в целом. Эти электроны легко теряются атомом, в результате чего образуется положительно заряженный ион. В других случаях, наоборот, не только все электроны очень крепко связаны
сатомом, но при благоприятных условиях атом охотно захватывает электрон или даже два электрона и превращается в отрицательно заряженный ион. Такие атомы при образовании молекулы превращаются в ионы
сотрицательным знаком заряда. Между ионами
действуют кулоновские силы притяжения, которые и обеспечивают образование молекулы. К числу таких молекул относится, например, молекула хлористого натрия NaCl.
236
Силы межмолекулярного взаимодействия
2. Ковалентная связь. Ионная связь не в состоянии объяснить существование молекул, состоящих из двух одинаковых атомов, таких, например, как Н2, 02, N2 и др., потому что два атома входят в молекулу равноправно и нет оснований для одного из них стать положительным ионом, а для другого — отрицательным. Существующая в таких молекулах связь между атомами называется ковалентной. Механизм образования этой связи основан на обобществлении электронов при сближении двух атомов, т.е. оба атома притягиваются кулоновскими силами к электронному сгустку, образованному их электронами.
237
Ван-дер-Ваальсова связь
При сравнительно больших расстояниях между молекулами действуют силы притяжения, называемые
силами Ван-дер-Ваальса. Эти силы возникают вследствие того, что при небольшом смещении отрицательных и положительных зарядов в нейтральной молекуле она перестает быть нейтральной в электрическом отношении, превращаясь в электрический диполь, т.е. совокупность разноименных, одинаковых по абсолютному значению, расположенных на близком друг от друга расстоянии зарядов. При сближении молекул электрические поля составляющих их зарядов быстро меняются во времени и лишь в среднем компенсируют друг друга в различных точках пространства. Поэтому при сближении молекулы поляризуют друг друга, причем обращенные друг к другу стороны поляризованных молекул обладают зарядами противоположного знака. Такие взаимно поляризованные молекулы притягивают
друг друга. |
238 |
|
Потенциал межмолекулярного взаимодействия
На малых расстояниях между молекулами действуют силы отталкивания (кулоновские и др.). Это является просто выражением того факта, что молекула занимает некоторую область пространства и препятствует другим молекулам проникать в эту область. Эти силы проявляются в очень малой области, порядка размеров молекулы. На больших расстояниях между молекулами действуют силы притяжения (ван-дер-ваальсовы). Поэтому, поскольку силы притяжения и отталкивания имеют разные знаки, должно существовать такое расстояние между молекулами r0, где силы компенсируют друг друга. Приближенный вид
потенциала межмолекулярного взаимодействия (потенциала Леннарда-Джонса), как функции
расстояния между молекулами r, имеет вид |
|
|||||||||||
|
d |
d |
6 |
|
где u0 – постоянная; d – расстояние, |
|||||||
|
|
|
12 |
|
|
|
|
|
|
|
||
u u0 |
|
|
|
|
|
|
, |
на котором притяжение между |
|
|||
|
|
молекулами сменяется их |
|
|||||||||
|
|
r |
r |
|
|
|
239 |
|||||
|
|
|
|
|
|
|
|
|
|
|
отталкиванием. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
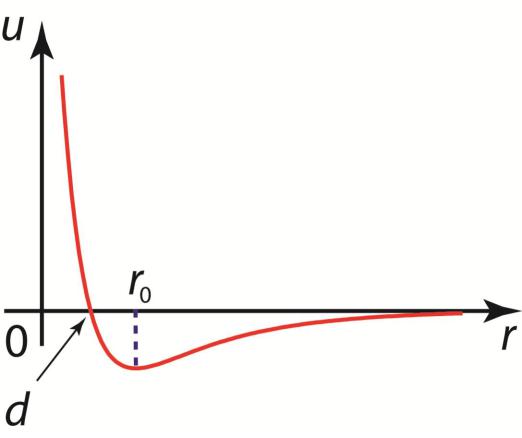
Потенциал Леннарда-Джонса
На некотором расстоянии r0 между молекулами образуется минимум энергии их взаимодействия,
т.е. устойчивое состояние двух молекул.
240
