
- •Справочный материал по Физиологии.
- •Глава 24 – Кровь.
- •Функции крови
- •Общий анализ крови
- •Объёмы крови
- •Реологические свойства
- •Липопротеины
- •Осмотическое и онкотическое давление
- •Кислотно-щелочное равновесие
- •Химические буферные системы
- •Клеточные элементы крови
- •Гемопоэз
- •Эритроциты
- •Гемоглобин
- •Метаболизмгемоглобина
- •Метаболизмжелеза
- •Фолиеваякислотаивитаминb12
- •Эритроцитарные антигены и группы крови
- •Редкиесистемы
- •Переливание крови
- •1. Общие положения
- •3. Техника иммуносерологических исследований
- •4. Пробы на индивидуальную совместимость крови донора и реципиента
- •Определениегруппыкрови(системаАв0)
- •Определениегруппыкровисистемыab0спомощьюстандартныхизогемагглютинизирующихсывороток
- •Определениегруппыкровипосистемеав0спомощьюмоноклональныхат
- •Лейкоциты
- •Определениелейкоцитарнойформулы
- •Возрастныеизмененияклетоккрови
- •Продолжительностьжизнилейкоцитов
- •Нейтрофилы
- •Эозинофилы
- •Базофилы
- •Моноциты
- •Кровяные пластинки
- •Гемостаз
Гемоглобин
Практически весь объём эритроцита заполняет дыхательный белок — гемоглобин(Hb). Молекула Hb — тетрамер, состоящий из 4 субъединиц — полипептидных цепей глобина (2 цепии 2 цепей,,,,,в разных комбинациях), каждая из которых ковалентно связана с одной молекулой гема.Гемпостроен из 4 молекул пиррола, образующих порфириновое кольцо, в центре которого находится атом железа (Fe2+). Основная функция Hb — перенос O2. Существует несколько типов Hb, образующихся на разных сроках развития организма, различающихся строением глобиновых цепей и сродством к кислороду.ЭмбриональныеHb(‑ и‑цепи) появляются у 19‑дневного эмбриона, присутствуют в эритроидных клетках в первые 3–6 мес беременности.ФетальныйHb(HbF —22) появляется на 8–36 нед беременности и составляет 90–95% всего Hb плода. После рождения его количество постепенно снижается и к 8 мес составляет 1%.ДефинитивныеHb— основные Hb эритроцитов взрослого человека (96–98% — HbA (A1,) —22, 1,5–3% — HbA2—22). Известно более 1000 мутаций разных глобинов, значительно изменяющих свойства Hb, в первую очередь — способность транспортировать O2.
HbH— гомотетрамер, образующийся при ингибировании синтеза‑цепи. Транспорт O2. не эффективен, развивается синдром, схожий с талассемией (у гетерозигот по двум генам‑талассемии).
HbM— группа аномальных Hb, у которых замещение одной аминокислоты способствует образованию MetHb (хотя активность метгемоглобинредуктазы нормальна), гетерозиготы имеют врождённую метгемоглобинемию, гомозиготы погибают в ходе внутриутробного развития.
HbS— аномальный Hb (мутация в 6‑м положении‑цепи), у гетерозигот имеются серповидно-клеточные эритроциты (HbS от 20 до 45%, остальное — HbA, анемии нет), у гомозигот развивается серповидно-клеточная анемия (HbS — 75‑100%, остальное — HbF или HbA2).
БартаHb[Bart — фамилия пациента, у которого впервые обнаружен этот Hb] — гомотетрамер, встречающийся у раннего эмбриона и при‑талассемии, не эффективен как переносчик O2.
HbF— основной Hb эритроцитов плода, имеет большее сродство к O2, чем дефинитивные Hb. Увеличение содержания HbF наблюдают при некоторых гемоглобинопатиях, гипопластических и витамин B12‑дефицитной анемиях, остром лейкозе, у постоянно находящихся в условиях высокогорья.
Определениегемоглобина. В настоящее время в качестве унифицированного признан цианметгемоглобиновый (гемиглобинцианидный) метод определения Hb крови. Данный метод основан на том, что после взаимодействия с железосинеродистым калием (красная кровяная соль) Hb окисляется в метгемоглобин (гемиглобин), который под влиянием CN-ионов образует окрашенный в красный цвет комплекс — цианметгемоглобин (гемиглобинцианид). Концентрацию цианметгемоглобина измеряют на фотоэлектрокалориметре и расчёт концентрации Hb производят по калибровочному графику.
Ранее был широко распространён метод определения Hb с помощью гемометра Сали, представляющего собой небольшой штатив, в гнездах которого расположены градуированная пробирка и две запаянные пробирки со стандартным окрашенным раствором. Градуированной пипеткой насасывают выступающую из прокола кожи кровь до отметки 0,02 (20 мкл) и осторожно выдувают в градуированную пробирку гемометра с 0,1 н раствором соляной кислоты, перемешивают стеклянной палочкой и вставляют пробирку в гнездо гемометра между пробирками со стандартным раствором. В пробирку с испытуемым раствором добавляют дистиллированную воду по каплям до тех пор, пока цвет испытуемого и стандартного растворов не совпадёт. По шкале пробирки определяют уровень жидкости, который соответствует концентрации Hb.
Формыгемоглобина. В эритроцитах Hb находится в восстановленной (HbH) и/или окисленной (HbO2) формах, а также в виде гликозилированного Hb. В ряде случае возможно присутствие карбоксигемоглобина и метгемоглобина.
Оксигемоглобин. В лёгких при повышенном pO2Hb связывает (ассоциирует) O2, образуя оксигемоглобин (HbO2), в этой форме HbO2переносит O2от лёгких к тканям, где O2легко освобождается (диссоциирует), а HbO2становится дезоксигенированным Hb (обозначают как HbH). Для ассоциации и диссоциации O2 необходимо, чтобы атом железа гема был в восстановленном состоянии (Fe2+). При включении в гем трёхвалентного железа (Fe3+) образуется метгемоглобин — очень плохой переносчик O2.
Метгемоглобин(MetHb) — Hb, содержащий Fe гема в трёхвалентной форме (Fe3+); не переносит О2; прочно связывает O2, так что диссоциация последнего затруднена. Это приводит к метгемоглобинемии и неизбежным нарушениям газообмена. Образование MetHb может быть наследственным или приобретённым. В последнем случае это результат воздействия на эритроциты сильных окислителей. К ним относят нитраты и неорганические нитриты, сульфаниламиды и местные анестетики (например, лидокаин).
Карбоксигемоглобин— плохой переносчик кислорода. Hb легче (примерно в 200 раз), чем с O2, связывается с монооксидом углерода СО (угарный газ), образуя карбоксигемоглобин (O2замещён CO).
ГликозилированныйHb(HbА1с) — HbА (A1), модифицированный ковалентным присоединением к нему глюкозы (норма HbA1C5,8–6,2%). К одним из первых признаков сахарного диабета относят увеличение в 2–3 раза количества HbA1C. Этот Hb имеет худшее сродство к кислороду, чем обычный Hb.
Транспорткислорода. Кровь ежедневно переносит из лёгких в ткани около 600 л О2. Основной объём О2транспортирует HbO2(O2обратимо ассоциирован с Fe2+гема, это так называемый химически связанный O2[неверный по существу, но — к сожалению — устоявшийся термин]). Незначительная часть O2растворена в крови (физически растворённый O2). Содержание O2в крови в зависимости от парциального давления O2(Po2) представлено на рис. 24–10.
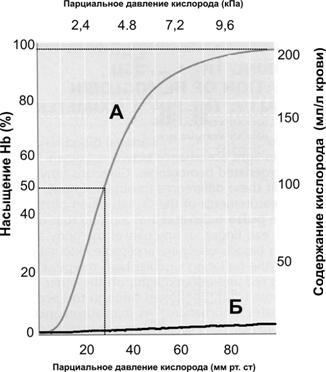
Рис.24–10.Содержаниекислородавкрови[23].А— ассоциированный с Hb O2.Б— физически растворённый в крови O2. Обратите внимание, что кривая А (в отличие от кривой Б) не имеет линейного характера, это так называемая S-образная (сигмовидная) кривая; такая форма кривой отражает то обстоятельство, что 4 субъединицы Hb связываются с O2кооперативно. Это обстоятельство имеет важное физиологическое значение: при конкретных и разных (!) значениях Po2в артериальной и в смешанной (венозной) создаются наиболее благоприятные условия для ассоциации Hb и O2в капиллярах лёгкого и для диссоциации Hb и O2в тканевых капиллярах. В то же время в плазме крови физически растворена только небольшая часть О2(максимально 6%); физическую растворимость О2описывает закон Генри (уравнение 24–6): с увеличением Po2содержание О2линейно возрастает.
Физическаярастворимостьгазовможет быть описана законом Генри (уравнение 24–6).
Уравнение24–6
Сх=хРх
где: Cx— концентрация газа;х— коэффициент растворимости газа Px— парциальное давление газа.
КооперативностьсвязыванияО2иHbпоказана на рис. 24–11.
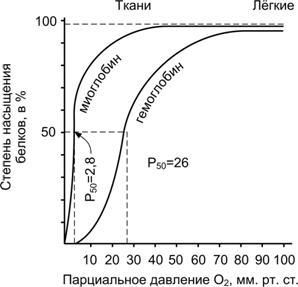
Рис.24–11.Кривыедиссоциациикислородадлямиоглобинаигемоглобинавзависимостиотпарциальногодавлениякислорода[9].
Из графика видно, что кривые диссоциации О2для миоглобина и гемоглобина различны.
КриваядиссоциацииО2длямиоглобинаимеет вид простой гиперболы — очевидное указание на то, что на обратимое связывание мономерного (не складывающегося — в отличие от Hb — из субъединиц) миоглобина мышечной ткани и О2влияет только Po2. Миоглобин имеет очень высокое сродство к О2.. Даже при Po2, равном 1–2 мм рт.ст., миоглобин остаётся связанным с О2на 50%. Миоглобин связывает О2., который в капиллярах скелетных мышц высвобождает Hb, но и сам миоглобин может освобождать О2в ответ на возрастание потребностей в нём мышечной ткани и при интенсивном использовании О2в результате физической нагрузки.
КриваядиссоциацииО2длягемоглобинаимеет сигмоидную форму (S-образную). Это указывает на то, что субъединицы Hb работают кооперативно: чем больше О2связывают (отдают) субъединицы, тем легче идёт ассоциация (диссоциация) последующих молекул О2. Из графика на рис. 24–11 также видно, что Hb (в отличие от миоглобина) имеет значительно более низкое сродство к О2; полунасыщение гемоглобина О2наступает при более высоком давлении О2(около 26 мм рт.ст.). В капиллярах покоящихся мышц, где давление О2составляет около 40 мм рт.ст., большая часть кислорода возвращается в составе оксигемоглобина обратно в лёгкие. При физической работе Po2в мышечных капиллярах падает до 10–20 мм рт.ст. Именно в этой области (от 10 до 40 мм рт.ст.) располагается «крутая часть» S-образной кривой, где в наибольшей степени проявляется свойство кооперативной работы субъединиц.
Физическирастворённыйвкровигаз. Согласно закону Генри, количество растворённого в крови O2(любого газа) пропорционально Po2(парциальному давлению любого газа) и коэффициенту растворимости конкретного газа. Физическая растворимость O2в крови примерно в 20 раз меньше, чем растворимость СО2, но для обоих газов незначительна. В то же время физически растворённый в крови газ — необходимый этап транспорта любого газа (например, при перемещении O2в эритроцит из полости альвеол).
Кислороднаяёмкостькрови— максимальное возможное количество связанного с Hb О2— теоретически составляет 0,062 ммоль О2(1,39 мл О2) на 1 г Hb (реальное значение несколько меньше — 1,34 мл О2на 1 г Hb). Измеренные же значения составляют для мужчин 9,4 ммоль/л (210 мл О2/л), для женщин — 8,7 ммоль/л (195 мл О2/л).
Насыщение(сатурация, S)HbО2(So2) зависит от парциального давления кислорода (Po2) и фактически отражает содержание оксигенированного Hb (HbО2, см. кривую А на рис. 24–10, рис. 24–11). So2может принимать значения от 0 (HbО2нет) до 1 (нет HbH). При половинном насыщении (S0,5) Po2равно 3,6 кПа (27 мм рт.ст.), при S0,75— 5,4 кПа, при S0,9813,3 кПа. Другими словами (см. кривую А на рис. 24–10) зависимость между So2и Po2не является линейной (характерная S-образная кривая), что благоприятствует как связыванию О2в лёгких (артериальная кровь) и транспорту О2, так и освобождению О2в кровеносных капиллярах органов и тканей, так как насыщение артериальной крови кислородом (SAo2) составляет примерно 97,5%, а венозной крови (SVo2) — 75%.
Характернасыщения(см. кривая А на рис. 24–10, рис. 24–11, рис. 24–12) таков, что кривая существенно уплощается при Po2около 70 мм рт.ст. Так, при Po2ниже 60 рт.ст. кислород хорошо связывается с Hb, но уже при Po260 мм рт.ст. насыщение составляет 90%, и дальнейшее увеличение Po2относительно слабо сказывается на насыщении (увеличение Po2от 60 до 100 мм рт.ст. увеличивает насыщение всего на 7%). Другими словами, в этом диапазоне Po2насыщение O2благоприятно для обеспечения его транспорта. Совершенно иная картина складывается при значениях Po2ниже 60 мм рт.ст., т.е. при небольших изменениях Po2из Hb освобождается существенные количества O2, что облегчает его диффузию из крови в ткани.
Насыщение O2описывает уравнение 24–7:
Уравнение24–7
So2=[HbО2]/([HbH]+[HbО2])
где: HbО2— оксигенированный Hb, HbH — дезоксигенированный Hb.
АффинитетHbкО2, т.е. насыщение Hb О2при конкретном Po2изменяет ряд факторов (температура, pH и Pco2, 2,3-бифосфоглицерат; рис. 24–12).
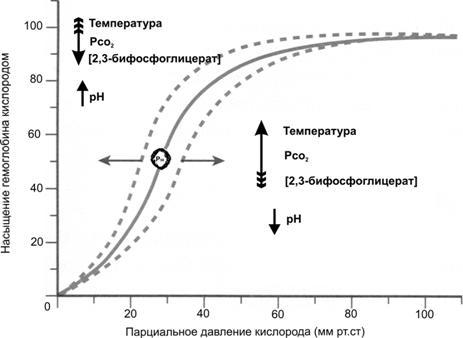
Рис.24–12.ДиссоциацияоксигемоглобинавкровивзависимостиотPo2[4]. В зависимости от изменений (указаны стрелками) температуры, pH, Pco2крови и концентрации 2,3-бифосфоглицерата в эритроцитах кривая насыщения гемоглобина O2сдвигается вправо (что означает меньшее насыщение кислородом) или влево (что означает большее насыщение кислородом). На кривой кружочком отмечена позиция, соответствующая половинному насыщению (S0,5).
pH,Pco2иэффектБора. Особенно существенно влияние pH:уменьшениеводородного показателя (сдвиг в кислую сторону — в зону ацидоза) сдвигает кривую диссоциации Hb вправо (что способствует диссоциации О2), тогда какувеличениеpH (сдвиг в щелочную сторону — в зону алкалоза) сдвигает кривую диссоциации Hb влево (что увеличивает аффинитет О2). Эффекты же Pco2на кривую диссоциации оксигемоглобина реализуются преимущественно через изменение значений водородного показателя: при поступлении CO2в кровь происходит уменьшение pH, что способствует диссоциации О2и его диффузии из крови в ткани. Напротив, в лёгких CO2диффундирует из крови в альвеолы, что приводит к увеличению pH, т.е. способствует связыванию О2с Hb. Этот влияние CO2и H+на аффинитет О2к Hb известно какэффектКристианаБора(отец великого физика Нильса Бора). Таким образом, эффект Бора обусловлен преимущественно изменением pH при увеличении содержания CO2и лишь частично — связыванием CO2с Hb (см. далее). Физиологическое следствие эффекта Бора — облегчение диффузии O2из крови в ткани и связывание O2артериальной кровью в лёгких.
Температура. Значение влияния температуры на аффинитет Hb к О2у гомойотермных животных теоретически отсутствует, но может оказаться важным при ряде ситуаций. Так, при интенсивной мышечной нагрузке температура тела увеличивается, что приводит к сдвигу кривой диссоциации вправо (увеличивается поступление О2в ткани). При понижении температуры (особенно пальцев, губ, ушной раковины) кривая диссоциации сдвигается влево, т.е. увеличивается аффинитет О2; следовательно, увеличения поступления О2, в ткани не происходит.
2,3-Бифосфоглицерат(БФГ) — промежуточный продукт гликолиза — содержится в эритроцитах примерно в той же молярной концентрации, что и Hb. БФГ связывается с Hb (в основном за счёт взаимодействия с‑субъединицей, т.е. с дефинитивными Hb, но не с фетальным Hb, в составе которого нет‑субъединицы). Связывание БФГ с Hb сдвигает кривую диссоциации Hb вправо (см. рис. 24–12), что способствует диссоциации О2при умеренных значениях Po2(например, в тканевых капиллярах), но практически не влияет на кривую диссоциации при высоких значениях Po2(в капиллярах лёгкого). Существенно, что при усилении гликолиза (анаэробного окисления) концентрация БФГ в эритроцитах увеличивается, что является механизмом приспособления организма к гипоксии, наблюдающейся при заболеваниях лёгких, анемиях, подъёме на высоту. Так, в период адаптации к высокогорью (более 4 км над уровнем моря) концентрация БФГ уже через 2 дня возрастает почти в 2 раза (от 4,5 до 7,0 мМ). Понятно, что это снижает сродство Hb к О2и увеличивает количество О2, освобождаемого из капилляров в ткани.
Транспорт CO2. Как и О2, СО2транспортируется кровью как в физически растворённом состоянии, так и в химически связанном (в составе бикарбонатов и в соединении с белками, т.е. в форме карбаматов и в том числе в связи с Hb — карбгемоглобин). Во всех 3-х состояниях (растворённое, бикарбонат, карбаматы) СО2присутствует и в эритроцитах (89%), и в плазме крови (11%) (табл. 24–5). При химическом связывании СО2образуется значительное количество протонов (H+).
Таблица 24–5. Содержание в крови СО2 (мл/л)
|
|
Артериальная |
Смешанная (венозная) |
Артерио-венозная разница |
|
Врастворе |
25 |
29 |
4 |
|
Всвязисбелками |
24 |
38 |
14 |
|
Вформебикарбоната |
433 |
455 |
22 |
|
ВСЕГО |
482 |
522 |
40 |
Примечание. Pсо2(мм рт.ст.) артериальной крови — 40, венозной — 46, артерио–венозная разница — 6.
ОбщеесодержаниеCO2иартерио–венознаяразницапоCO2. Когда артериальная кровь поступает в тканевые капилляры, она связывает дополнительно 40 мл/л CO2(артерио–венозная разница по CO2, или дополнительный CO2). Это дополнительное количество CO2транспортируется к лёгким в растворённом виде, как бикарбонат и в составе карбаматов. Однако, при измерении в крови содержания бикарбоната методом Ван Слайка учитывается не только бикарбонат, но также растворённый CO2, CO2в составе карбаматов, угольной кислоты и карбонатов. Именно по этой причине во многих источниках существенно завышена роль бикарбоната как главного транспортёра CO2и занижена роль растворённого CO2и карбаматов (здесь и далее все значения даны в откорректированном виде, учитывающем недостатки метода Ван Слайка).
Примерно 2/3 СО2(68%, в том числе 63% в эритроцитах) транспортируется кровью в виде бикарбоната (НСО3–). Пятую часть СО2(22%, в том числе в виде карбгемоглобина — 21%) переносят карбаматы (СО2обратимо присоединён к неионизированным концевым-аминогруппам белков, образуя группировку R-NH-CОО–). 10% СО2находится в растворённом состоянии (поровну в плазме и в эритроцитах). Крайне существенно то обстоятельство, что в реакциях химического связывания СО2образуются ионы Н+:
СО2 + Н2ОН2СО3Н+ + НСО3–R-NH2+ СО2R-NH-CОО– +Н+
Из обоих равновесных реакций следует, что химическое связывание СО2идёт с образованием ионов Н+. Таким образом, для химического связывания СО2необходимо нейтрализовать Н+. Эту задачу решает гемоглобиновая буферная система.
Рольгемоглобиновойбуфернойсистемы(связывание ионов Н+) существенна для транспорта CO2кровью (рис. 24–13, рис. 24–14).
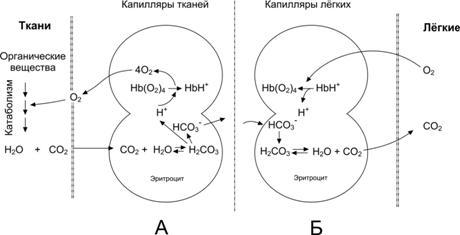
Рис.24–13.ПЕРЕНОСО2ИСО2СКРОВЬЮ[9].А.ВлияниеСО2иН+навысвобождениеО2изкомплексасгемоглобиномвтканях(эффектБора).Б.Оксигенированиедезоксигемоглобинавлёгких,образованиеивыделениеСО2.
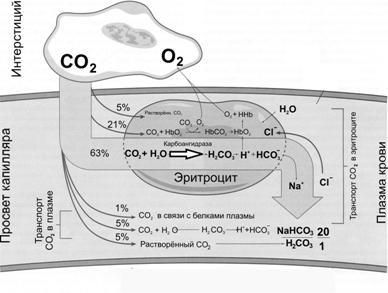
Рис. 24–14. Механизмы транспорта СО2 с кровью [4]
ВкапиллярахбольшогокругакровообращенияHbO2отдаёт кислород, а в кровь поступает CO2. В эритроцитах под влиянием карбоангидразы CO2взаимодействует с H2O, образуется угольная кислота (H2CO3), диссоциирующая на HCO3–и H+. Ион H+связывается с Hb (образуется восстановленный Hb — HHb), а HCO3–из эритроцитов выходит в плазму крови; взамен в эритроциты поступает эквивалентное количество Cl–. Одновременно часть CO2связывается с Hb (образуется карбгемоглобин).
Вкапиллярахлёгких(т.е. в условиях низкого pСО2и высокого pО2) Hb присоединяет O2и образуется оксигемоглобин (HbO2). В то же время в результате разрыва карбаминовых связей высвобождается CO2. При этом HCO3–из плазмы крови поступает в эритроциты (в обмен на ионы Cl–) и взаимодействует с H+, отщепившимся от Hb в момент его оксигенации. Образующаяся угольная кислота (H2CO3) под влиянием карбоангидразы расщепляется на CO2и H2O. CO2диффундирует в альвеолы и выводится из организма.
КриваядиссоциацииCO2описывает связь между содержанием в крови CO2и pСО2. В отличие от кривой диссоциации Hb и О2(см. рис. 24–10 и рис. 24–12), кривая диссоциации CO2при физиологических значениях pСО2 (кровь артериальная — 40 мм рт.ст., венозная — 46 мм рт.ст.) имеет линейный характер. Более того, при любом значении pСО2 содержание CO2в крови обратно пропорционально pО2 (насыщению Hb О2). Эта обратная зависимость между содержанием CO2и парциальным давлением кислорода (pО2) известна какэффектХолдейна. Как и эффектБора, эффект Холдейна имеет важное физиологическое значение. Так, в капиллярах большого круга кровообращения по мере диффузии O2из капилляроввозрастаетспособность крови поглощать CO2, в результате CO2поступает в кровь. Напротив, в капиллярах лёгкого при оксигенация крови её способность поглощать CO2уменьшается, в результате CO2«сбрасывается» в альвеолы.
Метаболизм гемоглобина, железо организма и анемии
