
- •Автор:
- •ISBN 978-985-6823-61-2
- •Д. Мецлер
- •Введение
- •Пищеварительные ферменты секретируются в виде зимогенов
- •Апикальная сторона
- •Базальная сторона
- •Всасывание и секреция электролитов
- •Секреция соляной кислоты обкладочными клетками желудка
- •Баланс азота и азотистое равновесие
- •Нормы белка в питании
- •Биологическая ценность белков
- •Обмен простых белков
- •Переваривание белков в желудке
- •Действие пепсина
- •Таблица 3.1
- •Субстратная специфичность протеиназ желудочно-кишечного тракта
- •Активный фермент
- •Зимоген
- •Активатор
- •Пепсин А
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Трипсиноген
- •Химотрипсиноген
- •Проэластаза
- •Карбоксипептидаза А
- •Карбоксипептидаза В
- •Аминопептидаза
- •Трипсин
- •Трипсин
- •Трипсин
- •Механизм активации химотрипсиногена
- •Общие свойства семейства сериновых протеиназ
- •Нарушения процессов переваривания белков
- •Механизм действия карбоксипептидазы А
- •Всасывание свободных аминокислот
- •Всасывание интактных белков
- •Лекция № 4
- •Обмен аминокислот в норме и при патологии
- •Общие реакции аминокислот
- •Оксидазы аминокислот
- •Реакции аммиака
- •Цикл мочевины
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат синтетаза
- •Орнитин транскарбамоилаза
- •Аргининосукцинат синтетаза
- •Аргининосукцинат лиаза
- •Аргиназа
- •Обмен индивидуальных аминокислот в норме и при патологии
- •Таблица 5.1
- •Значение клетчатки в питании человека
- •Таблица 6.1
- •Целлюлоза
- •Гемицеллюлоза
- •Лигнин
- •Пектин
- •Фрукты
- •Камеди
- •Непрямые эффекты рафинированных углеводов
- •Переваривание и всасывание углеводов
- •Таблица 6.2
- •Название
- •углевода
- •Тип связи
- •Структура
- •Амилопектин
- •Амилоза
- •Сахароза
- •Трегалоза
- •Молодые грибы
- •Лактоза
- •Фруктоза
- •Фрукты, мед
- •Глюкоза
- •Раффиноза
- •Бобовые
- •Таблица 6.3
- •Продукт реакции
- •Амилоза
- •Глюкоза
- •Глюкоза
- •Глюкоза
- •Сахароза
- •Глюкоза, фруктоза
- •Трегалоза
- •Глюкоза
- •Глюкоза, церамид
- •Лактоза
- •Глюкоза, галактоза
- •Всасывание моносахаридов
- •Таблица 6.4
- •Базальная поверхность
- •Хорошие субстраты
- •Флоризин
- •Цитохалазин В
- •Гипоксические повреждения тканей
- •Субстратные циклы
- •Гипогликемия у недоношенных детей
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Таблица 9.1
- •Cостав пируват-дегидрогеназного комплекса млекопитающих
- •Таблица 9.3
- •Кофакторы и простетические группы пируват-дегидрогеназы
- •Локализация
- •Регуляция пируватдегидрогеназного комплекса
- •Глюконеогенез
- •Особенности синтеза гликогена: гликогенин в роли праймера
- •Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
- •Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
- •Генетические дефекты структуры коллагена
- •ПРИЛОЖЕНИЕ 6.1
- •Функция
- •ПРИЛОЖЕНИЕ 7.1
- •Обмен 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •ПРИЛОЖЕНИЕ 7.2
- •Гликолиз и рак
- •Таблица 7.2.1
- •Белок/фермент
- •Функция
- •Лизосомные болезни накопления
- •Дополнительная литература
- •Окислительное декарбоксилирование
- •Регуляция пируватдегидрогеназного комплекса
- •Нарушения метаболизма, связанные с дефектами
- •пируватдегидрогеназы
- •Глюконеогенез
- •Регуляция активности пируват-карбоксилазы
- •Глюконеогенез и гликолиз регулируются реципрокно
- •Гликогенолиз и гликогенез
- •Ферментативное обеспечение гликогенолиза
- •Болезни накопления гликогена I типа
- •Деградация молекул гликогена в местах ветвления
- •Болезни накопления гликогена II, III и V типов
- •Синтез гликогена
- •Особенности синтеза гликогена: гликогенин
- •в роли праймера
- •Цикл Кори
- •Гипогликемия и алкогольная интоксикация
- •Пентозофосфатный путь
- •Неокислительные реакции пентозофосфатного пути
- •Синдром Вернике-Корсакова
- •Генетические дефекты структуры коллагена
- •Биосинтез полиаминов
- •Катаболизм полиаминов
- •Клиническое значение 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •Рекомендуемая литература
- •Основная литература
- •Дополнительная литература
ПРИЛОЖЕНИЕ 7.1
Обмен 2,3-дифосфоглицерата
Одной из реакций гликолитического пути распада глюкозы является реакция превращения 3-фосфоглицерата в 2-фосфоглицерат. При этом фосфорильная группа 3-фосфоглицерата перемещается из третьего положения во второе с образованием 2-фосфоглицерата. Данную реакцию катализирует фосфоглицеромутаза. В целом мутазы представляют собой класс ферментов обеспечивающих внутримолекулярное перемещение химических групп как, например, в данном случае фосфорильной группы. Фосфоглицеромутазная реакция обладает замечательной особенностью: фосфорильная группа не просто перемещается от одного атома углерода к другому. Этот фермент зависит от присутствия в каталитических количествах 2,3-дифосфоглицерата, который поддерживает остаток His в активном центре фермента в фосфорилированном состоянии:
Е–His + 2,3-дифосфоглицерат ↔ Е–His–фосфат + 2-фосфоглицерат
Е–His–фосфат + 3-фосфоглицерат ↔ Е–His + 2,3-дифосфоглицерат
Сумма этих двух реакций дает нетто выражение мутазной реакции:
3-фосфоглицерат ↔ 2-фосфоглицерат
Анализ первой части реакции показывает, что мутаза действует как фосфатаза – фермент превращает 2,3-дифосфоглицерат в 2-фосфоглицерат. Однако при этом фосфорильная группа остается связанной с ферментом. Эта фосфорильная группа затем переносится на 3-фосфоглицерат, регенерируя 2,3-дифосфоглицерат. Поскольку фосфорилированная форма фермента относительно нестабильна и подвергается распаду до свободного фермента и неорганического фосфата очевидно должна существовать отдельная реакция, обеспечивающая генерирование 2,3-дифосфоглицерата, который будет рефосфорилировать любую молекулу свободного фермента.
Действительно, существует фермент – дифосфоглицератмутаза, который катализирует образование 2,3-дифосфоглицерата из 1,3- дифосфоглицерата и 3-фосфоглицерата. Особенно большое значение эта реакция приобретает в эритроцитах, поскольку 2,3-дифосфоглицерат служит аллостерическим регулятором транспортной функции гемоглобина человека. Весьма интересен механизм описываемой мутазной реакции. Обязательным ее участником является 3-фосфоглицерат, хотя в итоговой стехиометрии реакции он не фигурирует (рис. 7.1.1). Дифосфоглицератмутаза одновременно связывает 1,3-дифосфоглицерат и 3-фосфоглицерат. В составе
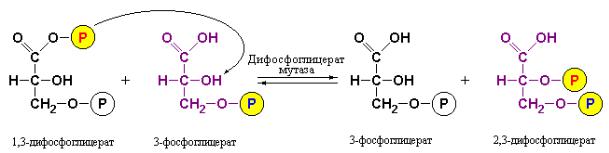
этого тройного комплекса происходит перенос фосфорильной группы от С-1 1,3-дифосфоглицерата на С-2 3-фосфоглицерата. В данной мутазной реакции 2,3-дифосфоглицерат выступает как мощный конкурентный ингибитор связывания 1,3-дифосфоглицерата. Таким образом, скорость синтеза 2,3- дифосфоглицерата отчасти зависит от его собственной концентрации.
Рис. 7.1.1 Схематическое изображение участия 3-фосфоглицерата в превращении 1,3-дифосфоглицерата в 2,3-дифосфоглицерат.
Другим регуляторным фактором реакции образования 2,3- дифосфоглицерата является концентрация 1,3-дифосфоглицерата, поскольку фермент не всегда насыщен этим соединением. В противоположность содержание 3-фосфоглицерата (в эритроцитах) почти всегда находится на уровне достаточном для насыщения мутазы. Отсюда следует, что скорость синтеза 2,3-дифосфоглицерата регулируется концентрациями несвязанных 1,3-дифосфоглицерата и 2,3-дифосфоглицерата. Избыточные количества 2,3- дифосфоглицерата гидролизуются под действием 2,3-дифосфоглицерат- фосфатазы с образованием 3-фосфоглицерата.
Итак, помимо того, что 2,3-дифосфоглицерат (2,3-DPG) является важным участником реакции превращения 3-фосфоглицерата в 2- фосфоглицерат в ходе гликолиза, этот органический фосфат служит принципиальным регулятором транспорта кислорода в эритроцитах. Он снижает сродство гемоглобина к кислороду, стабилизируя Т-состояние гемопротеида. Эритроциты характеризуются высокой концентрацией 2,3- дифосфоглицерата (обычно равной 4 мМ), что отличает их от других клеток, содержащих лишь следовые количества этого соединения (как, например, в гепатоцитах или миоцитах где 2,3-дифосфоглицерат используется лишь в качестве кофактора мутазной реакции).
Регуляторная функция 2,3-дифосфоглицерата в процессе транспорта кислорода реализуется благодаря способности данного соединения связываться с гемоглобином и, тем самым, влиять на сродство гемопротеида к кислороду. Действительно, в отсутствие 2,3-дифосфоглицерата Р50 для гемоглобина составляет 1 торр, тогда как в присутствии этого эффектора Р50 для гемоглобина возрастает до 26 торр. Это означает, что 2,3-DPG снижает сродство гемоглобина к кислороду в 26 раз. Физиологический смысл этого
явления сводится к следующему: в отсутствие 2,3-DPG гемоглобин в составе эритроцитов, проходя по капиллярам тканей, где рО2 равно ~26 торр, отдавал бы лишь небольшую часть связанного кислорода.
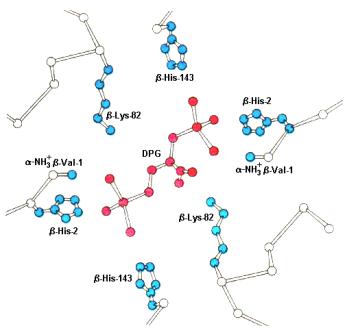
Методом ренгеноструктурного анализа было показано, что 2,3-DPG специфически связывается с дезоксигемоглобином в стехиометрии 1 молекула 2,3-DPG на 1 тетрамерную молекулу гемоглобина. (Arnone A., X-ray diffraction study of binding of 2,3-diphosphoglycerate to human deoxyhaemoglobin, Nature, 1972, 237, 5351, 146-149). Подобная стехиометрия взаимодействия эффектора с тетрамерами гемоглобина, структура которых описывается общей формулой α2β2, может указывать только на то, что 2,3- DPG связывается в центральной полости гемопротеида. Хорошо известно, что в гемоглобине человека HbA1 N-концевые последовательности β- субъединиц, обращенные в центральную полость тетрамерной молекулы белка, содержат общий кластер из восьми положительных зарядов,
представленных остатками β-Val-1, β-His-2, β-Lys-82, β-His-143 в каждой β-
цепи (рис. 7.1.2). Таким образом, связывание 2,3-DPG обусловлено образованием ион-парных взаимодействий между отрицательно заряженным
Рис. 7.1.2 Связывание 2,3-DPG с дезоксигемоглобином человека. 2,3-DPG электростатически взаимодействует с тремя положительно заряженными группами в каждой β-цепи белка. (Arnone A., X-ray diffraction study of binding of 2,3-diphosphoglycerate to human deoxyhaemoglobin, Nature, 1972, 237, 5351, 146-149).
эффектором, имеющим при физиологическом значении рН практически 4 отрицательных заряда и тремя положительно заряженными группами в каждой β-цепи белка.
В настоящее время стало понятным, почему 2,3-DPG снижает сродство гемоглобина к кислороду. Образуя перекрестные ион-парные взаимодействия с β-цепями, эффектор стабилизирует четвертичную структуру дезоксигемоглобина (так называемую Т-конформацию белка). Другими словами, 2,3-DPG сдвигает равновесие в сторону образования Т- конформации в ряду переходов Т↔R, где R-конформация соответствут полностью оксигенированному гемоглобину.
Клиническое значение 2,3-дифосфоглицерата
Выявление роли 2,3-DPG в транспорте кислорода позволило решить несколько проблем в разных областях клинической медицины. Так, например, на протяжении ряда лет оставалось непонятным, почему в крови, консервированной в среде цитрат – декстроза (общепринятая для консервирования крови среда), сродство гемоглобина к кислороду возрастает: вместо 26 торр значение Р50 становится равным 16 торр. В настоящее время установлено, что данное повышение сродства гемоглобина к кислороду обусловлено резким снижением содержания 2,3-DPG в эритроцитах с 4,5 до менее, чем 0,5 мМ за 10 дней хранения крови. Вместе с тем, сродство вливаемой консервированной крови к кислороду может иметь принципиальное значение в некоторых клинических случаях. Если больному переливают большое количество крови с высоким сродством к кислороду, то возникает опасность существенного снижения снабжения кислородом тканей. Попавшие в кровяное русло эритроциты, полностью лишенные 2,3- DPG, способны восстановить только половину его нормального содержания не менее чем за 24 часа. Такой длительный срок может оказаться критическим для тяжелых больных. Таким образом, в определенных условиях следует обращать внимание на то, чтобы при переливании крови больной получил эритроциты с нормальным сродством гемоглобина к кислороду. Простым добавлением 2,3-DPG нельзя повысить его содержание в эритроцитах, так как данный эффектор, обладая высоким зарядом, не способен проходить через клеточную мембрану. Можно, однако, предотвратить снижение концентрации 2,3-DPG в консервированных красных кровяных клетках, добавляя в среду консервирования инозин. Незаряженные молекулы инозина переносятся через мембрану эритроцита и внутри клетки в результате сложной серии реакций превращаются в 2,3-DPG. По этой причине в настоящее время инозин широко используется для сохранения функциональной полноценности консервированной крови.
Открытие роли 2,3-DPG позволило также понять и некоторые адаптивные механизмы, включающиеся при нарушении снабжения тканей кислородом. Возьмем для примера больных с тяжелой обструктивной эмфиземой легких. При этом заболевании затруднено поступление воздуха в бронхиолы; в результате артериальная кровь недостаточно насыщается
