
- •Автор:
- •ISBN 978-985-6823-61-2
- •Д. Мецлер
- •Введение
- •Пищеварительные ферменты секретируются в виде зимогенов
- •Апикальная сторона
- •Базальная сторона
- •Всасывание и секреция электролитов
- •Секреция соляной кислоты обкладочными клетками желудка
- •Баланс азота и азотистое равновесие
- •Нормы белка в питании
- •Биологическая ценность белков
- •Обмен простых белков
- •Переваривание белков в желудке
- •Действие пепсина
- •Таблица 3.1
- •Субстратная специфичность протеиназ желудочно-кишечного тракта
- •Активный фермент
- •Зимоген
- •Активатор
- •Пепсин А
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Трипсиноген
- •Химотрипсиноген
- •Проэластаза
- •Карбоксипептидаза А
- •Карбоксипептидаза В
- •Аминопептидаза
- •Трипсин
- •Трипсин
- •Трипсин
- •Механизм активации химотрипсиногена
- •Общие свойства семейства сериновых протеиназ
- •Нарушения процессов переваривания белков
- •Механизм действия карбоксипептидазы А
- •Всасывание свободных аминокислот
- •Всасывание интактных белков
- •Лекция № 4
- •Обмен аминокислот в норме и при патологии
- •Общие реакции аминокислот
- •Оксидазы аминокислот
- •Реакции аммиака
- •Цикл мочевины
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат синтетаза
- •Орнитин транскарбамоилаза
- •Аргининосукцинат синтетаза
- •Аргининосукцинат лиаза
- •Аргиназа
- •Обмен индивидуальных аминокислот в норме и при патологии
- •Таблица 5.1
- •Значение клетчатки в питании человека
- •Таблица 6.1
- •Целлюлоза
- •Гемицеллюлоза
- •Лигнин
- •Пектин
- •Фрукты
- •Камеди
- •Непрямые эффекты рафинированных углеводов
- •Переваривание и всасывание углеводов
- •Таблица 6.2
- •Название
- •углевода
- •Тип связи
- •Структура
- •Амилопектин
- •Амилоза
- •Сахароза
- •Трегалоза
- •Молодые грибы
- •Лактоза
- •Фруктоза
- •Фрукты, мед
- •Глюкоза
- •Раффиноза
- •Бобовые
- •Таблица 6.3
- •Продукт реакции
- •Амилоза
- •Глюкоза
- •Глюкоза
- •Глюкоза
- •Сахароза
- •Глюкоза, фруктоза
- •Трегалоза
- •Глюкоза
- •Глюкоза, церамид
- •Лактоза
- •Глюкоза, галактоза
- •Всасывание моносахаридов
- •Таблица 6.4
- •Базальная поверхность
- •Хорошие субстраты
- •Флоризин
- •Цитохалазин В
- •Гипоксические повреждения тканей
- •Субстратные циклы
- •Гипогликемия у недоношенных детей
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Таблица 9.1
- •Cостав пируват-дегидрогеназного комплекса млекопитающих
- •Таблица 9.3
- •Кофакторы и простетические группы пируват-дегидрогеназы
- •Локализация
- •Регуляция пируватдегидрогеназного комплекса
- •Глюконеогенез
- •Особенности синтеза гликогена: гликогенин в роли праймера
- •Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
- •Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
- •Генетические дефекты структуры коллагена
- •ПРИЛОЖЕНИЕ 6.1
- •Функция
- •ПРИЛОЖЕНИЕ 7.1
- •Обмен 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •ПРИЛОЖЕНИЕ 7.2
- •Гликолиз и рак
- •Таблица 7.2.1
- •Белок/фермент
- •Функция
- •Лизосомные болезни накопления
- •Дополнительная литература
- •Окислительное декарбоксилирование
- •Регуляция пируватдегидрогеназного комплекса
- •Нарушения метаболизма, связанные с дефектами
- •пируватдегидрогеназы
- •Глюконеогенез
- •Регуляция активности пируват-карбоксилазы
- •Глюконеогенез и гликолиз регулируются реципрокно
- •Гликогенолиз и гликогенез
- •Ферментативное обеспечение гликогенолиза
- •Болезни накопления гликогена I типа
- •Деградация молекул гликогена в местах ветвления
- •Болезни накопления гликогена II, III и V типов
- •Синтез гликогена
- •Особенности синтеза гликогена: гликогенин
- •в роли праймера
- •Цикл Кори
- •Гипогликемия и алкогольная интоксикация
- •Пентозофосфатный путь
- •Неокислительные реакции пентозофосфатного пути
- •Синдром Вернике-Корсакова
- •Генетические дефекты структуры коллагена
- •Биосинтез полиаминов
- •Катаболизм полиаминов
- •Клиническое значение 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •Рекомендуемая литература
- •Основная литература
- •Дополнительная литература
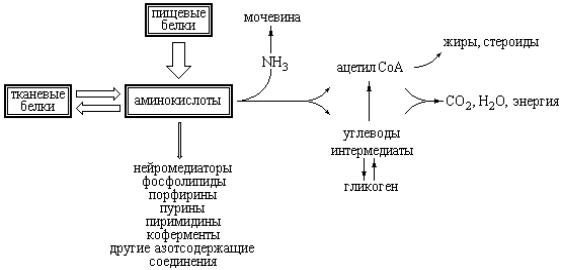
Рис. 4.1 Схема основных направлений метаболических путей, участвующих в формировании и утилизации пула свободных протеиногенных аминокислот.
Выше указывалось, что определенное количество атомов N, принадлежащих аминогруппам экзогенных аминокислот, используется для повторного синтеза этих важнейших соединений, или используется в других, зависящих от аминокислот, синтетических процессах. Однако бóльшая часть азота, высвобождающегося в результате деградации избыточных аминокислот, превращается в мочевину и экскретируется почками. Синтез мочевины осуществляется в печени, которая ответственна также за биосинтез заменимых аминокислот. В печени протекают и процессы деградации всех экзогенных аминокислот.
Общие реакции аминокислот
Аминокислоты, не используемые непосредственно для ресинтеза тканевых белков, подвергаются дальнейшим превращениям, совокупность которых описывается как промежуточный обмен аминокислот. Условно промежуточный обмен этих соединений подразделяют на общие пути обмена аминокислот и специфические пути распада и синтеза индивидуальных аминокислот. К общим путям обмена относят метаболические пути, включающие реакции декарбоксилирования,
переаминирования, окислительного дезаминирования, а также некоторые реакции, приводящие к образованию продуктов промежуточного обмена веществ в организме человека. Поскольку реакции переноса аминогрупп с аминокислоты на соответствующую α-кетокислоту являются наиболее универсальными, рассмотрение общих путей деградации аминокислот целесообразно начать именно с процесса трансаминирования.
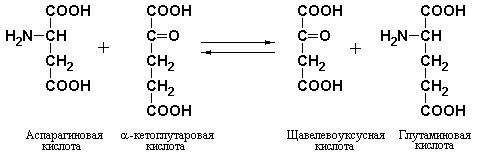
Трансаминирование аминокислот связано с переносом аминогруппы на акцептор
Реакции трансаминирования, катализируемые ферментами семейства трансаминаз, называемых также аминотрансферазами, являются общими реакциями, как для катаболических, так и анаболических путей промежуточного обмена аминокислот. Принцип реакций трансаминирования состоит в переносе аминогруппы от α-аминокислоты (без промежуточного образования свободного аммиака) на α-кетокислоту с образованием новой α- кето- и новой α-аминокислоты.
В количественном отношении перенос аминогрупп на α-кетокислоты является наиболее важной реакцией метаболизма аминокислот. Реакции трансаминирования чрезвычайно важны для синтеза заменимых аминокислот, для процессов распада аминокислот и обмена аминогрупп. Трансаминирование обнаружено in vivo для всех основных аминокислот за исключением лизина, треонина и пролина.
Приоритет открытия реакций трансаминирования принадлежит российским биохимикам А.Е. Браунштейну и М.Г. Крицман. В 1937 году этими авторами было обнаружено, что из глутаминовой кислоты и пировиноградной кислоты с большой скоростью образуются α- кетоглутаровая кислота и аланин, причем было замечено, что эта реакция протекает без промежуточного образования свободного аммиака. Поскольку
вреакционной смеси аммиак не обнаруживался, напрашивалось заключение
отом, что реакция осуществляется путем переноса аминогруппы с аминокислоты на кетокислоту.
Наиболее изученным ферментом семейства трансаминаз является
цитоплазматическая аспартат-трансаминаза. Кроме цитоплазматической аспартат-трансаминазы похожий, но другой фермент был обнаружен в
митохондриях. Большинство трансаминаз специфичны к α-кетоглутаровой или глутаминовой кислотам в качестве одного из субстратов реагирующей пары. Специфичность же различных трансаминаз к другому субстрату (аминоили кетокислоте) может быть как строгой, так и широкой.
В любом случае аминокислота и соответствующая ей кетокислота находятся в равновесии с α-кетоглутаратом и глутаминовой кислотой:

Поскольку константа равновесия данной реакции близка к 1, фактическое равновесие реакции переаминирования определяется реально действующими концентрациями субстратов, которые, в свою очередь, зависят от множества клеточных процессов продукции или расхода этих соединений.
Некоторые трансаминазы вместо глутаминовой кислоты используют в качестве субстрата глутамин. В этом случае в реакции трансаминирования образуется совсем другой продукт – α-кетоглутарамат:
Использование аминокислот, меченых 15N позволило сформулировать концепцию «динамического равновесия», отражающую стационарное состояние, в котором находится обмен атомами азота между отдельными аминокислотами. В условиях in vivo, именно трансаминазы ответственны за активное перераспределение аминогрупп между аминокислотами.
Активность трансаминаз зависит от присутствия кофактора,
представленного пиридоксальфосфатом.
Кофермент связан с белком ионными взаимодействиями, вдобавок альдегидная группа пиридоксальфосфата образует Шиффово основание с ε- аминогруппой лизина в активном центре белковой молекулы. Механизм реакции переаминирования приведен ниже (рис. 4.2).
Данная схема показывает первую стадию реакции трансаминирования - образование интермедиата, представленного Шиффовым основанием кофактора и аминокислоты-субстрата. В результате внутримолекулярной перестройки этого интермедиата происходит освобождение кетокислоты и
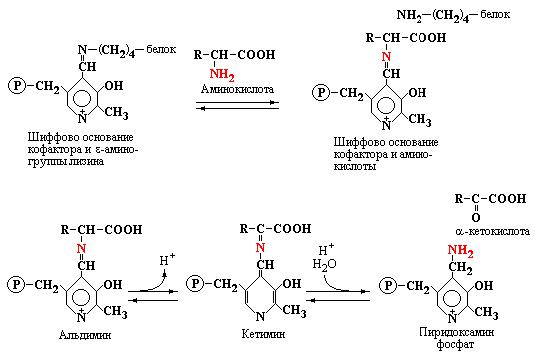
образование связанного с ферментом пиридоксаминфосфата, который являет собой форму фиксации аминогруппы.
Рис. 4.2 Механизм реакции трансаминирования, предложенный А. Браунштейном и Э. Снеллом.
При взаимодействии пиридоксаминфосфата с другой кетокислотой, за счет обращения реакции, образуется новая аминокислота. Таким образом, в процессе переаминирования кофермент выполняет функцию переносчика аминогруппы.
Поскольку, как упоминалось выше, константа равновесия реакций переаминирования практически равна единице, данные реакции легко обратимы, что позволяет трансаминазам функционировать и в процессах катаболизма, и в процессах биосинтеза аминокислот. Следовательно, реакции трансаминирования оказываются чрезвычайно важными для синтеза заменимых аминокислот, для процессов распада аминокислот и обмена аминогрупп. Действительно, в результате функционирования трансаминаз происходит образование десяти заменимых аминокислот из соответствующих α-кетоаналогов.
Окислительное дезаминирование аминокислот. Глутамат-дегидрогеназа
Избыток аминокислот относительно того количества, которое необходимо для синтеза тканевых белков, в отличие от жирных кислот и глюкозы, не может запасаться или выделяться в неизменном виде из
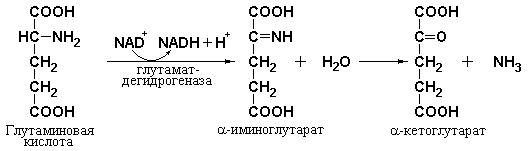
организма. Экзогенные аминокислоты используются как метаболическое топливо, при этом α-аминогруппы отщепляются от углеродного скелета. Большинство аминогрупп избыточных аминокислот расходуется на образование мочевины, тогда как их углеродные скелеты превращаются в ацетил-S-СоА или сукцинил-S-СоА.
Основным ферментом, обеспечивающим в конечном итоге отщепление аминогрупп от большинства аминокислот, является глутаматдегидрогеназа. Функционирование данного фермента теснейшим образом связано с активностью трансаминаз: аспартат-трансаминазы и аланинтрансаминазы. Как уже было сказано, α-аминогруппы большинства аминокислот переносятся на α-кетоглутарат с образованием глутаминовой кислоты. Это очень важно, так как глутаминовая кислота является единственной аминокислотой в тканях млекопитающих, которая может с существенной скоростью подвергаться окислительному дезаминированию с высвобождением аммиака (NH4+). Реакция, катализируемая глутаматдегидрогеназой, показана ниже:
Глутамат + NAD+(NADP+) + H2O ↔ α-кетоглутарат + NADH (NADPH) + NH4+ + H+
Характерной особенностью данного фермента является его способность использовать в качестве кофакторов как NAD+, так и NADP+.
Реакция, приведенная выше, представляет собой лишь бруттовыражение процесса. В действительности механизм реакции окислительного дезаминирования глутаминовой кислоты намного сложнее. В такой реакции аминогруппа окисляется вначале до иминогруппы с образованием α- иминокислоты, при этом восстановительные эквиваленты переносятся на NAD+ или NADP+. На второй стадии α-иминокислота неферментативно присоединяет воду и превращается в соответствующую α-кетокислоту с потерей α-аминного азота в виде NH4+:
При нейтральном значении pH равновесие реакции сдвинуто в сторону образования глутамата. Однако в физиологических условиях, при которых за продукты реакции – NADH и α-кетоглутарат конкурируют другие ферменты
– NADH-оксидаза и α-кетоглутарат-дегидрогеназа, соответственно, реакция идет в сторону эффективного окисления глутаминовой кислоты.
