
- •Автор:
- •ISBN 978-985-6823-61-2
- •Д. Мецлер
- •Введение
- •Пищеварительные ферменты секретируются в виде зимогенов
- •Апикальная сторона
- •Базальная сторона
- •Всасывание и секреция электролитов
- •Секреция соляной кислоты обкладочными клетками желудка
- •Баланс азота и азотистое равновесие
- •Нормы белка в питании
- •Биологическая ценность белков
- •Обмен простых белков
- •Переваривание белков в желудке
- •Действие пепсина
- •Таблица 3.1
- •Субстратная специфичность протеиназ желудочно-кишечного тракта
- •Активный фермент
- •Зимоген
- •Активатор
- •Пепсин А
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Трипсиноген
- •Химотрипсиноген
- •Проэластаза
- •Карбоксипептидаза А
- •Карбоксипептидаза В
- •Аминопептидаза
- •Трипсин
- •Трипсин
- •Трипсин
- •Механизм активации химотрипсиногена
- •Общие свойства семейства сериновых протеиназ
- •Нарушения процессов переваривания белков
- •Механизм действия карбоксипептидазы А
- •Всасывание свободных аминокислот
- •Всасывание интактных белков
- •Лекция № 4
- •Обмен аминокислот в норме и при патологии
- •Общие реакции аминокислот
- •Оксидазы аминокислот
- •Реакции аммиака
- •Цикл мочевины
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат синтетаза
- •Орнитин транскарбамоилаза
- •Аргининосукцинат синтетаза
- •Аргининосукцинат лиаза
- •Аргиназа
- •Обмен индивидуальных аминокислот в норме и при патологии
- •Таблица 5.1
- •Значение клетчатки в питании человека
- •Таблица 6.1
- •Целлюлоза
- •Гемицеллюлоза
- •Лигнин
- •Пектин
- •Фрукты
- •Камеди
- •Непрямые эффекты рафинированных углеводов
- •Переваривание и всасывание углеводов
- •Таблица 6.2
- •Название
- •углевода
- •Тип связи
- •Структура
- •Амилопектин
- •Амилоза
- •Сахароза
- •Трегалоза
- •Молодые грибы
- •Лактоза
- •Фруктоза
- •Фрукты, мед
- •Глюкоза
- •Раффиноза
- •Бобовые
- •Таблица 6.3
- •Продукт реакции
- •Амилоза
- •Глюкоза
- •Глюкоза
- •Глюкоза
- •Сахароза
- •Глюкоза, фруктоза
- •Трегалоза
- •Глюкоза
- •Глюкоза, церамид
- •Лактоза
- •Глюкоза, галактоза
- •Всасывание моносахаридов
- •Таблица 6.4
- •Базальная поверхность
- •Хорошие субстраты
- •Флоризин
- •Цитохалазин В
- •Гипоксические повреждения тканей
- •Субстратные циклы
- •Гипогликемия у недоношенных детей
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Таблица 9.1
- •Cостав пируват-дегидрогеназного комплекса млекопитающих
- •Таблица 9.3
- •Кофакторы и простетические группы пируват-дегидрогеназы
- •Локализация
- •Регуляция пируватдегидрогеназного комплекса
- •Глюконеогенез
- •Особенности синтеза гликогена: гликогенин в роли праймера
- •Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
- •Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
- •Генетические дефекты структуры коллагена
- •ПРИЛОЖЕНИЕ 6.1
- •Функция
- •ПРИЛОЖЕНИЕ 7.1
- •Обмен 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •ПРИЛОЖЕНИЕ 7.2
- •Гликолиз и рак
- •Таблица 7.2.1
- •Белок/фермент
- •Функция
- •Лизосомные болезни накопления
- •Дополнительная литература
- •Окислительное декарбоксилирование
- •Регуляция пируватдегидрогеназного комплекса
- •Нарушения метаболизма, связанные с дефектами
- •пируватдегидрогеназы
- •Глюконеогенез
- •Регуляция активности пируват-карбоксилазы
- •Глюконеогенез и гликолиз регулируются реципрокно
- •Гликогенолиз и гликогенез
- •Ферментативное обеспечение гликогенолиза
- •Болезни накопления гликогена I типа
- •Деградация молекул гликогена в местах ветвления
- •Болезни накопления гликогена II, III и V типов
- •Синтез гликогена
- •Особенности синтеза гликогена: гликогенин
- •в роли праймера
- •Цикл Кори
- •Гипогликемия и алкогольная интоксикация
- •Пентозофосфатный путь
- •Неокислительные реакции пентозофосфатного пути
- •Синдром Вернике-Корсакова
- •Генетические дефекты структуры коллагена
- •Биосинтез полиаминов
- •Катаболизм полиаминов
- •Клиническое значение 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •Рекомендуемая литература
- •Основная литература
- •Дополнительная литература
Глюконеогенез
Глюконеогенезом называется процесс синтеза глюкозы из неуглеводных предшественников. Этот особый метаболический путь имеет чрезвычайно важное значение для поддержания уровня глюкозы в кровотоке, поскольку некоторые ткани, в частности мозг, являются весьма чувствительными к снижению концентрации глюкозы, которая в клетках таких тканей играет роль первичного метаболического топлива.
Дневная потребность мозга взрослого человека в глюкозе составляет около 120 граммов. Для сравнения, суточная потребность всего организма в глюкозе равняется 160 граммам. Это означает, что на долю мозга приходится неизмеримо большая часть общей потребности организма в глюкозе. В жидкостях тела присутствует около 20 граммов глюкозы, и еще примерно 190 граммов глюкозы легко может быть получено из ее резервной формы – гликогена.
Таким образом, «непосредственных» резервов глюкозы вполне достаточно для удовлетворения потребности в ней в течение одного дня. При более длительном голодании для обеспечения жизнедеятельности организма возникает необходимость синтезировать глюкозу из неуглеводных предшественников. Большое значение глюконеогенез приобретает также при интенсивной физической нагрузке.
Главными неуглеводными предшественниками глюкозы служат
лактат, глюкогенные аминокислоты и глицерол. Лактат образуется в больших количествах в интенсивно работающей скелетной мышце. В этом случае скорость гликолиза существенно превышает скорость функционирования цикла Кребса и системы окислительного фосфорилирования. Аминокислоты становятся доступными для образования глюкозы после переваривания белков пищи или, при голодании, образуются в результате распада тканевых белков (в первую очередь белков скелетной мускулатуры). Наконец, глицерол образуется в результате гидролиза триацилглицеролов в жировых клетках адипозной ткани. Глицерол служит предшественником глюкозы, тогда как жирные кислоты в организме человека и животных в глюконеогенный путь не вступают.
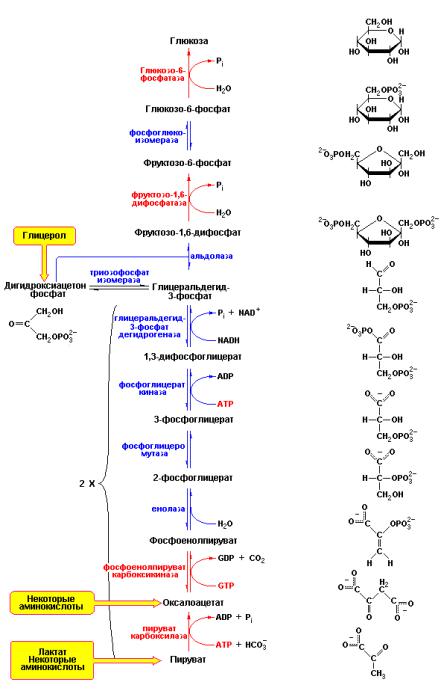
По пути глюконеогенеза происходит превращение пировиноградной кислоты в глюкозу. Включение различных метаболитов в глюконеогенез осуществляется в основном на уровне пирувата, оксалоацетата и дигидроксиацетонфосфата (рис. 9.11).
Главным местом глюконеогенеза в организме является печень. Эти метаболические превращения протекают также в коре почек, но общее количество глюкозы, образующейся в почках, составляет только 1/10 того количества моносахарида, которое синтезируется в печени. Однако такое сравнение не говорит о более низкой эффективности глюконеогенного пути в
почках. Указанные различия объясняются гораздо меньшей массой той части почечной ткани, которая участвует в глюконеогенезе.
Отмечено, что очень незначительные количества глюкозы могут образовываться за счет глюконеогенеза в мозгу, а также в скелетной и сердечной мышцах. Однако процесс глюконеогенза в печени и почках протекает настолько эффективно, что клетки мозга и миоциты в основном лишь извлекают глюкозу из кровяного русла в количествах достаточных для удовлетворения своих метаболических потребностей.
Рис. 9.11 Последовательность реакций глюконеогенеза. Характерные для
глюконеогенеза реакции и ферменты их катализирующие выделены красным цветом. Все остальные реакции являются общими для гликолиза и глюконеогенеза. В основном ферменты глюконеогенеза локализованы в цитоплазме. Исключение составляют пируваткарбоксилаза, действующая в митохондриях и глюкозо-6- фосфатаза являющаяся мембраносвязанным белком эндоплазматического ретикулума гепатоцитов и клеток почек. На схеме также показаны места входа в глюконеогенез лактата, глицерола и глюкогенных аминокислот (Berg J.M., Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006).
В ходе гликолиза глюкоза превращается в пируват и, наоборот, при глюконеогенезе пируват превращается в глюкозу. Тем не менее, глюконеогенез – не есть обращение гликолиза. Нужно помнить, что из десяти реакций гликолиза три – необратимы, а именно реакции, катализируемые гексокиназой, фосфофруктокиназой и пируваткиназой. Это означает, что термодинамическое равновесие гликолиза в целом сдвинуто далеко в сторону образования пировиноградной кислоты. В частности в реальных условиях клетки, фактическое значение G для образования пирувата из глюкозы составляет примерно –20 ккал/моль. Такое уменьшение свободной энергии при гликолизе со всей очевидностью говорит о том, что глюконеогенез должен использовать другие пути, идущие в обход фактически необратимых в условиях клетки реакций гликолиза.
Путь глюконеогенеза обходит эти необратимые реакции гликолиза при помощи следующих новых этапов:
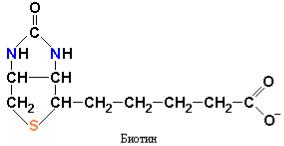
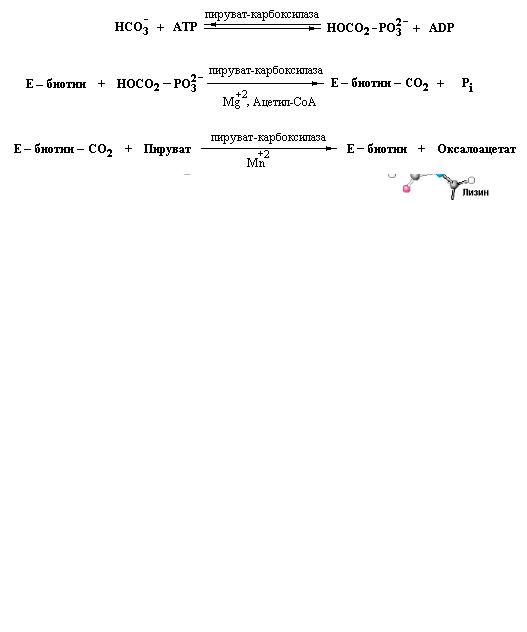
Во-первых, фосфоенолпируват синтезируется из пировиноградной кислоты через промежуточное образование оксалоацетата. Вначале происходит карбоксилирование пировиноградной кислоты в оксалоацетат с использованием одной молекулы АТР. Реакция катализируется пируваткарбоксилазой – митохондриальным ферментом, содержащим ковалентно связанную простетическую группу, биотин, которая функционирует в качестве переносчика активированного СО2.
Обнаружение того факта, что в митохондриях происходит образование щавелевоуксусной кислоты из пировиноградной кислоты, как раз и привело Мертона Аттера к открытию пируват-карбоксилазы в 1960 году. Пируваткарбоксилаза представляет особый интерес в связи с уникальными
структурными, каталитическими и аллостерическими свойствами. Приблизительно 300-350 N-концевых аминокислотных остатков пируваткарбоксилазы формируют АТР-связывающий домен. С другой стороны на С- конце фермента 80 аминокислотных остатков используются для образования биотин-связывающего домена (рис. 9.12). Биотин это ковалентно связанная простетическая группа, которая используется в качестве переносчика активированного СО2. Карбоксильная группа биотина образует амидную связь с ε-аминогруппой специфического остатка лизина пируваткарбоксилазы. Следует обратить внимание на то, что биотин присоединяется к пируват карбоксилазе длинной подвижной «ножкой», состоящей из девяти атомов углерода и одного атома азота как это имеет место при взаимодействии липоамида с дигидролипоил-трансацетилазой пируватдегидрогеназного комплекса.
Рис. 9.12 Биотин-связующий домен пируваткарбоксилазы. Структура биотинсвязующего домена пируваткарбоксилазы получена на основе гомологичного домена ацетил-СоА-карбоксилазы. Биотин «привязан» к ферменту амидной связью образованной между карбоксильной группой кофермента и ε-аминогруппой лизина. Эта длинная «ножка» позволяет биотину свободно перемещаться между АТР-бикарбонат-связующим сайтом и пируват-связующим сайтом (Berg J.M., Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006).
Реакция карбоксилирования пировиноградной кислоты протекает в три стадии:
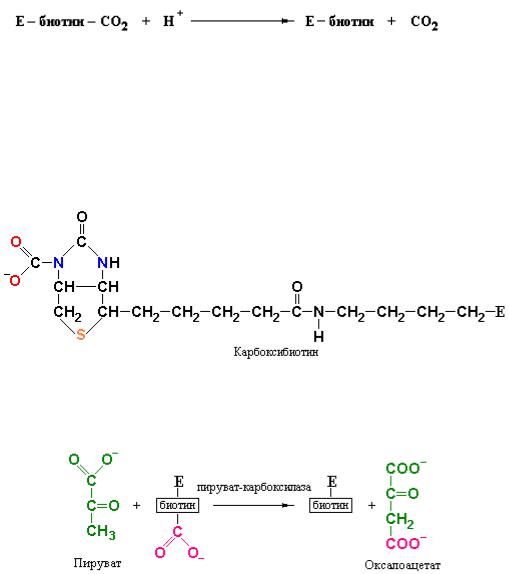
Напомним, что в водных растворах благодаря участию карбоангидразы СО2 существует в виде бикарбонат-иона HCO3¯. Бикарбонат-ион HCO3¯ активируется с образованием карбоксифосфата. Активированный таким образом СО2 присоединяется к атому азота N1 кольца биотина с образованием промежуточного комплекса карбоксибиотин-фермент. Присоединенный к биотину СО2 остается в активированном состоянии. Величина G°/ для реакции отщепления СО2:
составляет –4,7 ккал/моль (–20 кДж/моль). Отрицательное значение G°/ для указанной выше реакции свидетельствует о том, что карбоксибиотин способен переносить СО2 на соответствующие акцепторы без дополнительного расходования энергии.
Карбоксильная группа в промежуточном продукте, карбоксибиотине, связана с атомом N1 биотинового кольца:
Таким образом, в реакции карбоксилирования активированная карбоксильная группа переносится на пируват с образованием оксалоацетата.
Во-вторых, для перехода от оксалоацетата к фосфоенолпирувату необходимо перенести щавелевоуксусную кислоту из митохондриального компартмента в цитозоль. Перенос оксалоацетата осуществляется по челночному механизму с участием митохондриальной NADH-зависимой малат-дегидрогеназы. Образующаяся при этом яблочная кислота переносится через митохондриальную мембрану и вновь окисляется до оксалоацетата NAD+-зависимой малат-дегидрогеназой цитозоля. В цитозоле оксалоацетат
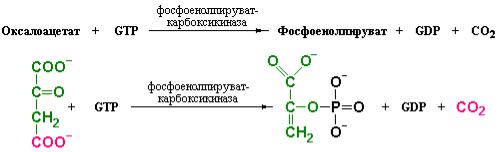
подвергается одновременно и декарбоксилированию, и фосфорилированию под действием фосфоенолпируват-карбоксикиназы:
На этой стадии происходит отделение СО2, присоединившегося к пирувату под действием пируват-карбоксилазы. Реакция фосфорилирования становится термодинамически возможной вследствие одновременного декарбоксилирования. Процессы декарбоксилирования часто приводят в движение реакции, которые в ином случае были бы высокоэнергоемкими.
В-третьих, превращение фруктозо-1,6-дифосфата во фруктозо-6- фосфат происходит путем гидролиза фосфатного эфира по С1 атому молекулы фруктозо-1,6-дифосфата. Данная реакция, как уже указывалось в разделе «Взаимоотношения фосфорилированных сахаров», катализируется фруктозо-1,6-дифосфатазой.
Наконец, свободная глюкоза образуется путем гидролиза глюкозо-6- фосфата под действием глюкозо-6-фосфатазы – фермента, связанного с мембранами эндоплазматического ретикулума и принимающего участие также в процессе мобилизации гликогена.
Регуляция активности пируват-карбоксилазы
Активность пируват-карбоксилазы зависит от присутствия ацетил-S-
СоА. В отсутствие связанного с ферментом ацетил-S-СоА (или другого близкого по структуре ацил-S-СоА) биотин не карбоксилируется.
Аллостерическая активация пируват-карбоксилазы с участием ацетил-S-СоА представляет собой важнейший физиологический механизм контроля. Дело в том, что оксалоацетат – продукт пируват-карбоксилазной реакции, является одновременно и стехиометрическим промежуточным продуктом глюконеогенеза и каталитическим промежуточным продуктом цикла трикарбоновых кислот. Высокое содержание ацетил-S-СоА служит сигналом необходимости увеличения количества оксалоацетата. Если в клетке имеет место избыток АТР, оксалоацетат используется в реакциях глюконеогенеза. В условиях недостатка АТР оксалоацетат включается в цикл трикарбоновых кислот с целью конденсации с ацетил-S-СоА.
Таким образом, пируват-карбоксилаза является ферментом не только важным для процесса глюконеогенеза, этот фермент играет также
критическую роль в поддержании необходимой концентрации промежуточных продуктов цикла Кребса. Указанные промежуточные продукты должны все время восполняться, поскольку они используются в некоторых биосинтетических реакциях, например, при биосинтезе гема. Эта уникальная роль пируват-карбоксилазы в клетке получила название анаплеротической, что означает восполняющая или компенсаторная роль.
Выше указывалось, что пируват-карбоксилаза является митохондриальным ферментом, тогда как все остальные ферменты глюконеогенеза локализованы в цитоплазме соответствующих клеток. Перенос оксалоацетата из митохондрий в цитоплазму осуществляется по уже известному челночному механизму.
Стехиометрия процесса глюконеогенеза описывается общим уравнением:
2 Пируват + 4 АТР + 2GTP + 2 NADH + 2 Н2О → → Глюкоза + 4 ADP + 2 GDP + 6 Pi + 2 NAD+
G°/ = –9 ккал/моль
Стехиометрия обращения гликолиза (хотя это не так) носит иной характер:
2 Пируват + 2 АТР + 2 NADH + 2 H2O → → Глюкоза + 2 ADP + 2 Pi + 2 NAD+
G°/ = +20 ккал/моль
Заметим, что для синтеза глюкозы из пирувата путем глюконеогенеза используется шесть высокоэнергетических фосфатных связей, тогда как в процессе превращения глюкозы в пируват при гликолизе образуются только две молекулы АТР. Таким образом, избыточная «цена» глюконеогенеза равна четырем высокоэнергетическим фосфатным связям в расчете на одну молекулу глюкозы, синтезируемой из пирувата. Для превращения энергетически неблагоприятного процесса (обращение гликолиза, G°/ = +20 ккал/моль) в энергетически благоприятный (глюконеогенез, G°/ = –9 ккал/моль) требуются четыре лишние высокоэнергетические фосфатные связи. Рассматривая это энергетическое различие между гликолизом и глюконеогенезом под другим углом зрения, напомним, что вклад одного эквивалента АТР изменяет константу равновесия реакции примерно в 108 раз. Следовательно, вклад четырех дополнительных высокоэнергетических фосфатных связей при глюконеогенезе изменяет эту константу в 1032 раз, что делает превращение пирувата в глюкозу термодинамически выгодным.
Глюконеогенез и гликолиз регулируются реципрокно
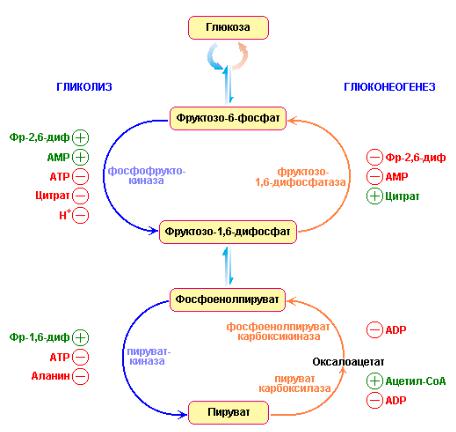
Глюконеогенз и гликолиз координируются таким образом, что когда активность одного из этих путей находится на относительно низком уровне, другой путь является высокоактивным. Если бы обе последовательности реакций гликолиза и глюконеогенеза протекали с высокой активностью одновременно, происходил бы неоправданный гидролиз четырех высокоэнергетических фосфатных связей (двух АТР и двух GTP) на один цикл реакции. В условиях существующих в клетке и гликолиз, и глюконеогенез представляют собой высокоэкзергонические процессы, так что термодинамических барьеров для осуществления таких циклов нет. Однако количества и активности отдельных ферментов глюколиза и глюконеогенеза контролируются так, что ни один из этих двух путей не функционирует с высокой активностью одновременно. Так скорость протекания гликолиза детерминируется концентрацией глюкозы, в то время как скорость процесса глюконеогенеза определяется концентрациями лактата и других предшественников глюкозы.
Рис. 9.13 Реципрокная регуляция глюконеогенеза и гликолиза в печени. После приема пищи уровень фруктозо-2,6-дифосфата увеличивается и, соответственно, снижается в период голодания. Еще одной важной точкой контроля является ингибирование пируваткиназы путем ее фосфорилирования в промежутках между приемами пищи (Berg J.M.,
Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006).
Взаимопревращение фруктозо-6-фосфата и фруктозо-1,6-дифосфата строго регулируются (рис. 9.13). Ранее указывалось, что АМР стимулирует фосфофруктокиназу, в то время как АТР и цитрат ингибируют активность данного фермента. С другой стороны, фруктозо-1,6-дифосфатаза ингибируется АМР, но активируется цитратом. Высокая концентрация АМР указывает на то, что энергетический заряд в клетке низок и сигнализирует, тем самым, о том, что необходим синтез АТР. И наоборот, высокие уровни АТР и цитрата указывают на высокий энергетический заряд клетки и на то, что интермедиаты биосинтеза присутствуют в клетке в избытке. В таких условиях гликолиз практически «выключен», а глюконеогенез функционирует с высокой эффективностью.
Фосфофруктокиназа и фруктозо-1,6-дифосфатаза также реципрокно регулируются под действием фруктозо-2,6-дифосфата. Уровень фруктозо- 2,6-дифосфата низок в промежутках между приемами пищи и высок при употреблении пищи. Это явление имеет место из-за антагонистических эффектов инсулина и глюкагона на продукцию и деградацию данных сигнальных молекул. Фруктозо-2,6-дифосфат заметно стимулирует фосфофруктокиназу и в такой же степени ингибирует фруктозо-1,6-
дифосфатазу. Отсюда следует, что после приема пищи гликолиз ускоряется, а глюконеогенез, соответственно, замедляется. В промежутках между приемами пищи активируется глюконеогенез из-за того, что уровень фруктозо-2,6-дифосфата сильно снижается. Образованная в этих условиях глюкоза поступает из печени в кровь для удовлетворения потребности в данном метаболическом топливе головного мозга и мышц.
Взаимопревращение фосфоенолпирувата и пирувата также тонко регулируется. Заметьте, что пируват-киназа контролируется с помощью аллостерических эффекторов, а также путем фосфорилирования/дефосфорилирования. В печени фермент ингибируется при высоких концентрациях АТР и аланина, что указывает на высокий энергетический заряд клеток и наличие достаточных количеств строительных блоков для биосинтеза. С другой стороны, пируват-карбоксилаза, катализирующая первую реакцию процесса глюконеогенеза, активируется в присутствии ацетил-S-СоА и ингибируется при повышении концентрации ADP. Точно так же АDP ингибирует фосфоенолпируват-карбоксикиназу. Таким образом, обогащение клеток печени топливными молекулами и АТР благоприятствует превращению пирувата в фосфоенолпируват и, следовательно, способствует протеканию глюконеогенеза в целом.
Количество и активности этих принципиальных для гликолиза и глюконеогенза ферментов регулируются на молекулярном уровне. В этом случае регуляторами являются гормоны. Гормоны оказывают влияние на экспрессию генов главным образом путем изменения скорости транскрипции, также регулируя процессы деградации матричных РНК. Например, инсулин, уровень которого возрастает вскоре после еды,

стимулирует экспрессию фосфофруктокиназы, пируват-киназы и бифункционального фермента (фосфофруктокиназы-2) обеспечивающего как образование, так и деградацию фруктозо-2,6-дифосфата. В противоположность этому глюкагон, концентрация которого увеличивается в промежутках между приемами пищи, ингибирует экспрессию указанных выше ферментов, но стимулирует продукцию двух ключевых ферментов глюконеогенеза – фосфоенолпируват-карбоксикиназы и фруктозо-1,6- дифосфатазы. Следует помнить, что регуляция на уровне транскрипции у эукариот занимает намного больше времени, чем аллостерическая регуляция: регуляция на уровне транскрипции «срабатывает» в течение нескольких часов, тогда как изменение активности ферментов под действием аллостерических регуляторов происходит в пределах нескольких секунд или минут.
Рис. 9.14 Промотор гена фосфоенолпируват-карбоксикиназы. Этот промотор имеет размер около 500 пар оснований и содержит регуляторные последовательности (response elements), которые опосредуют действие нескольких гормонов. IRE – последовательность для связывания инсулина, GRE – глюкокортикоидов, TRE – тиреоидного гормона, CREI
и CREII – циклического АМР (McGrane M.M., Jun J.S., Patel Y.M., Hanson R.W., Trends Biochem. Sci., 17, 1992, 40-48).
Сложность гормональной регуляции достаточно наглядно иллюстрирует графическое изображение структуры промотора гена фосфоенолпируват-карбоксикиназы (рис. 9.14), который содержит регуляторные последовательности, реагирующие на воздействие инсулина, глюкагона, глюкокортикоидов и тиреоидного гормона.
Лекция 10
Гликогенолиз и гликогенез
Избыток поступающей извне глюкозы или глюкоза, образованная в ходе фотосинтеза, у многих организмов превращается в соответствующую запасающую полимерную форму: гликоген у позвоночных и микроорганизмов или крахмал у фотосинтезирующих растений. У позвоночных животных и человека гликоген обнаруживается главным образом в печени и скелетных мышцах. Концентрация гликогена в печени значительно превышает его содержание в мышцах, однако в целом запасы гликогена в скелетных мышцах, ввиду их намного большей массы существенно выше, чем в печени. В количественном отношении данный полимер может составлять до 10% от массы печени и до 1-2% от массы скелетных мышц. Если бы это большое количество глюкозы было просто растворено в цитоплазме гепатоцитов, ее концентрация составила бы величину, равную приблизительно 0,4 М. Такая высокая концентрация моносахарида полностью определяла бы осмотические свойства клеток. Однако при образовании своей полимерной формы – гликогена такая же масса глюкозы в клетке составляет концентрацию, равную всего 0,01 μМ.
Гликоген представляет собой очень крупный разветвленный полимер, состоящий из остатков глюкозы, соединенных между собой α-1,4- гликозидными связями. Ветвление молекул гликогена создается посредством образования α-1,6-гликозидных связей, причем на каждые десять остатков глюкозы в составе гликогена приходится одна такая связь. Для сравнения, вспомним, что в молекулах амилопектина, разветвленной фракции крахмала, одна α-1,6-гликозидная связь приходится на каждые двадцать остатков глюкозы.
Как в мышцах, так и в печени гликоген выполняет функцию легко мобилизуемого источника энергии, для аэробного и для анаэробного обмена веществ. В мышцах гликоген может быть расходован за время, составляющее менее одного часа при выполнении интенсивной физической нагрузки. В противоположность мышечному гликогену гликоген печени служит источником глюкозы для других тканей в перерывах между поступлением пищи в организм или в моменты голодания. Это особенно важно для клеток головного мозга, которые не способны использовать жирные кислоты в качестве метаболического топлива. Гликоген печени расходуется обычно в течение 12 – 24 часов. Несмотря на то, что общее количество энергии, запасенное в виде гликогена у человека намного меньше запасов энергии в виде жиров (триацилглицеролов), гликоген незаменим как для аэробного, так и для анаэробного обмена веществ, поскольку жиры не могут превращаться в глюкозу в тканях млекопитающих и не могут подвергаться катаболизму в анаэробных условиях.
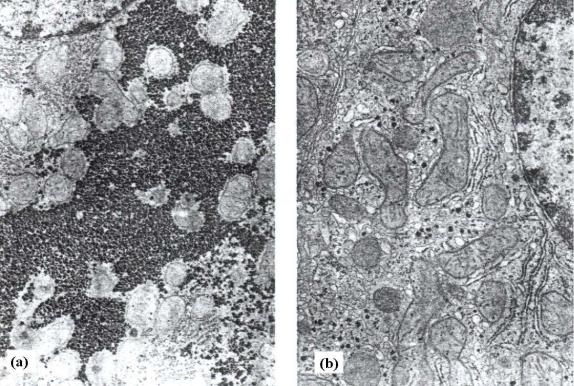
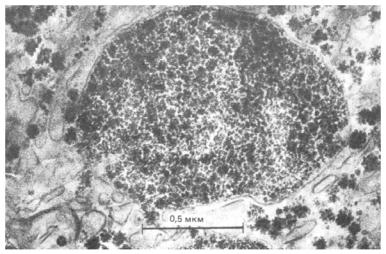
Гликоген запасается в цитоплазме клеток в виде крупных гранул. Элементарная гранула гликогена, обозначаемая β-частицей, и имеющая диаметр 21 нм (210Å) состоит из приблизительно 55.000 остатков глюкозы и отличается наличием примерно 2.000 нередуцирующих концов. Около 20 – 40 таких частиц собираются вместе и образуют, так называемые α-розетки, хорошо видимые с помощью микроскопа в цитоплазме клеток животных после кормления. Такие же гранулы гликогена практически отсутствуют в клетках животных после 24-часового голодания (см. рис. 10.1). Исходя из сказанного выше, следует, что гликогеновые гранулы, присутствующие в цитоплазме клеток, могут отличаться различными размерами. Такие различия в размерах гранул гликогена определяются, в первую очередь, неодинаковыми размерами самих молекул гликогена средняя молекулярная масса, которых составляет приблизительно несколько тысяч килодальтон.
Рис. 10.1 Электронная микрофотография, показывающая гранулы гликогена в гепатоцитах обильно кормленных крыс (а) и почти полное отсутствие таких гранул в печени животных голодавших в течение 24 час (b). Гликоген выглядит как электрон-плотные частицы часто собранные в агрегаты или розетки. В гепатоцитах гранулы гликогена тесно связаны с каналами гладкого эндоплазматического ретикулума. На рисунке также хорошо видны митохондрии (Textbook of Biochemistry with clinical correlations, T.M. Devlin, ed., WILEY-LISS, 1993, стр. 339).
Гликогеновые гранулы, помимо молекул самого гликогена, содержат ферменты, катализирующие синтез и распад этого полисахарида, а также
ферменты, обеспечивающие регуляцию процессов гликогенеза и гликогенолиза. Вместе с тем нужно иметь в виду, что ферментный состав гликогеновых гранул отличается гораздо меньшей степенью упорядоченности структурной организации, чем мультиферментные комплексы, подобные пируват-дегидрогеназному или α-кетоглутарат- дегидрогеназному комплексам.
Синтез и распад гликогена представляет значительный интерес с биохимической точки зрения по целому ряду соображений.
Во-первых, эти процессы имеют большое значение для регуляции уровня глюкозы в крови и создают резерв глюкозы для удовлетворения потребностей интенсивно работающей скелетной мускулатуры.
Во-вторых, синтез и распад гликогена осуществляется в ходе разных метаболических путей, что является иллюстрацией одного из важнейших принципов биохимии.
В-третьих, гормональная регуляция обмена гликогена опосредуется механизмами, имеющими общее значение, что открывает возможности изучения механизмов действия гормонов в функционировании ряда других систем.
В-четвертых, охарактеризованы многочисленные наследственные дефекты ферментов участвующих в синтезе и распаде гликогена, которые приводят к нарушениям обмена гликогена. Многие из этих болезней накопления гликогена приводят к летальному исходу уже в раннем детстве, другие же характеризуются относительно благополучным клиническим течением.
Ферментативное обеспечение гликогенолиза
Первая стадия деградации гликогена зависит от участия фермента – гликоген-фосфорилазы. Этот фермент катализирует фосфоролиз гликогена с образованием глюкозо-1-фосфата. В ходе реакции имеет место расщепление α[1→4]-гликозидных связей с участием неорганического фосфата, причем последовательное отщепление остатков глюкозы от молекулы полисахарида происходит только с нередуцирующего конца.
Механизм реакции, катализируемой гликоген-фосфорилазой существенно отличается от механизма действия α-амилазы, ответственной за расщепление крахмала и гликогена в пищеварительном тракте. Для расщепления α[1→4]- гликозидных связей α-амилаза использует воду, осуществляя гидролитическую деградацию пищевых полисахаридов, в то время как гликоген-фосфорилаза, используя неорганический фосфат осуществляет фосфоролиз гликогена. Важно, что в случае фосфоролиза определенная часть энергии гликозидной связи сохраняется при образовании фосфоэфирной связи в молекуле глюкозо-1-фосфата.
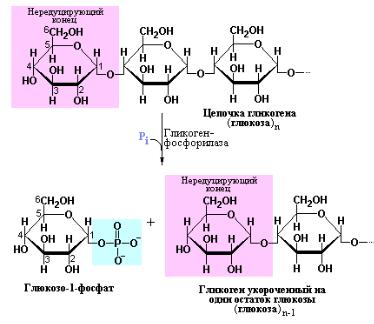
В реакции, катализируемой гликоген-фосфорилазой, существенную роль играет кофактор этого фермента – пиридоксальфосфат при этом его фосфатная группа действует как общий кислый катализатор, облегчающий атаку гликозидной связи неорганическим фосфатом. В данном случае мы имеем дело с необычным свойством пиридоксальфосфата, который типично является кофактором ферментов обмена аминокислот.
Путь распада гликогена был охарактеризован благодаря исследованиям Карла и Герти (Cori C.F., Cori G.T., 1947, Polysaccharide phosphorylase. In: Nobel Lectures: Physiology or Medicine (1942-1962) p 186-206, American Elsevier, 1964). Эти исследователи показали, что гликоген расщепляется в присутствии ортофосфата, давая новый вид фосфорилированного сахара, идентифицированного ими как глюкозо-1-фосфат. Кори удалось также выделить гликоген-фосфорилазу и получить ее в кристаллическом виде. Фосфоролитическое отщепление остатка глюкозы с нередуцирующего конца молекулы гликогена показано на рис. 10.2.
Рис. 10.2 Удаление терминального остатка глюкозы с нередуцирующего конца ветви гликогена под действием гликоген-фосфорилазы. Этот процесс протекает последовательно; фермент удаляет один за другим остатки глюкозы до тех пор, пока не достигнет концевого остатка глюкозы отстоящего от точки ветвления на расстоянии четырех остатков сахара
(Nelson D.L., Cox. M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004).
Суммарная реакция деградации гликогена с участием гликогенфосфорилазы может быть записана следующим образом:
Следующая стадия процесса расщепления гликогена катализируется фосфоглюкомутазой, обеспечивающей образование глюкозо-6-фосфата из глюкозо-1-фосфата:
Эта практически равновесная реакция эффективно используется как при распаде, так и при синтезе гликогена.
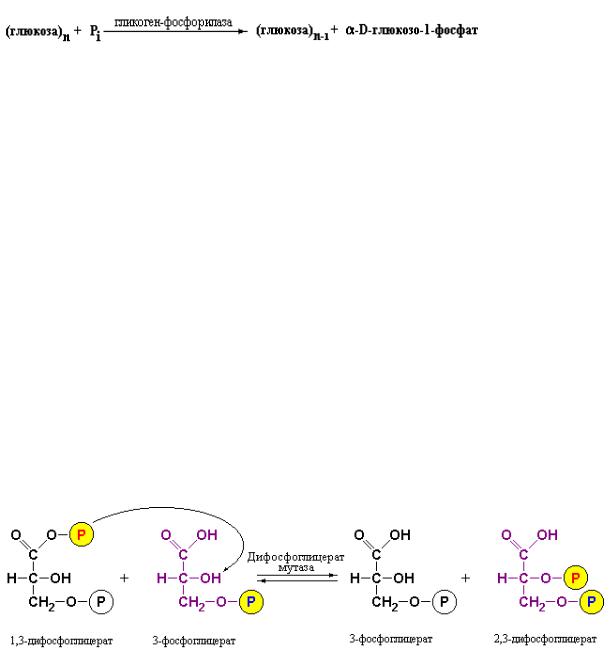
Характерной особенностью данной реакции является то, что ее механизм аналогичен механизму реакции, катализируемой фосфоглицеромутазой, в ходе которой обязательным является участие дифосфата глицерата. 2,3- дифосфоглицерат играет общую роль в качестве кофактора при превращении 3-фосфоглицерата в 2-фосфоглицерат. Кроме того, существует фермент – дифосфоглицератмутаза, который катализирует образование 2,3- дифосфоглицерата из 1,3-дифосфоглицерата и 3-фосфоглицерата. Особенно большое значение эта реакция приобретает в эритроцитах, поскольку 2,3- дифосфоглицерат служит аллостерическим регулятором транспортной функции гемоглобина человека (см. Приложение 7.1).
Подобный механизм, включающий участие дифосфата глюкозы – глюкозо-1,6-дифосфата, характерен для фосфоглюкомутазы. Продукт деградации гликогена, образующийся под действием гликоген-фосфорилазы
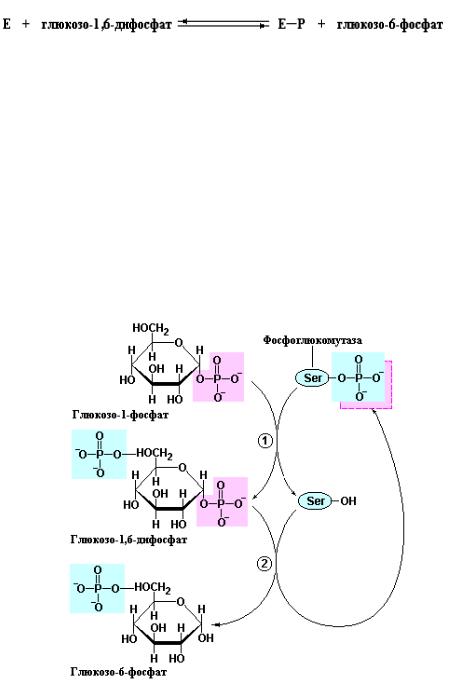
– глюкозо-1-фосфат – превращается, как было указано выше, в глюкозо-6- фосфат. В этом случае также происходит взаимодействие фосфорилированного сахара (глюкозо-1-фосфата) с фосфорилированной формой фермента. При этом изначально фосфорилированный по остатку Ser фермент поставляет свою фосфорильную группу в С-6-положение субстрата (глюкозо-1-фосфата), а затем принимает фосфорильную группу из С-1- положения глюкозо-1,6-дифосфата:
Таким образом, в ходе реакции сначала образуется промежуточное соединение глюкозо-1,6-дифосфат, который в результате перегруппировки остатков ортофосфата превращается в глюкозо-6-фосфат с восстановлением исходной фосфорилированной формы фермента:
Механизм реакции катализируемой фосфоглюкомутазой показан на рис. 10.3.
Рис. 10.3 Реакция катализируемая фосфоглюкомутазой. Реакцию начинает фермент фосфорилированный по остатку Ser в активном центре. На первой стадии (1) фермент поставляет свою фосфорильную группу (показано голубым цветом) глюкозо-1-фосфату образуя при этом глюкозо-1,6-дифосфат. На второй стадии реакции (2) фосфорильная группа в С-1-положении глюкозо-1,6-дифосфата (показана розовым цветом) переносится на фермент, обеспечивая рефосфорилирование фосфоглюкомутазы и образование глюкозо-6-фосфата (Nelson D.L., Cox. M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004).

Поскольку фосфорилированная форма фосфоглюкомутазы относительно нестабильна и подвергается гидролизу до свободного фермента (Е) и неорганического фосфата, существует отдельная реакция катализируемая специфической киназой. Этот фермент обеспечивает генерирование из глюкозо-1-фосфата глюкозо-1,6-дифосфата, который рефосфорилирует любой свободный фермент, образующийся при гидролизе фосфофермента. Итак, эффективность протекания реакции превращения глюкозо-1-фосфата в глюкозо-6-фосфат зависит от присутствия, в каталитических количествах, промежуточного соединения глюкозо-1,6- дифосфата, который образуется специально для этих целей под действием дополнительного фермента – фосфоглюкокиназы:
Следующая стадия процесса гликогенолиза зависит от тканевой принадлежности. Например, глюкозо-6-фосфат, источником которого служит гликоген, в скелетной мышце может непосредственно включаться в гликолиз и служить источником энергии для мышечного сокращения. В печени распад гликогена служит многим целям: и главной из них является выброс глюкозы в кровяное русло, когда уровень сахара в крови снижается (как это имеет место, например, в промежутках между приемами пищи). Этот процесс требует участия дополнительного фермента – глюкозо-6-фосфатазы, которая присутствует в клетках печени и почек, но отсутствует во всех остальных тканях. Фермент является интегральным мембрано-связанным белком эндоплазматического ретикулума гепатоцитов, который, как полагают, содержит девять трансмембранных спиралей с активным центром на полостной стороне мембран ЭР и осуществляет реакцию гидролиза глюкозо- 6-фосфата:
Отсюда следует, что для осуществления данной реакции необходим перенос глюкозо-6-фосфата в эндоплазматический ретикулум. Транспорт образованного в цитоплазме глюкозо-6-фосфата в полость эндоплазматического ретикулума осуществляется с помощью специфического переносчика транслоказы (глюкозо-6-фосфат- транслоказы), обозначенного на рис. 10.4а как переносчик Т1.

Рис. 10.4а Гидролиз глюкозо-6-фосфата под действием микросомальной глюкозо- 6-фосфатазы. Каталитический центр глюкозо-6-фосфатазы обращен в полость эндоплазматического ретикулума гепатоцита. Переносчик глюкозо-6-фосфата (G6P) – Т1 (транслоказа) – транспортирует субстрат из цитоплазмы в полость ЭР, а образующиеся продукты реакции глюкоза и Рi поступают обратно в цитоплазму с помощью переносчиков Т2 и Т3, соответственно. Выход свободной глюкозы из клетки обеспечивает переносчик GLUT2, локализованный в плазматической мембране гепатоцита (Berg J.M., Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006).
Образующиеся в результате совместного действия транслоказы (переносчик Т1) и глюкозо-6-фосфатазы неорганический Рi и свободная глюкоза транспортируются обратно в цитоплазму с участием двух разных переносчиков (Т3 и Т2, соответственно), а покидает клетку глюкоза с помощью совсем иного переносчика в плазматической мембране гепатоцита (GLUT2). Следует указать, что в действительности транслоказа, глюкозо-6- фосфатаза и переносчики Т3 и Т2 не разобщены в мембране ЭР, а, наоборот, формируют слаженно функционирующий ансамбль, причем для проявления своей фосфатазной активности глюкозо-6-фосфатаза нуждается в присутствии специфического Са2+-зависимого стабилизирующего белка, обозначаемого как SP-белок (рис. 10.4б).
Рис. 10.4б Образование свободной глюкозы из глюкозо-6-фосфата. Некоторые
мембраносвязанные белки эндоплазматического ретикулума принимают участие в образовании свободной глюкозы из глюкозо-6- фосфата. Переносчик Т1 транспортирует глюкозо-6-фосфат в просвет ЭР, в то время как переносчики Т2 и Т3 обеспечивают транспорт неорганического фосфата и глюкозы, соответственно, обратно в цитоплазму. Глюкозо-6-фосфатаза стабилизируется Са2+-зависимым белком (SP) (Buchell A., Waddel I.D., Biochim Biophys Acta, 1991, 1092, 129-137).
Отметьте, что расположение активного центра глюкозо-6-фосфатазы внутри мембран эндоплазматического ретикулума позволяет клетке отделить эту реакцию от гликолитического пути распада глюкозы протекающего в цитоплазме. В противном случае глюкозо-6-фосфатаза прерывала бы протекание гликолиза еще в самом начале этой последовательности катаболического превращения углеводов.
Болезни накопления гликогена I типа
Генетические дефекты глюкозо-6-фосфатазы или транслоказы (переносчика Т1) приводят к серьезным нарушениям обмена гликогена,
выражающимся в развитии болезни накопления гликогена типа I или болезни фон Гирке.
Это заболевание является наиболее распространенным среди болезней накопления гликогена и связано с нехваткой, в первую очередь, глюкозо-6- фосфатазы в печени, почках и слизистой оболочке кишечника. Пациенты, страдающие болезнью фон Гирке, подразделяются на две группы в зависимости от дефицита одного из двух ферментов – глюкозо-6-фосфатазы или транслоказы. Болезнь накопления гликогена типа Ia характеризуется дефектом глюкозо-6-фосфатазы, в то время как болезнь типа Ib развивается при дефектах глюкозо-6-фосфат-транслоказы (табл. 10.1). Заболевание передается как аутосомальный рецессивный признак и встречается у 1 из 200.000 человек. Клиническая картина представлена тяжелой формой гипогликемии, кетозом, гиперурикемией, гиперлипидемией и подагрическим артритом.
Тяжелая гипогликемия легко объясняется дефектом глюкозо-6- фосфатазы, что препятствует поддержанию уровня глюкозы в крови за счет мобилизации гликогена в клетках печени.
Побочное развитие молочнокислой ацидемии связано с тем, что печень частично утрачивает способность эффективно использовать лактат в процессе глюконеогенеза. Кроме того, в печени происходит неадекватное накопление молочной кислоты в ответ на действие глюкагона. Гиперурикемия является следствием интенсификации процессов распада пуринов в печени, а гиперлипидемия определяется повышенной доступностью молочной кислоты для процессов липогенеза и мобилизацией
липидов из адипозной ткани, вызванной повышенным уровнем глюкагона в ответ на гипогликемию.
Проявления болезни фон Гирке могут быть заметно снижены при введении в течение всего дня углеводов для уменьшения степени гипогликемии (Cori G.T., Cori C.F., Glucose-6-phosphatase of the liver in glycogen storage disease, J. Biol. Chem., 1952, 199, 661-677).
Деградация молекул гликогена в местах ветвления
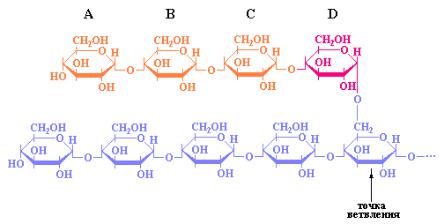
Как было указано выше, первым ферментом, который включается в процесс мобилизации гликогена является гликоген-фосфорилаза, проявляющая специфичность к α[1→4]-глюкозидным связям. Однако под действием только гликоген-фосфорилазы гликоген распадается в ограниченной степени, поскольку α[1→6]-глюкозидные связи, расположенные в точках ветвления молекул данного полисахарида нечувствительны к действию фосфорилазы. Гликоген-фосфорилаза действует последовательно на невосстанавливающие концы ветвей гликогена до тех пор, пока не достигнет концевого остатка глюкозы отстоящего от точки ветвления на расстоянии четырех остатков моносахарида (рис. 10.5) где ее действие приостанавливается.
Рис. 10.5 Структура двух наружных ветвей частицы гликогена, образующихся в результате фосфоролитического расщепления. На расстоянии четырех остатков глюкозы (А, В, С и D) от точки ветвления гликогенфосфорилаза делает остановку.
Такая молекула гликогена, которая была деградирована под действием гликоген-фосфорилазы до указанного выше состояния, называется
декстрином ограниченным фосфорилазой.
Дальнейшее расщепление гликогена под действием гликогенфосфорилазы возможно только при участии дополнительного фермента,

Таблица 10.1
Болезни накопления гликогена человека
|
|
|
|
|
|
|
Название |
Измененный фермент |
|
Поражаемый |
|
Симптомы |
|
заболевания |
|
|
орган |
|
|
|
|
|
|
|
|
|
|
Тип 0 |
Гликоген-синтаза |
|
Печень |
|
|
|
|
|
|
|
|
Тип Iа |
Глюкозо-6-фосфатаза |
|
Печень |
|
|
Болезнь фон Гирке |
|
|
|
|
|
Тип Ib |
Микросомальная |
|
Печень |
|
|
|
глюкозо-6-фосфат |
|
|
|
|
|
транслоказа |
|
|
|
|
|
|
|
|
|
|
Тип Iс |
Микросомальный |
|
Печень |
|
|
|
переносчик Рi |
|
|
|
|
Тип II |
Лизосомальная |
|
Скелетные |
|
|
Болезнь Помпе |
глюкозидаза |
|
мышцы, сердечная |
|
|
|
|
|
мышца |
|
|
|
|
|
|
|
|
Тип IIIа |
Дебранчинг-фермент |
|
Печень, скелетные |
|
|
Болезнь Кори |
|
|
мышцы, сердечная |
|
|
|
|
|
мышца |
|
|
Тип IIIb |
Дебранчинг-фермент |
|
Печень |
|
|
|
печени (дебранчинг- |
|
|
|
|
|
фермент мышц в норме) |
|
|
|
|
Тип IV |
Ветвящий фермент |
|
Печень, скелетные |
|
|
Болезнь Андерсена |
|
|
мышцы |
|
|
|
|
|
|
|
|
Тип V |
Мышечная гликоген- |
|
Скелетные мышцы |
|
|
Болезнь Мак-Ардля |
фосфорилаза |
|
|
|
|
|
|
|
|
|
|
Тип VI |
Печеночная гликоген- |
|
Печень |
|
|
Болезнь Херса |
фосфорилаза |
|
|
|
|
Тип VII |
Мышечная PFK-1 |
|
Мышцы, |
|
|
|
|
|
эритроциты |
|
|
|
|
|
|
|
|
Тип VIb, VIII или IX |
Киназа фосфорилазы |
|
Печень, мышцы, |
|
|
|
|
|
лейкоциты |
|
|
Тип XI |
Переносчик глюкозы |
|
Печень |
|
|
Болезнь Франкони- |
(GLUT2) |
|
|
|
|
Бикеля |
|
|
|
|
|
|
|
|
|
|
|
Низкий уровень глюкозы в крови, высокое содержание кетоновых тел, ранняя смерть Увеличена печень, почечная недостаточность Те же, что и при болезни типа Iа (фон Гирке), высокая чувствительность к бактериальным инфекциям Те же, что и при болезни
типа Iа (фон Гирке) Детская форма: смерть в возрасте до двух лет; подростковая форма: дефекты мышц (миопатия); взрослая форма: мышечная дистрофия
Удетей увеличена печень, миопатия
Удетей увеличена печень
Увеличены печень и селезенка, высокий уровень миоглобина в моче.
Мышечные судороги и боли при физической нагрузке, высокий уровень миоглобина в моче Увеличена печень
Те же, что и при болезни типа V (Мак-Ардля), гемолитическая анемия Увеличена печень
Увеличена печень, рахит, дисфункция почек, остановка в весе
который катализирует реакции, обеспечивающие удаление точек ветвления в молекуле данного полисахарида.
Этот «удаляющий ветвление» фермент, формально известный как
олиго-α-[1→6]→α-[1→4]-глюкантрансфераза называемый также
«дебранчинг»-ферментом, представляет собой бифункциональный энзим, который катализирует две реакции, дающие возможность, в конечном итоге, расщепить α[1→6]-глюкозидную связь. После переноса ветви и гидролиза α[1→6]-гликозидной связи функционирование гликоген-фосфорилазы возобновляется.
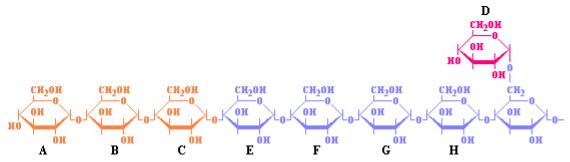
В ходе первой из этих двух реакций проявляется 4-α-D- глюкантрансферазная активность «дебранчинг»-фермента, которая заключается в отщеплении трех глюкозильных остатков из четырех, входящих в состав ответвления. Цепочка из трех остатков глюкозы остается ковалентно связанной с ферментом до тех пор, пока последний не осуществит ее перенос на свободную гидроксильную группу в 4-положении концевого остатка глюкозы этой же самой или соседней молекулы гликогена. Каталитическое действие 4-α-D-глюканотрансферазы иллюстрирует рис. 10.6.
Рис. 10.6 Схема действия «дебранчинг»-фермента. Короткая цепочка из остатков глюкозы А-В-С переносится на 4-гидрокси-группу концевого остатка глюкозы Е.
Как следует из этого рисунка, «дебранчинг»-фермент отщепляет три остатка глюкозы, соединенных в короткую цепочку А-В-С и переносит ее на 4-гидрокси-группу концевого остатка глюкозы Е. В результате такого переноса формируется более длинная амилозная цепь, содержащая только один остаток глюкозы, связанный с амилозной цепочкой α[1→6]- глюкозидной связью. Связь α[1→6] расщепляется гидролитически «дебранчинг»-ферментом, проявляющим в данном случае другую свою активность – амило-α-(1,6)-глюкозидазную (рис. 10.7).
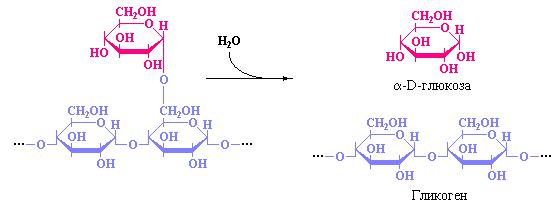
Рис. 10.7 Схема, иллюстрирующая амило-α-(1,6)-глюкозидазную активность «дебранчинг»-фермента
Таким образом, совместное действие гликоген-фосфорилазы и «дебранчинг»-фермента приводит к полному фосфоролизу и, отчасти гидролизу, молекулы гликогена. При расщеплении гликогена, исходя из описанного механизма, на каждую молекулу свободной глюкозы, образованной при действии «дебранчинг»-фермента, приходится 12 молекул глюкозо-1-фосфата, получаемых с помощью гликоген-фосфорилазы. Общая схема процесса гликогенолиза показана на рис. 10. 8.
Болезни накопления гликогена II, III и V типов
Выше уже указывалось, что генетические дефекты глюкозо-6- фосфатазы и глюкозо-6-фосфат-транслоказы лежат в основе возникновения болезни накопления гликогена I типа. Изменение структуры «удаляющего ветвление» фермента также оказывает негативное влияние на состояние обмена гликогена в организме человека.
Болезнь накопления гликогена III типа, называемая также болезнью Кори, затрагивает печень и мышечную ткань и связана с дефектом «дебранчинг»-фермента. Данное заболевание сопровождается накоплением в печени и мышцах гликогена с короткими внешними ветвями, что является результатом мобилизации этого полисахарида под действием только гликоген-фосфорилазы. У пациентов, страдающих данным заболеванием, отмечается преходящее увеличение печени. С возрастом размеры органа уменьшаются. Клинические проявления болезни Кори схожи с проявлениями болезни фон Гирке, но характеризуются более мягким течением, поскольку глюконеогенный путь синтеза глюкозы у этих больных продолжает нормально функционировать. По этой причине состояние гипогликемии не отличается серьезными осложнениями (Van Hoff F., Hers H.G., The subgroups of type III glycogenosis, Eur. J. Biochem., 1967, 2, 265-278).
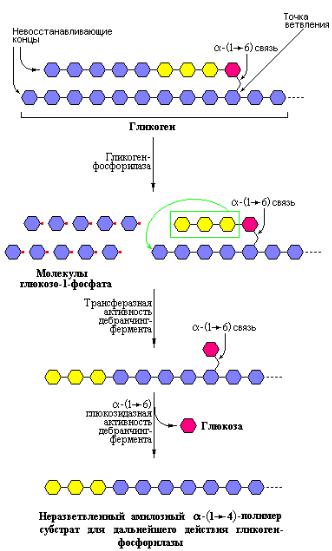
Рис. 10.8 Общая схема деградации молекул гликогена включающая механизм удаления точки ветвления в полисахариде. После поэтапного удаления терминальных остатков глюкозы гликоген-фосфорилазой остатки глюкозы вблизи точки ветвления удаляются в ходе двух-стадийного процесса требующего участия бифункционального «дебранчингфермента». Сначала трансферазная активность фермента обеспечивает перенос блока из трех молекул глюкозы от ответвления на ближайший нередуцирующий конец, к которому этот блок присоединяется обычной α[1→4]-гликозидной связью. Единственный остаток глюкозы остающийся присоединенным к точке ветвления α[1→6]-гликозидной связью высвобождается в виде свободной глюкозы благодаря α[1→6]- глюкозидазной активности «дебранчинг-фермента» (Nelson D.L., Cox. M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004).
Болезнь накопления гликогена V типа или болезнь Мак-Ардля вызвана отсутствием в клетках мышечной ткани гликоген-фосфорилазы (табл. 10.1). Пациенты с данным заболеванием страдают от весьма болезненных мышечных судорог и не способны выполнять интенсивные физические упражнения вследствие недоступности гликогена, который является главным
источником энергии для работающей мышцы. Накопление избыточного количества гликогена в мышцах и его недоступность для мышечной ткани является причиной снижения концентрации лактата в плазме крови ниже нормы. Нарушение целостности клеток мышечной ткани, обусловленное накоплением большого избытка гликогена приводит к выбросу в кровь мышечных ферментов – креатин-фосфокиназы и альдолазы, а также миоглобина. Повышенный уровень в крови указанных белков является свидетельством развития болезни мышц (McArdle B., Myopathy due to a defect in muscle glycogen breakdown, Clin. Sci., 1951, 10, 13-18).
Помимо описанного пути мобилизации гликогена, существует другой, дополнительный, путь деградации данного полисахарида, который зависит от действия лизосомальной α-1,4-глюкозидазы. Этот путь не имеет принципиального значения в случае нормального функционирования α-1,4- глюкозидазы. Однако, при дефектах этого фермента клиницисты сталкиваются с серьезным проявлением одной из болезней накопления гликогена – болезнью Помпе.
Болезнь накопления гликогена II типа или болезнь Помпе (табл. 10.1) возникает в результате генетических дефектов или отсутствия лизосомальной α-1,4-глюкозидазы (называемой также кислой мальтазой). Данный фермент расщепляет гликоген, поступающий в лизосомы в результате обычного обмена мембранными элементами между внутриклеточными мембранными структурами. Отсутствие α-1,4-глюкозидазы приводит к накоплению гликогена в лизосомах клеток практически всех тканей. Это в некоторой степени удивительно. Тем не менее, лизосомы, поглощающие гранулы гликогена, становятся дефектными в отношении других своих функций в том случае, когда они утрачивают способность расщеплять гликоген.
Рис. 10.9 Электронная микрофотография лизосомы клетки печени ребенка, умершего от болезни Помпе. На микрофотографии в составе лизосомы видны частицы гликогена, отличающиеся высокой плотностью и
звездчатой структурой. Заполнение и набухание лизосом происходит вследствие дефекта лизосомальной α-1,4-глюкозидазы, которая, в норме, расщепляет гликоген, поступающий в эти органеллы путем аутофагии (К. де Дюв, Путешествие в мир живой клетки, М., Мир, 1987,
с. 87).
Поскольку при болезни Помпе основные пути гликогенеза и гликогенолиза продолжают функционировать нормально, метаболические нарушения, характерные для болезни фон Гирке не проявляются. Причина избыточного накопления гликогена в лизосомах многих тканей не известна. Болезнь сопровождается развитием кардиореспираторной недостаточности и заканчивается смертью в возрасте до двух лет (Hers H.G., α-Glucosidase deficiency in generalized glycogen storage disease (Pompe/s disease), Biochem. J., 1963, 86, 11-23).
Синтез гликогена
Расщепление и синтез гликогена происходят различными путями. Реакция, катализируемая гликоген-фосфорилазой, в принципе, легко обратима. Действительно, Кори удалось синтезировать гликоген in vitro из глюкозо-1-фосфата с использованием очищенных гликоген-фосфорилазы и «ветвящего» фермента. Однако последующие эксперименты показали, что in vivo гликоген синтезируется совершенно другим путем. В пользу существования иного пути синтеза данного полисахарида говорили следующие факты:
во-первых, реакция, катализируемая гликоген-фосфорилазой, находится в состоянии равновесия, когда соотношение концентраций [Pi]/[глюкозо-1-фосфат] составляет величину равную 3,6 при нейтральном значении рН, тогда как в условиях клетки реальное отношение концентраций данных соединений превышает 100. Отсюда следует, что in vivo фосфорилазная реакция должна идти в направлении распада гликогена;
во-вторых, гормоны, вызывающие повышение активности гликогенфосфорилазы, обычно усиливают мобилизацию гликогена;
в-третьих, больные с полной утратой гликоген-фосфорилазы в мышцах (болезнь Мак-Ардля) сохраняют способность синтезировать мышечный гликоген.
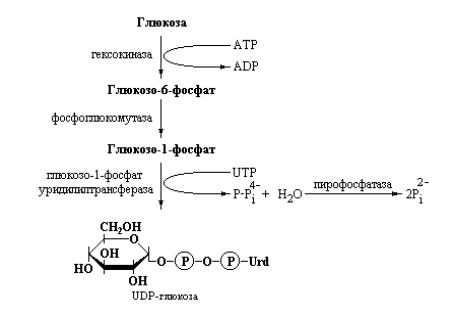
Первая реакция на пути синтеза гликогена подобна реакции,
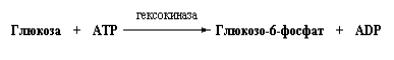
катализируемой печеночной глюкокиназой или гексокиназой периферических тканей:
Вторая реакция катализируется фосфоглюкомутазой – ферментом, общим для процессов распада и синтеза гликогена вследствие легкой обратимости зависящей от него реакции:
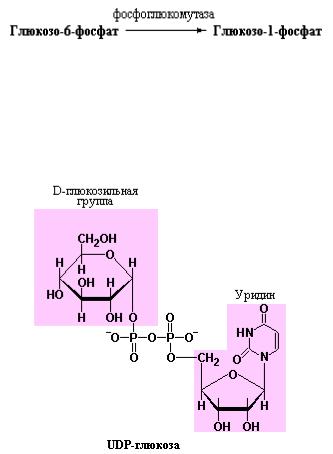
Третья стадия синтеза гликогена была впервые описана в 1957 году аргентинским биохимиком Луи Лелуа и его сотрудниками, которые показали, что для синтеза гликогена необходимо промежуточное образование нуклеотид-сахара – уридиндифосфатглюкозы:
Впоследствии было обнаружено, что множество реакций, в которых происходит превращение одной гексозы в другую или имеет место полимеризация гексоз зависит от участия нуклеотид-сахаров – особых соединений, в которых аномерный атом углерода сахара активируется посредством присоединения к нуклеотиду за счет образования фосфоэфирной связи. Нуклеотид-сахара являются субстратами многих реакций обеспечивающих образование дисахаридов, гликогена, крахмала, целлюлозы и более сложных экстрацеллюлярных полисахаридов. Нуклеотидсахара также являются ключевыми интермедиатами в образовании аминогексоз и дезоксигексоз входящих в состав сложных гетерополисахаридов.
Реакция образования UDP-глюкозы катализируется специфическим ферментом глюкозо-1-фосфат-уридилилтрансферазой (Stalmans W., Hers H.G., Glycogen synthesis from UDPG, In: Boyer P.D. (ed), The Enzymes (3rd ed), 1973, vol 9, pp 310-361, Academic Press). UDP-глюкоза, выступающая в роли донора глюкозы в процессе биосинтеза гликогена, представляет собой активированную форму данного моносахарида, подобно тому, как АТР и
ацетил-СоА являются активированными формами ортофосфата и ацетата, соответственно.
Итак, третья, ключевая, стадия синтеза гликогена заключается в образовании промежуточной активированной формы глюкозы – UDPглюкозы, являющейся продуктом реакции конденсации глюкозо-1-фосфата с
UTP, катализируемой глюкозо-1-фосфат-уридилилтрансферазой (UDP-
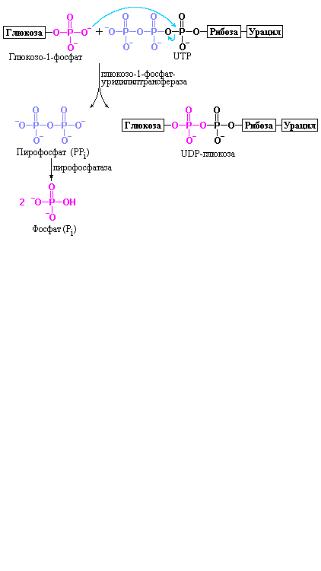
глюкозо-пирофосфорилазой). Заметьте, что в скобках приводится второе название одного и того же фермента, отражающее ход реакции в обратную сторону. В реальных условиях клетки, несмотря на потенциальную обратимость этой реакции, происходит образование UDP-глюкозы, а не распад вследствие того, что второй продукт реакции – неорганический пирофосфат быстро гидролизуется под действием пирофосфатазы, сдвигая равновесие процесса в сторону синтеза UDP-глюкозы. Процесс образования UDP-глюкозы показан на рис. 10.10.
Рис. 10.10 Образование UDP-глюкозы. Реакция конденсации протекает между уридин-трифосфатом и глюкозо-1-фосфатом. Отрицательно заряженный атом кислорода в молекуле глюкозо-1-фосфата выступает в роли нуклеофила, атакуя α-фосфатную группу уридин-трифосфата и вытесняя пирофосфат. Реакция идет в прямом направлении за счет гидролиза РРi под действием пирофосфатазы (Nelson D.L., Cox. M.M.,
Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004).
Пирофосфат, освобождающийся в ходе этой реакции, происходит из двух фосфорильных α- и β-остатков UTP. В принципе, как упоминалось, реакция легко обратима, но в условиях in vivo она становится необратимой вследствие необратимой по своей природе сопутствующей реакции гидролиза неорганического пирофосфата под действием пирофосфатазы:
Общая последовательность реакций, приводящих к образованию UDPглюкозы, приведена на рис. 10.11.
Рис. 10.11 Схема последовательности реакций, в ходе которых происходит образование активированной формы глюкозы – UDP-глюкозы, необходимой для синтеза гликогена.
В процессе биосинтеза гликогена UDP-глюкоза является непосредственным донором активированных остатков сахара в реакции, катализируемой гликоген-синтазой, которая обеспечивает перенос глюкозильных остатков от UDP-глюкозы на невосстанавливающий конец ветви растущей молекулы гликогена (рис. 10.12). Гликоген-синтаза является узкоспецифичным ферментом, который переносит активированный глюкозильный остаток на гликоген так, что образуется новая α[1→4]- глюкозидная связь между гидроксильной группой по С1-положению в активированном сахаре и гидроксильной группой по С4-положению глюкозильного остатка растущей цепи гликогена (рис. 10.12) при этом фермент не способен образовывать α[1→6]-глюкозидные связи.
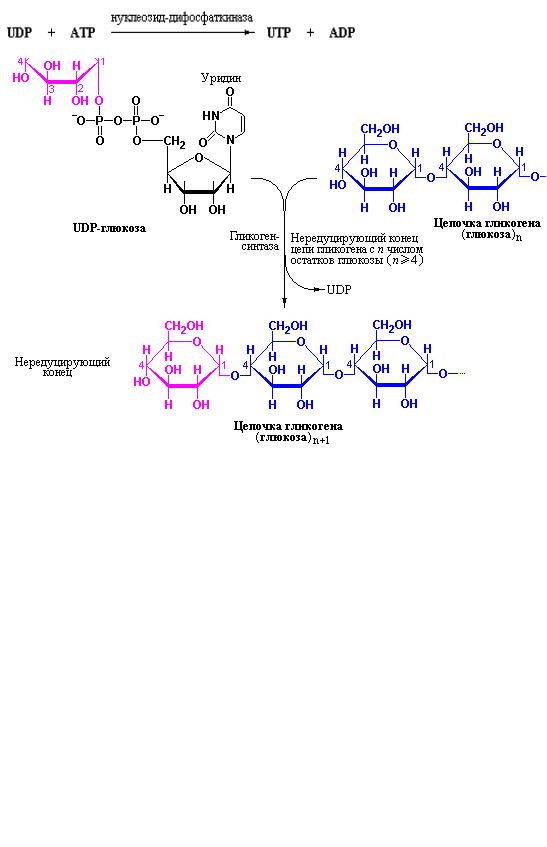
Рис. 10.12 Синтез гликогена. Цепь гликогена удлиняется под действием гликогенсинтазы. Фермент переносит остаток глюкозы от UDP-глюкозы на нередуцирующий конец ветви гликогена с образованием новой α[1→4]-
связи (Nelson D.L., Cox. M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004).
Как следует из приведенной выше схемы реакции, восстанавливающий (редуцирующий) конец молекулы глюкозы всегда добавляется к нередуцирующему концу увеличивающейся цепи гликогена. Необходимо отметить, что молекула гликогена, невзирая на ее размеры, теоретически имеет только один восстанавливающий конец, который спрятан в глубине молекулы. Другим важным обстоятельством гликоген-синтазной реакции является то, что второй продукт представлен UDP, а не UMP. Поэтому UDP может быть легко превращен в исходную форму нуклеозидтрифосфата – UTP
под действием нуклеозид-дифосфаткиназы:
Поскольку гликоген-синтаза является узкоспецифичным ферментом, который катализирует образование только α[1→4]-связей и не способен образовывать α[1→6]-глюкозидные связи действие только одной гликоген-
синтазы может обеспечить образование лишь амилозы – линейного полимера глюкозы, в котором мономерные звенья соединены α[1→4]-гликозидными связями. Более того, нужно иметь в виду, что гликоген-синтаза осуществляет присоединение глюкозильных остатков только при условии, что полисахаридная цепь уже содержит не менее четырех остатков глюкозы.
Это, в свою очередь, должно означать, что для синтеза гликогена de novo требуется наличие затравки – праймера, который, очевидно, формируется
другим особым ферментом.
Образование α[1→6]-связей зависит от действия другого также специфического фермента участвующего в биосинтезе гликогена называемого амило-[1→4]→[1→6]-трансгликозилазой или глюкозил-[4→6]-
трансферазой. Очень часто этот фермент называют также гликоген «ветвящим» ферментом. Гликоген «ветвящий» фермент катализирует перенос концевого амилозного фрагмента с нередуцирующегот конца ветви гликогена построенной под действием гликоген-синтазы на С-6- гидроксильную группу остатка глюкозы расположенного ближе к центру молекулы гликогена на той же или другой ветви данного гомополисахарида. Тем самым происходит образование новой ветви гликогена. После этого гликоген-синтаза продолжает добавлять остатки глюкозы к вновь образованной ветви.
Итак, в условиях in vivo, как только происходит образование цепочки амилозы, включающей, по крайней мере, 11 остатков глюкозы, в действие вступает «ветвящий» фермент. Ветвление молекулы гликогена имеет большое значение в том смысле, что оно сильно повышает растворимость данного гомополисахарида. Кроме того, благодаря ветвлению создается большое число нередуцирующих концов, которые, в свою очередь, являются местами действия гликоген-фосфорилазы и гликоген-синтазы. Таким образом, ветвление способствует увеличению скорости и эффективности как синтеза, так и расщепления молекул данного резервного полисахарида.
Механизм действия 1,4-α-глюкан-ветвящего фермента основан на его способности отщеплять от амилозного фрагмента гликогена цепочку, состоящую из 7 остатков глюкозы и переносить ее ближе к внутренней части молекулы с образованием α[1→6]-гликозидной связи. «Ветвящий» фермент обладает чрезвычайно высокой строгой специфичностью. Эта специфичность проявляется в том, что амилозная цепочка, состоящая из 7 остатков глюкозы, должна непременно включать невосстанавливающий конец и может отщепляться только от цепи длиной не менее 11 остатков. Кроме того, новая точка ветвления должна быть отделена от соседней точки ветвления, по меньшей мере, четырьмя остатками глюкозы. Схема действия «ветвящего» фермента показана на рис. 10. 13.
