
- •Автор:
- •ISBN 978-985-6823-61-2
- •Д. Мецлер
- •Введение
- •Пищеварительные ферменты секретируются в виде зимогенов
- •Апикальная сторона
- •Базальная сторона
- •Всасывание и секреция электролитов
- •Секреция соляной кислоты обкладочными клетками желудка
- •Баланс азота и азотистое равновесие
- •Нормы белка в питании
- •Биологическая ценность белков
- •Обмен простых белков
- •Переваривание белков в желудке
- •Действие пепсина
- •Таблица 3.1
- •Субстратная специфичность протеиназ желудочно-кишечного тракта
- •Активный фермент
- •Зимоген
- •Активатор
- •Пепсин А
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Трипсиноген
- •Химотрипсиноген
- •Проэластаза
- •Карбоксипептидаза А
- •Карбоксипептидаза В
- •Аминопептидаза
- •Трипсин
- •Трипсин
- •Трипсин
- •Механизм активации химотрипсиногена
- •Общие свойства семейства сериновых протеиназ
- •Нарушения процессов переваривания белков
- •Механизм действия карбоксипептидазы А
- •Всасывание свободных аминокислот
- •Всасывание интактных белков
- •Лекция № 4
- •Обмен аминокислот в норме и при патологии
- •Общие реакции аминокислот
- •Оксидазы аминокислот
- •Реакции аммиака
- •Цикл мочевины
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат синтетаза
- •Орнитин транскарбамоилаза
- •Аргининосукцинат синтетаза
- •Аргининосукцинат лиаза
- •Аргиназа
- •Обмен индивидуальных аминокислот в норме и при патологии
- •Таблица 5.1
- •Значение клетчатки в питании человека
- •Таблица 6.1
- •Целлюлоза
- •Гемицеллюлоза
- •Лигнин
- •Пектин
- •Фрукты
- •Камеди
- •Непрямые эффекты рафинированных углеводов
- •Переваривание и всасывание углеводов
- •Таблица 6.2
- •Название
- •углевода
- •Тип связи
- •Структура
- •Амилопектин
- •Амилоза
- •Сахароза
- •Трегалоза
- •Молодые грибы
- •Лактоза
- •Фруктоза
- •Фрукты, мед
- •Глюкоза
- •Раффиноза
- •Бобовые
- •Таблица 6.3
- •Продукт реакции
- •Амилоза
- •Глюкоза
- •Глюкоза
- •Глюкоза
- •Сахароза
- •Глюкоза, фруктоза
- •Трегалоза
- •Глюкоза
- •Глюкоза, церамид
- •Лактоза
- •Глюкоза, галактоза
- •Всасывание моносахаридов
- •Таблица 6.4
- •Базальная поверхность
- •Хорошие субстраты
- •Флоризин
- •Цитохалазин В
- •Гипоксические повреждения тканей
- •Субстратные циклы
- •Гипогликемия у недоношенных детей
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Таблица 9.1
- •Cостав пируват-дегидрогеназного комплекса млекопитающих
- •Таблица 9.3
- •Кофакторы и простетические группы пируват-дегидрогеназы
- •Локализация
- •Регуляция пируватдегидрогеназного комплекса
- •Глюконеогенез
- •Особенности синтеза гликогена: гликогенин в роли праймера
- •Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
- •Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
- •Генетические дефекты структуры коллагена
- •ПРИЛОЖЕНИЕ 6.1
- •Функция
- •ПРИЛОЖЕНИЕ 7.1
- •Обмен 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •ПРИЛОЖЕНИЕ 7.2
- •Гликолиз и рак
- •Таблица 7.2.1
- •Белок/фермент
- •Функция
- •Лизосомные болезни накопления
- •Дополнительная литература
- •Окислительное декарбоксилирование
- •Регуляция пируватдегидрогеназного комплекса
- •Нарушения метаболизма, связанные с дефектами
- •пируватдегидрогеназы
- •Глюконеогенез
- •Регуляция активности пируват-карбоксилазы
- •Глюконеогенез и гликолиз регулируются реципрокно
- •Гликогенолиз и гликогенез
- •Ферментативное обеспечение гликогенолиза
- •Болезни накопления гликогена I типа
- •Деградация молекул гликогена в местах ветвления
- •Болезни накопления гликогена II, III и V типов
- •Синтез гликогена
- •Особенности синтеза гликогена: гликогенин
- •в роли праймера
- •Цикл Кори
- •Гипогликемия и алкогольная интоксикация
- •Пентозофосфатный путь
- •Неокислительные реакции пентозофосфатного пути
- •Синдром Вернике-Корсакова
- •Генетические дефекты структуры коллагена
- •Биосинтез полиаминов
- •Катаболизм полиаминов
- •Клиническое значение 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •Рекомендуемая литература
- •Основная литература
- •Дополнительная литература
трипсину в силу практически идеальной комплементарности его структуры активному центру фермента. Между полипептидными цепями фермента и ингибитора возникает вследствие этой комплементарности большое число водородных связей. Примечательной особенностью этого взаимодействия является необычная устойчивость комплекса к действию 8 М мочевины или 6 М гуанидингидрохлорида, хотя в обычных случаях эти денатурирующие агенты всегда вызывают диссоциацию олигомеров белка на субъединицы.
Таким образом, присутствие ингибитора трипсина успешно предотвращает преждевременное образование свободных протеолитических ферментов поджелудочной железы.
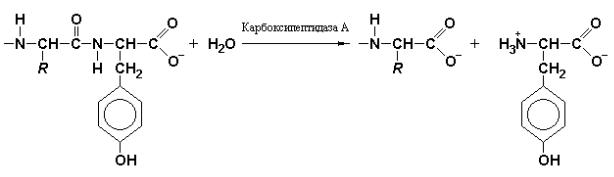
Механизм действия карбоксипептидазы А
Для осуществления наиболее полного переваривания белков, в тонком кишечнике присутствует протеолитический фермент панкреатического происхождения, который обеспечивает отщепление аминокислот с С-конца гидролизуемых пептидов и полипептидов. Особенно легко гидролизируются пептидные связи, образованные с С-концевыми ароматическими кислотами
(рис. 3.16).
Рис. 3.16 Реакция, катализируемая карбоксипептидазой А.
Прежде, чем перейти к более подробному рассмотрению механизма действия карбоксипептидазы А необходимо остановиться на двух особенностях фермента:
−связывание субстрата носит характер индуцированного соответствия, которое выражается в значительных изменениях структуры фермента после взаимодействия с субстратом;
−в активном центре карбоксипептидазы А содержится атом цинка, который вместе с другими группами вызывает смещение (перераспределение) электронов в субстрате, облегчая процесс гидролиза.

Трехмерную структуру карбоксипептидазы А с помощью рентгеноструктурного анализа с разрешением 2Å описал в 1971 году Вильям Липскомб. (Lipscomb W. N., Structure and mechanisms of enzymes, Proc. Robert
A.Welch Found. Conf. Chem. Res., 1971, 15, 131-156; Quiocho F. A., Lipscomb W. N., Carboxypeptidase A: protein and an enzyme, Advan. Protein Chem., 1971,
25, 1-78). Фермент содержит одну полипептидную цепь из 307 аминокислот,
имеет компактную эллипсоидную форму с размерами 50×42×38Å. С белком прочно связан атом цинка, расположенный в углублении близко к поверхности. Атом цинка образует координационные связи в виде тетраэдра с двумя гистидинами (His-69 и His-196) основной цепи, боковой цепью глутаминовой кислоты – Glu-72 и молекулой воды (рис. 3.17).
Рис. 3.17 Ион цинка, расположенный в активном центре карбоксипептидазы А, образует четыре координационные связи с радикалами двух остатков гистидина и остатком глутаминовой кислоты. Четвертую координационную связь занимает молекула воды.
Рядом с атомом цинка располагается большой неполярный «карман» для связывания ароматического радикала субстрата.
Рис. 3.18 Схематическое изображение связывания глицилтирозина в активном центре карбоксипептидазы А. Показан постулированный каталитически активный комплекс. Остаток глицина выделен красным цветом, остаток тирозина – зеленым.
Представления о характере взаимодействия субстрата с карбоксипептидазой А возникли на основе данных, полученных при изучении структуры комплекса фермента с глицилтирозином – дипептидом, который крайне медленно гидролизуется (рис. 3.18). Было показано, что в связывании субстрата принимают участие: остаток глутаминовой кислоты – Glu-270, а также остатки аргинина (Arg-145) и тирозина (Tyr-248).
Отрицательно заряженная С-концевая карбоксильная группа субстрата электростатически взаимодействует с положительно заряженным радикалом Arg-145. Ароматический радикал глицилтирозина связывается в гидрофобном кармане фермента. Водород NH-группы расщепляемой пептидной связи образует водородную связь с OH-группой Tyr-248. Карбонильный кислород гидролизуемой пептидной связи вступает в координационную связь с атомом Zn, а концевая аминогруппа глицилтирозина образует через встроенную воду (не показано) водородную связь с карбоксильной группой Glu-270. Последний тип взаимодействия скорее всего не имеет места в активном ES-комплексе и, вероятно, является причиной низкой скорости гидролиза глицилтирозина.
Связывание глицилтирозина вызывает структурную перестройку активного центра, в результате чего каталитические группы фермента принимают правильную ориентацию согласно модели индуцированного соответствия. Боковые цепи Arg-145 и Glu-270 перемещаются на 2 Å, в то время как гидроксифенил Tyr-248 перемещается на 12 Å, т.е. на расстояние равное ¼ диаметра молекулы фермента. Взаимодействие кислорода карбонильной группы расщепляемой пептидной связи с атомом цинка приводит к вытеснению воды из четвертого координационного положения (см. рис. 3.17). По крайней мере, еще четыре молекулы воды вытесняются из неполярного «кармана» фермента при связывании в нем тирозиновой боковой цепи субстрата. При перемещении Tyr-248 его гидроксильная группа, находившаяся на поверхности фермента, оказывается вблизи пептидной связи субстрата. В результате закрывается полость активного центра и тем самым завершается ее превращение из области, заполненной водой, в гидрофобную область.
На основе данных рентгеноструктурного анализа были предложены два механизма действия карбоксипептидазы А (Breslow R., Wernick D.L., Unified picture of mechanisms of catalysis by carboxypeptidase A, Proc. Nat. Acad. Sci. USA, 1977, 74, 1303-1307). Один из механизмов реализуется при гидролизе эфиров, тогда как другой механизм обеспечивает расщепление пептидных связей. Поскольку нас, в первую очередь, интересует гидролиз именно пептидных связей, ограничимся рассмотрением последнего механизма.
В соответствии со вторым механизмом катализа, остаток глутаминовой кислоты Glu-270 активирует молекулу воды. Образующийся OH¯-ион атакует карбонильный атом углерода расщепляемой связи. Одновременно
