
- •Автор:
- •ISBN 978-985-6823-61-2
- •Д. Мецлер
- •Введение
- •Пищеварительные ферменты секретируются в виде зимогенов
- •Апикальная сторона
- •Базальная сторона
- •Всасывание и секреция электролитов
- •Секреция соляной кислоты обкладочными клетками желудка
- •Баланс азота и азотистое равновесие
- •Нормы белка в питании
- •Биологическая ценность белков
- •Обмен простых белков
- •Переваривание белков в желудке
- •Действие пепсина
- •Таблица 3.1
- •Субстратная специфичность протеиназ желудочно-кишечного тракта
- •Активный фермент
- •Зимоген
- •Активатор
- •Пепсин А
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Трипсиноген
- •Химотрипсиноген
- •Проэластаза
- •Карбоксипептидаза А
- •Карбоксипептидаза В
- •Аминопептидаза
- •Трипсин
- •Трипсин
- •Трипсин
- •Механизм активации химотрипсиногена
- •Общие свойства семейства сериновых протеиназ
- •Нарушения процессов переваривания белков
- •Механизм действия карбоксипептидазы А
- •Всасывание свободных аминокислот
- •Всасывание интактных белков
- •Лекция № 4
- •Обмен аминокислот в норме и при патологии
- •Общие реакции аминокислот
- •Оксидазы аминокислот
- •Реакции аммиака
- •Цикл мочевины
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат синтетаза
- •Орнитин транскарбамоилаза
- •Аргининосукцинат синтетаза
- •Аргининосукцинат лиаза
- •Аргиназа
- •Обмен индивидуальных аминокислот в норме и при патологии
- •Таблица 5.1
- •Значение клетчатки в питании человека
- •Таблица 6.1
- •Целлюлоза
- •Гемицеллюлоза
- •Лигнин
- •Пектин
- •Фрукты
- •Камеди
- •Непрямые эффекты рафинированных углеводов
- •Переваривание и всасывание углеводов
- •Таблица 6.2
- •Название
- •углевода
- •Тип связи
- •Структура
- •Амилопектин
- •Амилоза
- •Сахароза
- •Трегалоза
- •Молодые грибы
- •Лактоза
- •Фруктоза
- •Фрукты, мед
- •Глюкоза
- •Раффиноза
- •Бобовые
- •Таблица 6.3
- •Продукт реакции
- •Амилоза
- •Глюкоза
- •Глюкоза
- •Глюкоза
- •Сахароза
- •Глюкоза, фруктоза
- •Трегалоза
- •Глюкоза
- •Глюкоза, церамид
- •Лактоза
- •Глюкоза, галактоза
- •Всасывание моносахаридов
- •Таблица 6.4
- •Базальная поверхность
- •Хорошие субстраты
- •Флоризин
- •Цитохалазин В
- •Гипоксические повреждения тканей
- •Субстратные циклы
- •Гипогликемия у недоношенных детей
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Таблица 9.1
- •Cостав пируват-дегидрогеназного комплекса млекопитающих
- •Таблица 9.3
- •Кофакторы и простетические группы пируват-дегидрогеназы
- •Локализация
- •Регуляция пируватдегидрогеназного комплекса
- •Глюконеогенез
- •Особенности синтеза гликогена: гликогенин в роли праймера
- •Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
- •Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
- •Генетические дефекты структуры коллагена
- •ПРИЛОЖЕНИЕ 6.1
- •Функция
- •ПРИЛОЖЕНИЕ 7.1
- •Обмен 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •ПРИЛОЖЕНИЕ 7.2
- •Гликолиз и рак
- •Таблица 7.2.1
- •Белок/фермент
- •Функция
- •Лизосомные болезни накопления
- •Дополнительная литература
- •Окислительное декарбоксилирование
- •Регуляция пируватдегидрогеназного комплекса
- •Нарушения метаболизма, связанные с дефектами
- •пируватдегидрогеназы
- •Глюконеогенез
- •Регуляция активности пируват-карбоксилазы
- •Глюконеогенез и гликолиз регулируются реципрокно
- •Гликогенолиз и гликогенез
- •Ферментативное обеспечение гликогенолиза
- •Болезни накопления гликогена I типа
- •Деградация молекул гликогена в местах ветвления
- •Болезни накопления гликогена II, III и V типов
- •Синтез гликогена
- •Особенности синтеза гликогена: гликогенин
- •в роли праймера
- •Цикл Кори
- •Гипогликемия и алкогольная интоксикация
- •Пентозофосфатный путь
- •Неокислительные реакции пентозофосфатного пути
- •Синдром Вернике-Корсакова
- •Генетические дефекты структуры коллагена
- •Биосинтез полиаминов
- •Катаболизм полиаминов
- •Клиническое значение 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •Рекомендуемая литература
- •Основная литература
- •Дополнительная литература
|
|
|
Таблица 9.3 |
|
Кофакторы и простетические группы пируват-дегидрогеназы |
||
|
|
|
|
|
Кофермент, |
Локализация |
Функции |
|
простетическая |
|
|
|
группа |
|
|
|
|
|
|
|
|
|
|
|
Тиаминпирофосфат |
Связан с пируват-дегидрогеназой |
Реагирует с пировиноградной |
|
|
|
кислотой |
|
Липоевая кислота |
Ковалентно связана с ε-аминогруппой |
Принимает ацетильную группу от |
|
остатка лизина в активном центре |
||
|
|
дигидролипоил-трансацетилазы |
тиаминпирофосфата |
|
|
|
|
|
Коэнзим А-SH |
Находится в растворе |
Принимает ацетильную группу от |
|
липоамидной группировки в |
||
|
|
|
трансацетилазе |
|
|
|
|
|
|
Прочно связан с дигидролипоил- |
Принимает восстанавливающие |
|
FAD |
эквиваленты от восстановленной |
|
|
дегидрогеназой |
липоамидной группы |
|
|
|
|
|
|
|
|
Терминальный акцептор |
|
NAD+ |
Находится в растворе |
восстанавливающих эквивалентов от |
|
восстановленного флавопротеида |
||
|
|
|
|
|
|
|
|
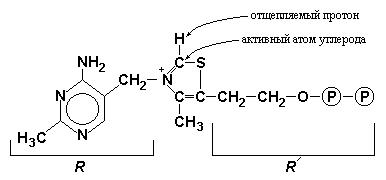
Ключевой особенностью ТПФ – простетической группы пируватдегидрогеназного компонента – является то, что атом углерода расположенный между атомами азота и серы в тиазоловом кольце обладает намного более кислыми свойствами (значение рКа равно приблизительно 10), чем большинство ═С― групп.
Рис. 9.2 Структурная формула тиаминпирофосфата (показан активный атом углерода тиазолового кольца, который после отщепления протона превращается в карбанион).
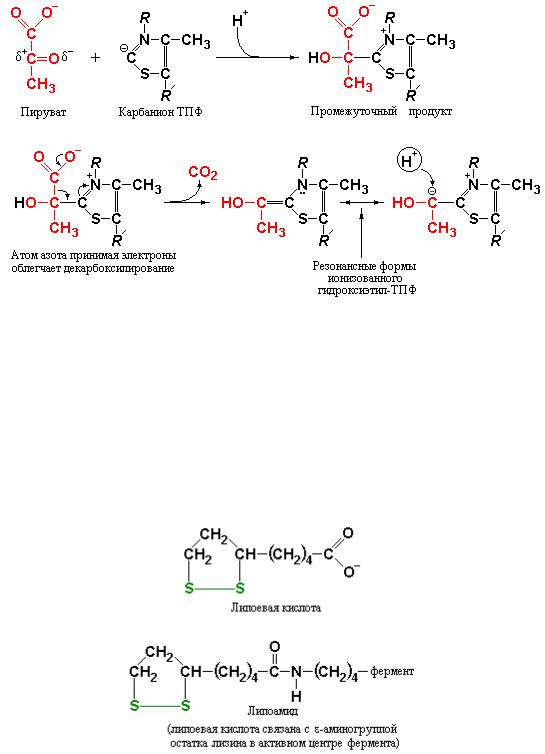
Этот атом углерода легко ионизуется с образованием карбаниона, который связывается с карбонильной группой пировиноградной кислоты. Положительно заряженный атом азота в тиазоловом кольце ТПФ принимает на себя электроны, обеспечивая тем самым формирование отрицательного заряда на пирувате, необходимого для декарбоксилирования последнего. В результате последующего протонирования образуется гидроксиэтил-ТПФ:
Рис. 9.3 Схема первой стадии реакции окислительного декарбоксилирования пирувата. Промежуточный продукт реакции подвергается декарбоксилированию с образованием ионизованной формы гидроксиэтил-тиаминпирофосфата.
На следующей стадии гидроксиэтильная группировка у ТПФ окисляется до ацетильной группы, которая переносится на липоамид – производное липоевой кислоты связанной амидной связью с остатком лизина трансацетилазного компонента комплекса.
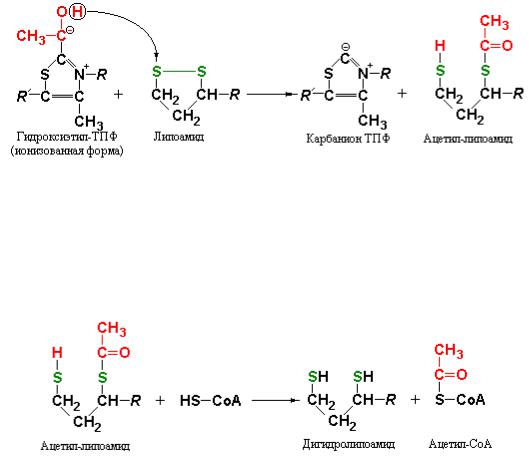
Окислителем в этой реакции является дисульфидная группа липоамида, которая восстанавливается в свою дисульфгидрильную форму. Эта реакция также катализируемая пируват-дегидрогеназным компонентом (Е1) приводит к образованию ацетиллипоамида:
Рис. 9.4 Схема второй стадии реакции окислительного декарбоксилирования пирувата. В результате окисления ионизованного гидроксиэтила образуется ацетильная группа, переносимая на липоамид.
На третьей стадии ацетильная группа переносится с ацетиллипоамида на присутствующий в растворе HS-СоА, образуя ацетил-S-СоА:
Рис. 9.5 Стадия образования ацетил-СоА, катализируемая дигидролипоилтрансацетилазным компонентом пируват-дегидрогеназного комплекса.
Данная стадия катализируется дигидролипоил-трансацетилазой (Е2). При переносе ацетильной группы с ацетиллипоамида на HS-СоА сохраняется богатая энергией тиоэфирная связь. Следует отметить, что HS-CoA служит в качестве переносчика большого количества активированных ацильных групп, среди которых ацетильная группа является наиболее простой. Таким образом, ацетил-S-CoA, являющийся топливом для цикла лимонной кислоты, образуется из пирувата, который накапливается в ходе гликолитического распада глюкозы.
Пируват-дегидрогеназный комплекс не сможет вступить в следующий цикл катализа до тех пор, пока дигидролипоамид не будет снова окислен в липоамид. Поэтому на следующей стадии реакции происходит регенерация окисленной формы липоамида с участием дигидролиплил-дегидрогеназного компонента (Е3). При этом два электрона переносятся на FAD –
простетическую группу компонента Е3, а затем на NAD+ с образованием NADH (Н+). Такой транспорт электронов от FADH2 на NAD+ является необычным поскольку, как правило, FAD является акцептором электронов переносимых от NADH (Н+). Однако в данном случае при взаимодействии с ферментом величина окислительно-восстановительного потенциала FAD изменяется, что позволяет ему восстанавливать NAD+.
Подвижность связи липоамида с дигидролипоил-трансацетилазой дает возможность этому кофактору перемещаться между различными активными центрами пируват-дегидрогеназного комплекса
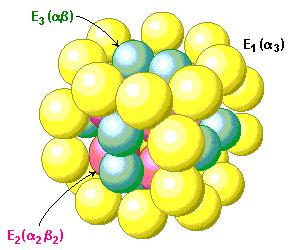
Несмотря на то, что структура представителей семейства пируватдегидрогеназных комплексов в интактном состоянии до сих пор не установлена на атомном уровне, по отдельности структуры всех компонентов комплекса известны, хотя эти компоненты выделены из разных комплексов различных видов организмов. Тем не менее, в настоящее время уже появилась возможность сконструировать модель комплекса (рис. 9.6), которая позволяет понять детали катализа.
Рис. 9.6 Схематическое изображение пируват-дегидрогеназного комплекса. На рисунке красным цветом показан трансацетилазный кор (Е2), пируватдегидрогеназный компонент (Е1) выделен желтым цветом и дигидролипоил-дегидрогеназа (Е3) указана зеленым цветом (Berg J.M.,
Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006).
Кор комплекса построен из дигидролипоил-трансацетилазы (Е2). Трансацетилаза состоит из восьми каталитических тримеров (α3) собранных в виде полого куба. Каждая из трех субъединиц формирующих тример включает три основных домена (рис. 9.7). N-концевая последовательность каждой субъединицы формирует небольшой домен, который содержит липоамид, связанный ε-аминогруппой остатка лизина. Этот домен гомологичен биотин-связующим доменам, таким как, например, домены
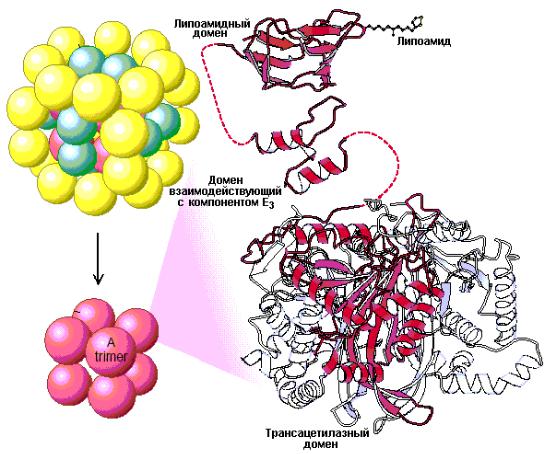
пируват-карбоксилазы. За липоамидным доменом следует также небольшой домен ответственный за взаимодействие с дигидролипоил-дегидрогеназой (Е3) в составе комплекса. Крупный трансацетилазный домен завершает структуру субъединицы Е2. Субъединицы Е1 представлены тетрамерами с общей формулой α2β2, а субъединицы Е3 являются αβ-димерами. Двадцать четыре копии субъединиц Е1 и 12 копий субъединиц Е3 окружают дигидролипоил-трансацетилазный кор Е2. Каким же образом три различных каталитических сайта согласованно функционируют в составе мультиферментного комплекса?
Рис. 9.7 Структура трансацетилазного кора (Е2). Каждый красный шарик представляет собой тример состоящий из субъединиц Е2. В свою очередь каждая субъединица состоит из трех доменов: липоамидсвязующего домена, небольшого домена ответственного за взаимодействие с дигидролипоил-дегидрогеназой (Е3) и крупного каталитического трансацетилазного домена. Все три субъединицы трансацетилазного домена показаны в виде лент, а одна из них выделена красным цветом (Berg J.M., Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006).
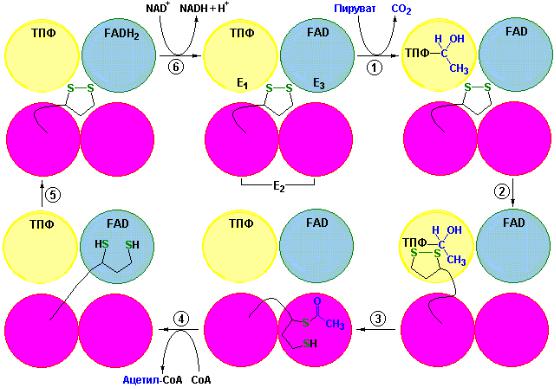
Последовательность событий, происходящих в активных центрах компонентов пируват-дегидрогеназного комплекса, выглядит следующим образом (рис. 9.8):
Рис. 9.8 Реакции пируват-дегидрогеназного комплекса. На рисунке вверху в
центре показан фермент (изображен желтым, голубым и двумя красными кружками), не модифицированный и готовый к началу катализа. 1 – декарбоксилирование пирувата с образованием гидроксиэтил-ТПФ. Реакция катализируется пируват-дегидрогеназным компонентом комплекса (Е1). 2 – липоамид, принадлежащий дигидролипоил-трансацетилазе (Е2), перемещается в активный центр Е1. 3 – Е1 катализиреут перенос двух углеродного фрагмента на дигидролипоил с образованием комплекса ацетил-липоил. 4 – Е2 катализирует перенос ацетила на HS-СоА с образованием ацетил-S- СоА. 5 – липоамид в сульфгидрильной форме перемещается в активный центр дигидролипоил-дегидрогеназы (Е3). Е3 катализирует восстановление (5) липоевой кислоты и переносит протоны и электроны (6) на NAD+ завершая реакционный цикл (Berg J.M.,
Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006).
−в активном центре пируват-дегидрогеназного компонента мультиферментного комплекса происходит декарбоксилирование пировиноградной кислоты с образованием замещенного интермедиата ТПФ (гидроксиэтил-ТПФ). Этот активный центр расположен в пределах
компонента Е1 и соединяется с поверхностью фермента гидрофобным каналом длиной 20Å;
−ответвление липоамидного домена Е2, представленное липоил-лизином располагается в гидрофобном канале Е1;
−Е1 катализирует перенос ацетильной группы на липоамид. Ацетилированное липоил-лизиновое ответвление покидает Е1 и входит в куб, состоящий из Е2 через особое отверстие на боковой стороне кора размером 30Å с тем, чтобы оказаться в активном центре Е2, расположенном глубоко в коре;
−после этого ацетильная группа переносится на HS-CoA с образованием конечного продукта – ацетил-S-CoA. Восстановленная липоил-лизиновая группировка затем поворачивается к активному центру флавопротеида Е3.
−в активном центре дигидролипоил-дегидрогеназы (Е3) липоамид окисляется с участием FAD в дисульфидную форму;
−в ходе последующего окисления FADH2 образуется еще один конечный продукт – NADH (Н+), а липоамид при этом в дисульфидной форме готов к следующему раунду катализа.
Взаключение следует отметить, что описанная выше структурная интеграция трех видов ферментов в составе одного комплекса делает возможным согласованное протекание отдельных стадий такой сложной реакции как пируват-дегидрогеназная реакция. Близкое расположение одного фермента от другого повышает суммарную скорость реакции и снижает возможность протекания побочных реакций. Все интермедиаты участвующие в окислительном декарбоксилировании пирувата тесно взаимодействуют в пределах комплекса и легко переносятся от одного фермента к другому благодаря способности липоил-лизиновой группировки дигидролипоил-трансацетилазы по очереди взаимодействовать со всеми активными центрами мультиферментного комплекса.
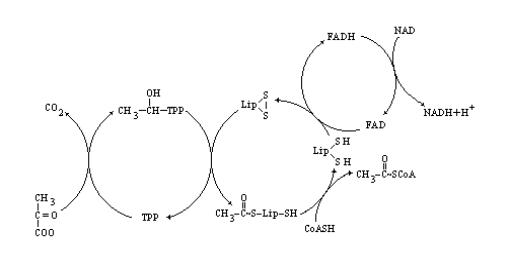
Ниже, на рис. 9.9 приведена общая схема механизма действия всего пируват-дегидрогеназного комплекса.
