
- •Автор:
- •ISBN 978-985-6823-61-2
- •Д. Мецлер
- •Введение
- •Пищеварительные ферменты секретируются в виде зимогенов
- •Апикальная сторона
- •Базальная сторона
- •Всасывание и секреция электролитов
- •Секреция соляной кислоты обкладочными клетками желудка
- •Баланс азота и азотистое равновесие
- •Нормы белка в питании
- •Биологическая ценность белков
- •Обмен простых белков
- •Переваривание белков в желудке
- •Действие пепсина
- •Таблица 3.1
- •Субстратная специфичность протеиназ желудочно-кишечного тракта
- •Активный фермент
- •Зимоген
- •Активатор
- •Пепсин А
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Трипсиноген
- •Химотрипсиноген
- •Проэластаза
- •Карбоксипептидаза А
- •Карбоксипептидаза В
- •Аминопептидаза
- •Трипсин
- •Трипсин
- •Трипсин
- •Механизм активации химотрипсиногена
- •Общие свойства семейства сериновых протеиназ
- •Нарушения процессов переваривания белков
- •Механизм действия карбоксипептидазы А
- •Всасывание свободных аминокислот
- •Всасывание интактных белков
- •Лекция № 4
- •Обмен аминокислот в норме и при патологии
- •Общие реакции аминокислот
- •Оксидазы аминокислот
- •Реакции аммиака
- •Цикл мочевины
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат синтетаза
- •Орнитин транскарбамоилаза
- •Аргининосукцинат синтетаза
- •Аргининосукцинат лиаза
- •Аргиназа
- •Обмен индивидуальных аминокислот в норме и при патологии
- •Таблица 5.1
- •Значение клетчатки в питании человека
- •Таблица 6.1
- •Целлюлоза
- •Гемицеллюлоза
- •Лигнин
- •Пектин
- •Фрукты
- •Камеди
- •Непрямые эффекты рафинированных углеводов
- •Переваривание и всасывание углеводов
- •Таблица 6.2
- •Название
- •углевода
- •Тип связи
- •Структура
- •Амилопектин
- •Амилоза
- •Сахароза
- •Трегалоза
- •Молодые грибы
- •Лактоза
- •Фруктоза
- •Фрукты, мед
- •Глюкоза
- •Раффиноза
- •Бобовые
- •Таблица 6.3
- •Продукт реакции
- •Амилоза
- •Глюкоза
- •Глюкоза
- •Глюкоза
- •Сахароза
- •Глюкоза, фруктоза
- •Трегалоза
- •Глюкоза
- •Глюкоза, церамид
- •Лактоза
- •Глюкоза, галактоза
- •Всасывание моносахаридов
- •Таблица 6.4
- •Базальная поверхность
- •Хорошие субстраты
- •Флоризин
- •Цитохалазин В
- •Гипоксические повреждения тканей
- •Субстратные циклы
- •Гипогликемия у недоношенных детей
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Таблица 9.1
- •Cостав пируват-дегидрогеназного комплекса млекопитающих
- •Таблица 9.3
- •Кофакторы и простетические группы пируват-дегидрогеназы
- •Локализация
- •Регуляция пируватдегидрогеназного комплекса
- •Глюконеогенез
- •Особенности синтеза гликогена: гликогенин в роли праймера
- •Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
- •Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
- •Генетические дефекты структуры коллагена
- •ПРИЛОЖЕНИЕ 6.1
- •Функция
- •ПРИЛОЖЕНИЕ 7.1
- •Обмен 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •ПРИЛОЖЕНИЕ 7.2
- •Гликолиз и рак
- •Таблица 7.2.1
- •Белок/фермент
- •Функция
- •Лизосомные болезни накопления
- •Дополнительная литература
- •Окислительное декарбоксилирование
- •Регуляция пируватдегидрогеназного комплекса
- •Нарушения метаболизма, связанные с дефектами
- •пируватдегидрогеназы
- •Глюконеогенез
- •Регуляция активности пируват-карбоксилазы
- •Глюконеогенез и гликолиз регулируются реципрокно
- •Гликогенолиз и гликогенез
- •Ферментативное обеспечение гликогенолиза
- •Болезни накопления гликогена I типа
- •Деградация молекул гликогена в местах ветвления
- •Болезни накопления гликогена II, III и V типов
- •Синтез гликогена
- •Особенности синтеза гликогена: гликогенин
- •в роли праймера
- •Цикл Кори
- •Гипогликемия и алкогольная интоксикация
- •Пентозофосфатный путь
- •Неокислительные реакции пентозофосфатного пути
- •Синдром Вернике-Корсакова
- •Генетические дефекты структуры коллагена
- •Биосинтез полиаминов
- •Катаболизм полиаминов
- •Клиническое значение 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •Рекомендуемая литература
- •Основная литература
- •Дополнительная литература
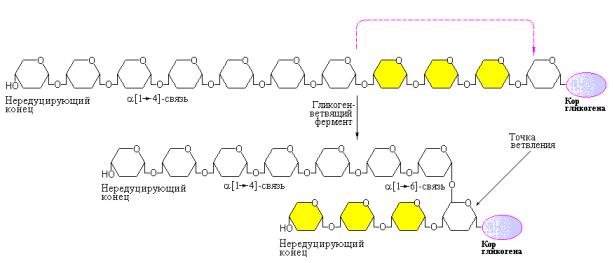
Рис. 10.13 Образование ветвей гликогена (ветвление гликогена). Гликогенветвящий фермент, называемый также амило-[1→4]→[1→6]- трансгликозилазой или глюкозил-[4→6]-трансферазой формирует новые точки ветвления в ходе синтеза гликогена (Nelson D.L., Cox. M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004).
Внимательный анализ механизма формирования молекулы гликогена с участием гликоген-синтазы и «ветвящего» фермента позволяет сделать однозначный вывод. Совместные действия двух указанных ферментов создают условия для последующего эффективного расщепления гликогена с учетом свойств гликоген-фосфорилазы и «дебранчинг»-фермента. Неудивительно, что дефекты «ветвящего» фермента могут приводить к развитию болезни накопления гликогена. Таким заболеванием, связанным с нарушением функции «ветвящего» фермента, является болезнь накопления гликогена IV типа, называемая также болезнью Андерсена (табл. 10.1). Заболевание затрагивает, в первую очередь, печень и селезенку. В клетках данных органов присутствует нормальное количество гликогена, структура которого, однако, отличается наличием очень длинных внешних ветвей. Клиническая картина протекания болезни характеризуется прогрессирующим циррозом печени. В свою очередь, недостаточная функциональная активность печени приводит к ранней смерти, обычно, в возрасте до двух лет.
Особенности синтеза гликогена: гликогенин в роли праймера
Гликоген-синтаза, главный фермент синтеза гликогена, не способен инициировать образование новых молекул данного полисахарида de novo. Для инициирования синтеза гликогена фермент нуждается в наличии предсуществущей затравки образованной либо линейной цепочкой остатков глюкозы, либо ответвлением, состоящим из, по меньшей мере, восьми глюкозильных остатков. В отличие от процесса синтеза ДНК, который
зависит от необходимости присутствия праймера, а также матрицы, образование гликогена требует участия только затравки. Следует иметь в виду, что молекулы гликогена сами по себе являются замечательными праймерами, поскольку в процессе синтеза гликоген-синтаза имеет возможность добавлять остатки глюкозы к молекулам гликогенового кора, которые всегда присутствуют в клетке. Внешние участки молекул гликогена распадаются и ресинтезируются намного более часто и эффективнее, чем внутренний кор. Более того, молекулы гликогена в крайне редких случаях распадаются полностью до того, как гликоген-синтаза и «ветвящий» фермент смогут их ресинтезировать. Изучение механизма действия гликоген-синтазы позволило показать, что сродство данного фермента к большим молекулам гликогена чрезвычайно велико. Обнаружено, что численное значение Кm становится больше и больше, по мере того, как размеры молекулы гликогена становятся все меньше. На основании полученных данных, и учитывая значение физиологической концентрации глюкозы в клетке, было сделано заключение, что глюкоза не может служить в качестве праймера для синтеза гликогена de novo. Приведенные рассуждения породили представление о том, что молекулы гликогена должны быть «бессмертными» и некоторое количество гликогена должно передаваться от одного поколения клеток к другому с целью последующего ресинтеза. Однако данное представление было отброшено, несмотря на привлекательность идеи возможного «бессмертия» гликогена, после обнаружения в клетках специфического белка, названного гликогенином (рис. 10.14), который, как было доказано, выступает в роли праймера при синтезе гликогена de novo (Lomako J., Lomako W.M., Whelan W.J., A self-glucosylating protein is the primer for rabbit muscle glycogen biosynthesis, FASEB J., 1988, 2, 3097-3105).
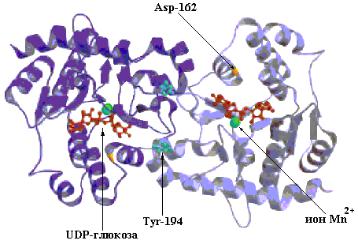
Рис. 10.14 Структура молекулы гликогенина (PDB 1D 1772). Мышечный гликогенин (мол. масса 37.000 дальтон) образует в растворе димеры. У человека в печени присутствует вторая изоформа белка – гликогенин-2. Субстрат – UDP-глюкоза связан (показан красным ball-and-stick) с
Rossman fold вблизи N-конца и расположен на некотором расстоянии от остатка Tyr-194 (бирюзовым цветом). Это расстояние составляет 15Å в мономере и 12Å в димере. Каждая молекула UDP-глюкозы взаимодействует своими фосфатными группами с ионом Mn+2 (показан зеленым), который необходим для катализа. Полагают, что Mn+2 действует как акцептор электронной пары (кислота Льюиса) стабилизируя уходящую группу – UDP. Гликозидная связь в продукте имеет такую же конфигурацию относительно атома С-1 глюкозы, как и в субстрате – UDP-глюкозе, предполагая, что перенос глюкозы от UDP на Tyr-194 происходит в две стадии. Первая стадия заключается в нуклеофильной атаке остатком Asp-162 (показано оранжевым), что приводит к образованию интермедиата с инвертированной конфигурацией, а вторичная нуклеофильная атака остатком Tyr-194 восстанавливает исходную конфигурацию.
Гликогенин представляет собой самоглюкозилирующийся фермент, который использует в качестве субстрата UDP-глюкозу, при этом он присоединяет остаток глюкозы редуцирующим концом к одному из своих остатков тирозина. Глюкозилированный гликогенин после присоединения глюкозы становится «ядром» синтеза гликогена. Так что, увы, гликоген не бессмертен.
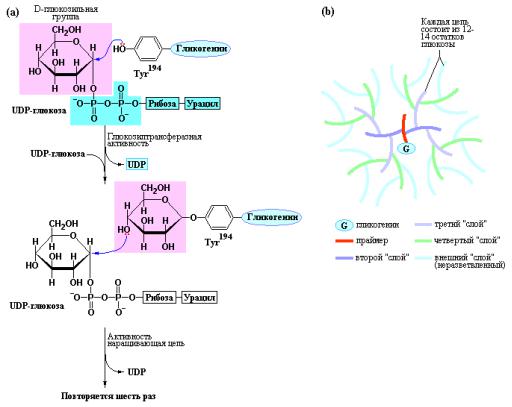
Рис. 10.15 Механизм действия гликогенина и структура гликогеновой частицы. (а) Гликогенин катализирует две различные реакции. Первоначально атака гидроксильной группой Tyr-194 атома углерода в положении С-1 глюкозильной части молекулы UDP-глюкозы приводит к глюкозилированию остатка Tyr. Затем атом углерода С-1 второй
молекулы UDP-глюкозы атакуется С-4 гидроксильной группой терминального остатка глюкозы соединенного с молекулой гликогенина. Эта последовательность повторяется до тех пор, пока не сформируется цепочка из восьми остатков глюкозы соединенных α[1→4]-связями. (b) Начиная от молекулы гликогенина, расположенного в центре, цепи гликогена формируют слои. Внутренние цепи имеют по две точки ветвления с α[1→6]-связями, каждая. Цепи во внешнем слое гликогена не разветвлены. Всего в зрелой молекуле гликогена имеется до 12 слоев (на рисунке показаны только четыре слоя) включающих 55.000 остатков глюкозы. Такая молекула имеет размеры 21 нм в диаметре с молекулярной массой до
107 дальтон (Nelson D.L., Cox. M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004).
Таким образом, для инициирования синтеза гликогена de novo используется уникальный фермент – гликогенин, который одновременно является и праймером, на котором собирается новая цепочка из остатков глюкозы и сам катализирует процесс сборки новой цепочки глюкозильных остатков.
Первый этап синтеза новой молекулы гликогена заключается в переносе остатка глюкозы от UDP-глюкозы на гидроксильную группу Tyr194 молекулы гликогенина в реакции катализируемой собственной глюкозилтрансферазной активностью белка. Новая цепь растет путем последовательного добавления более семи остатков глюкозы, донором которых является UDP-глюкоза. Реакция протекает благодаря каталитической активности гликогенина. На этой стадии к процессу синтеза гликогена подключается гликоген-синтаза. Гликогенин остается погруженным в гликогеновую частицу оставаясь ковалентно связанным с единственным восстанавливающим концом молекулы гликогена.
Лекция 11
Цикл Кори
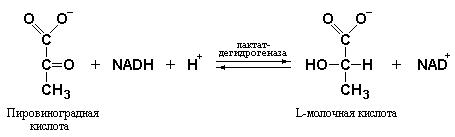
Основным исходным соединением, которое используется в процессе глюконеогенеза является молочная кислота, образующаяся при активной работе скелетных мышц. В сокращающейся мышце при анаэробных условиях скорость образования пирувата в ходе гликолитического расщепления глюкозы превышает скорость его поступления в митохондрии и последующего окисления в цикле трикарбоновых кислот. Кроме того, при интенсивно протекающем гликолизе скорость образования NADH под действием глицеральдегид-3-фосфат-дегидрогеназы выше, чем скорость его окисления в дыхательной цепи. Отсюда следует, что интенсивно протекающий гликолиз требует постоянного окисления NADH в NAD+. Генерирование NAD+ осуществляется лактат-дегидрогеназой, которая,
восстанавливая пировиноградную кислоту в молочную, окисляет NADH в NAD+.
Образование молочной кислоты – это тупик в метаболизме. Дальнейшие метаболические превращения молочной кислоты возможны только в случае повторного образования пирувата из лактата:
Исходя из сказанного выше, очевидно, что единственной целью восстановления пирувата в молочную кислоту является регенерация окисленного никотинамид-аденинидинуклеотида – NAD+, необходимого для непрерывного протекания гликолитического пути расщепления глюкозы в активной скелетной мышце. В свою очередь, процесс образования молочной кислоты в мышцах перекладывает часть метаболической нагрузки на печень.
Ранее обсуждалось, что плазматические мембраны большинства клеток обладают высокой проницаемостью для молочной и пировиноградной кислот. Оба соединения диффундируют из активной скелетной мышцы в кровь и переносятся в печень. При этом количество переносимого лактата существенно превышает количество пировиноградной кислоты из-за высокого значения отношения концентраций [NADH]/[NAD+] в сокращающихся мышцах. Молочная кислота, поступившая в печень, снова окисляется в гепатоцитах до пирувата вследствие низкого отношения
концентраций [NADH]/[NAD+] в цитозоле этих клеток. Образовавшийся пируват затем превращается в печени в глюкозу по пути глюконеогенеза.
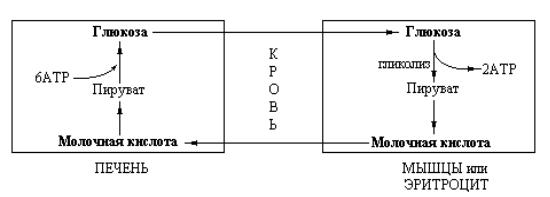
Таким образом, печень снабжает глюкозой сокращающиеся мышцы, которые, в свою очередь, генерируют АТР в результате гликолитического превращения глюкозы в молочную кислоту. Молочная кислота снова превращается в печени в глюкозу. Указанные взаимопревращения глюкозы и молочной кислоты составляют цикл Кори (рис. 11.1).
Рис. 11.1 Схема функционирования цикла Кори. Молочная кислота, образующаяся в активной скелетной мышце, превращается в печени в глюкозу. Этот цикл передает часть метаболического «груза» активной мышцы гепатоцитам.
Координированное функционирование описанных процессов облегчается различиями в каталитических свойствах лактат-дегидрогеназ, локализованных в мышечной и печеночной тканях. Лактат-дегидрогеназа представляет собой тетрамер, состоящий из субъединиц с молекулярной массой 35.000 дальтон, каждая. Однако субъединицы лактат-дегидрогеназы не идентичны: существует два вида полипептидных цепей, обозначаемых буквами М (muscle) и Н (hepatic), которые могут образовывать, что очевидно, пять форм фермента, называемых изоферментами. Наибольшим сродством к пирувату обладает изофермент М4, изоформа Н4 характеризуется существенно более низким сродством к пировиноградной кислоте, остальные изоферменты обладают промежуточной активностью.
Кроме цикла Кори, принимающего участие в глюконеогенном пути образования глюкозы в печени, этот орган обеспечивает также синтез глюкозы из аланина в ходе так называемого аланинового цикла. Функционирование этих двух циклов, обеспечивающих обмен глюкозой и молочной кислотой или аланином между печенью и периферическими тканями, возможно при условии, что ткани не полностью окисляют глюкозу
до СО2 и Н2О.
Аланиновый цикл предусматривает образование в мышечной ткани аланина при переаминировании пировиноградной кислоты с аминокислотами белков пищи или тканевых белков. Источником пирувата в таких тканях
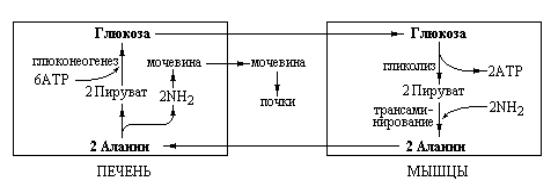
является гликолитическое расщепление глюкозы. Образовавшийся аланин диффундирует в кровяное русло и переносится в печень. В гепатоцитах снова происходит переаминирование аланина под действием аланин-трансаминазы с образованием пировиноградной кислоты, которая используется в глюконеогенном пути синтеза глюкозы. Аминогруппы аланина используются ферментами орнитинового цикла для синтеза мочевины, которая выводится из организма почками. Схема действия аланинового цикла приведена на рис. 11. 2.
Рис. 11. 2 Взаимоотношения между глюконеогенезом в печени и гликолизом в мышцах при функционировании аланинового цикла.
Еще одним неуглеводным предшественником глюкозы, который упоминался ранее, является также трехатомный спирт глицерин, образующийся в результате гидролиза триацилглицеролов. Кроме того, источником глицерина может служить фруктоза. Данный моносахарид под действием фруктокиназы превращается во фруктозо-1-фосфат, расщепляющийся с участием специфической альдолазы до дигидроксиацетонфосфата и глицеральдегида (см. лекцию 7 раздел «Токсические эффекты α-D-2-дезоксиглюкозы, сульфгидрильных реагентов и фтора» и лекцию 8 раздел «Синтез глюкозы из других сахаров»). Глицеральдегид далее восстанавливается до глицерина, способного окисляться до дигидроксиацетонфосфата. Схема путей образования глицерина и его последующего окисления до дигидроксиацетонфосфата приведена на рис. 11. 3.
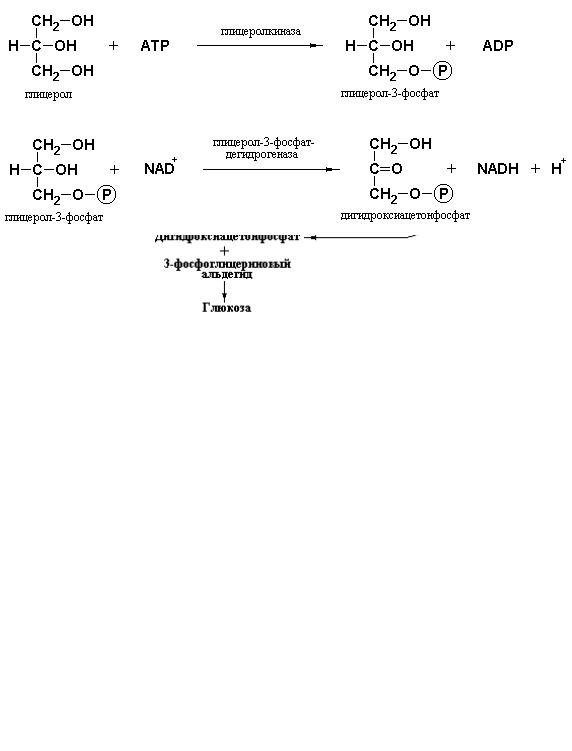
Рис. 11. 3 Схема, иллюстрирующая процесс образования глюкозы из глицерина.
Как следует из рис. 11. 3, глицерин фосфорилируется с участием фермента глицеролкиназы. Фосфорилированный по третьему положению трехатомный спирт окисляется под действием глицерол-3-фосфат- дегидрогеназы с образованием дигидроксиацетонфосфата:
Дигидроксиацетонфосфат используется в качестве одного из субстратов обратимой реакции, катализируемой альдолазой гликолиза. В результате реакции конденсации дигидроксиацетонфосфата с 3- фосфоглицериновым альдегидом образуется фруктозо-1,6-дифосфат, последующие превращения которого дают, в конечном счете, свободную глюкозу.
Гипогликемия и алкогольная интоксикация
Употребление алкоголя, особенно лицами, страдающими недоеданием провоцирует состояние гипогликемии различной степени тяжести. Подобное состояние может быть также результатом потребления алкоголя после тяжелой физической работы. В обоих случаях гипогликемическое состояние вызвано ингибирующим действием алкоголя на глюконеогенез, что, в свою очередь, приводит к истощению запасов гликогена в печени.
Состояние гипогликемии возникает вследствие накоплениния NADH в результате действия алкоголь-дегидрогеназы. Печень оказывается не в состоянии регулировать уровень восстанавливающих эквивалентов настолько эффективно, чтобы противостоять метаболическим сдвигам, вызванным окислением этанола. Избыток NADH блокирует превращение молочной кислоты в глюкозу, а также способствует превращению аланина в молочную кислоту, что приводит к значительному накоплению лактата в крови. В свою очередь, поскольку лактат представляет собой «метаболический тупик», возникает состояние молочнокислого ацидоза.
Известно, что низкие дозы алкоголя вызывают ослабление двигательной активности и интеллектуальной деятельности; высокие дозы приводят к помрачению сознания и наркотическому эффекту. Снижение содержания глюкозы в крови еще больше обостряет негативные эффекты алкоголя. В конечном счете, вследствие хронического употребления алкоголя у пацитента происходит необратимое повреждение центральной нервной системы. Поэтому необходимо помнить, что дети особенно чувствительны к действию этанола, так как они в большей степени зависят от того, насколько эффективно в детском организме протекают реакции глюконеогенеза, а состояние гипогликемии оказывает гораздо более пагубные последствия на деятельность детского мозга, чем у взрослых людей (Krebs H.A., Freedland R.A., Hems R., Stubbs M., Inhibition of hepatic gluconeogenesis by ethanol, Biochem. J., 1969, 112, 117-129).
Итак, этанол оказывает ингибирующее действие на глюконеогенное образование глюкозы в гепатоцитах. Ситуация осложняется еще и тем обстоятельством, что окисление этилового спирта, происходящее преимущественно в печени, сопровождается образованием большого избытка NADH, который должен быть перенесен в митохондрии при участии малатаспартатного шунта. Накапливающийся при окислении спирта NADH сильно сдвигает равновесие реакций, катализируемых лактат- и малатдегидрогеназами, в сторону образования молочной и яблочной кислот, соответственно:
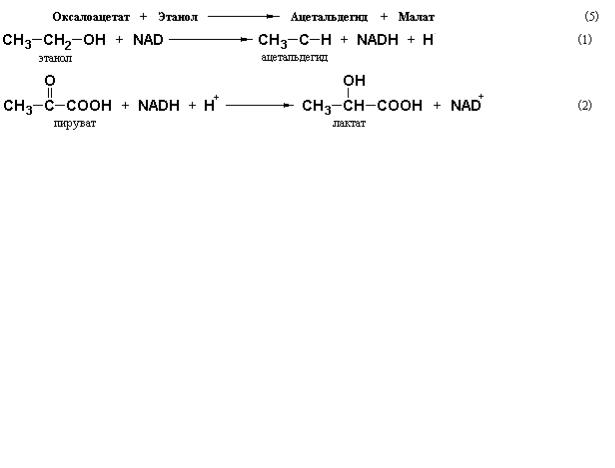
Суммарная реакция может быть записана следующим образом:
Подобно реакции (2), записывается реакция образования яблочной кислоты:
Суммируя реакции (1) и (4) получаем следующее выражение:
Анализ приведенных выше реакций показывает, что в присутствии этилового спирта в гепатоцитах нет недостатка в NADH, который необходим для функционирования глюконеогенного пути на стадии образования глицеральдегид-3-фосфата. Однако, смещение равновесия лактатдегидрогеназной и малат-дегидрогеназной реакций ингибирует образование глюкозы в целом из-за снижения концентраций пирувата и оксалоацетата, являющихся принципиальными субстратами начальных реакций глюконеогенеза, которые катализируются пируват-карбоксилазой и фосфоенолпируват-карбоксикиназой, соответственно.
Пентозофосфатный путь
Легкодоступным источником восстановительных эквивалентов в клетках является NADPH, который служит донором водорода и электронов в
реакциях восстановительного биосинтеза.
Генерирование NADPH происходит в пентозофосфатном пути при окислении глюкозо-6-фосфата в рибозо-5-фосфат. Этот пятиуглеродный сахар и его производные используются в клетках для синтеза таких важнейших биомолекул, как АТР, СоА, NAD+, NADP+, FAD, а также РНК и ДНК.
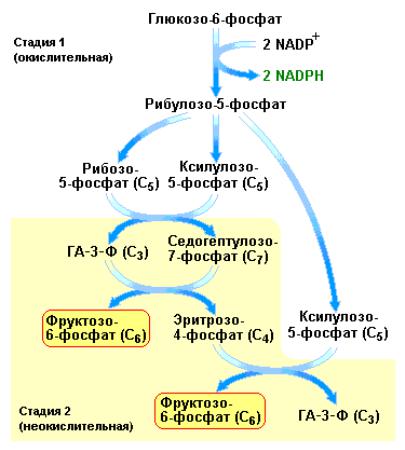
Ферменты пентозофосфатного пути катализируют также ряд неокислительных реакций, протекающих в цитозоле, которые обеспечивают взаимопревращения трех-, четырех-, пяти-, шести- и семиуглеродных сахаров. На рис. 11. 4 приведена общая схема пентозофосфатного пути.
Рис. 11. 4 Пентозофосфатный путь состоит из окислительной стадии, в которой происходит генерирование NADPH (1) и неокислительной стадии (2) ответственной за взаимопревращения фосфорилированных моносахаридов (Berg J.M., Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006).
Пентозофосфатный путь начинается с дегидрирования глюкозо-6- фосфата по атому углерода в первом положении. Данная реакция катализируется глюкозо-6-фосфат-дегидрогеназой. Продуктом реакции является 6-фосфоглюконолактон – внутримолекулярный эфир, с эфирной связью между С1-карбоксильной группой и гидроксильной группой по С5:
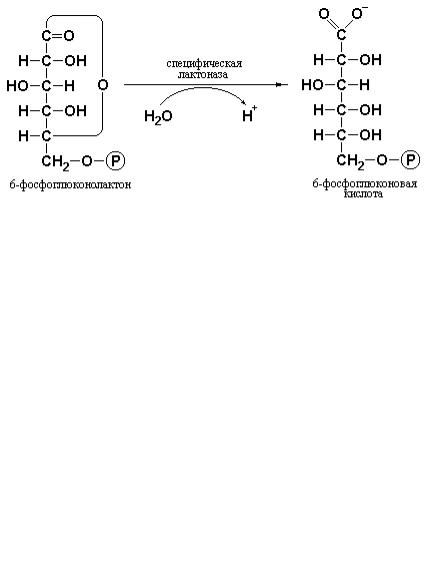
На следующей стадии под действием специфической лактоназы происходит гидролиз внутримолекулярного эфира – 6-фосфоглюконо-лактона с образованием 6-фосфоглюконата – фосфопроизводного оновой кислоты, называемого также 6-фосфоглюконовой кислотой:
Далее этот фосфорилированный шестиуглеродный сахар подвергается окислительному декарбоксилированию под действием 6-фосфоглюконат- дегидрогеназы с образованием пятиуглеродной кетозы – рибулозо-5-фосфата. На этой стадии пентозофосфатного пути акцептором электронов является также NADP+:
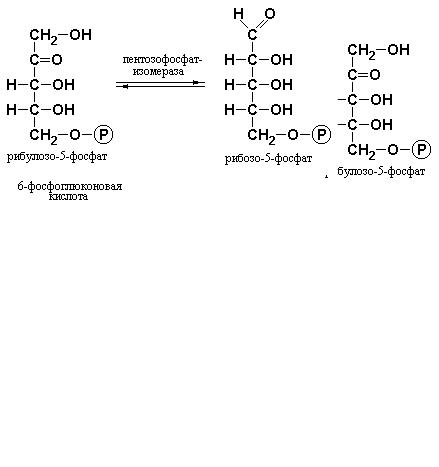
Наконец, рибулозо-5-фосфат изомеризуется с участием пентозофосфатизомеразы в рибозо-5-фосфат:
Одним из важнейших ферментов пентозофосфатного пути в красных кровяных клетках является глюкозо-6-фосфат-дегидрогеназа, которая играет важную роль в поддержании целостности плазматических мембран эритроцитов. Поэтому неудивительно, что отсутствие или дефект глюкозо-6- фосфат-дегидрогеназы может служить причиной лизиса эритроцитов. В некоторых случаях в эритроцитах человека может присутствовать одна из генетически детерминированных форм фермента, которая в обычных условиях характеризуется активностью, достаточной для поддержания целостности красных кровяных клеток. Однако, в состоянии, например, окислительного стресса активность измененного фермента оказывается недостаточной.
Известны мутации, которые не изменяют значения Km глюкозо-6- фосфат-дегидрогеназы для субстрата, но служат причиной снижения термостабильности фермента. Данное обстоятельство оказывается особенно губительным для эритроцитов, которые, как известно, лишены способности синтезировать белки и, следовательно, осуществлять ресинтез денатурированной глюкозо-6-фосфат-дегидрогеназы. Отсюда следует, что присутствие в эритроцитах термолабильного фермента в значительной степени влияет на время жизни красных кровяных клеток. (Beutler E.,
Glucose-6-phosphate dehydrogenase deficiency. Stanbury J.B., Wynaarden J.B.,
