
- •Автор:
- •ISBN 978-985-6823-61-2
- •Д. Мецлер
- •Введение
- •Пищеварительные ферменты секретируются в виде зимогенов
- •Апикальная сторона
- •Базальная сторона
- •Всасывание и секреция электролитов
- •Секреция соляной кислоты обкладочными клетками желудка
- •Баланс азота и азотистое равновесие
- •Нормы белка в питании
- •Биологическая ценность белков
- •Обмен простых белков
- •Переваривание белков в желудке
- •Действие пепсина
- •Таблица 3.1
- •Субстратная специфичность протеиназ желудочно-кишечного тракта
- •Активный фермент
- •Зимоген
- •Активатор
- •Пепсин А
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Трипсиноген
- •Химотрипсиноген
- •Проэластаза
- •Карбоксипептидаза А
- •Карбоксипептидаза В
- •Аминопептидаза
- •Трипсин
- •Трипсин
- •Трипсин
- •Механизм активации химотрипсиногена
- •Общие свойства семейства сериновых протеиназ
- •Нарушения процессов переваривания белков
- •Механизм действия карбоксипептидазы А
- •Всасывание свободных аминокислот
- •Всасывание интактных белков
- •Лекция № 4
- •Обмен аминокислот в норме и при патологии
- •Общие реакции аминокислот
- •Оксидазы аминокислот
- •Реакции аммиака
- •Цикл мочевины
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат синтетаза
- •Орнитин транскарбамоилаза
- •Аргининосукцинат синтетаза
- •Аргининосукцинат лиаза
- •Аргиназа
- •Обмен индивидуальных аминокислот в норме и при патологии
- •Таблица 5.1
- •Значение клетчатки в питании человека
- •Таблица 6.1
- •Целлюлоза
- •Гемицеллюлоза
- •Лигнин
- •Пектин
- •Фрукты
- •Камеди
- •Непрямые эффекты рафинированных углеводов
- •Переваривание и всасывание углеводов
- •Таблица 6.2
- •Название
- •углевода
- •Тип связи
- •Структура
- •Амилопектин
- •Амилоза
- •Сахароза
- •Трегалоза
- •Молодые грибы
- •Лактоза
- •Фруктоза
- •Фрукты, мед
- •Глюкоза
- •Раффиноза
- •Бобовые
- •Таблица 6.3
- •Продукт реакции
- •Амилоза
- •Глюкоза
- •Глюкоза
- •Глюкоза
- •Сахароза
- •Глюкоза, фруктоза
- •Трегалоза
- •Глюкоза
- •Глюкоза, церамид
- •Лактоза
- •Глюкоза, галактоза
- •Всасывание моносахаридов
- •Таблица 6.4
- •Базальная поверхность
- •Хорошие субстраты
- •Флоризин
- •Цитохалазин В
- •Гипоксические повреждения тканей
- •Субстратные циклы
- •Гипогликемия у недоношенных детей
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Таблица 9.1
- •Cостав пируват-дегидрогеназного комплекса млекопитающих
- •Таблица 9.3
- •Кофакторы и простетические группы пируват-дегидрогеназы
- •Локализация
- •Регуляция пируватдегидрогеназного комплекса
- •Глюконеогенез
- •Особенности синтеза гликогена: гликогенин в роли праймера
- •Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
- •Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
- •Генетические дефекты структуры коллагена
- •ПРИЛОЖЕНИЕ 6.1
- •Функция
- •ПРИЛОЖЕНИЕ 7.1
- •Обмен 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •ПРИЛОЖЕНИЕ 7.2
- •Гликолиз и рак
- •Таблица 7.2.1
- •Белок/фермент
- •Функция
- •Лизосомные болезни накопления
- •Дополнительная литература
- •Окислительное декарбоксилирование
- •Регуляция пируватдегидрогеназного комплекса
- •Нарушения метаболизма, связанные с дефектами
- •пируватдегидрогеназы
- •Глюконеогенез
- •Регуляция активности пируват-карбоксилазы
- •Глюконеогенез и гликолиз регулируются реципрокно
- •Гликогенолиз и гликогенез
- •Ферментативное обеспечение гликогенолиза
- •Болезни накопления гликогена I типа
- •Деградация молекул гликогена в местах ветвления
- •Болезни накопления гликогена II, III и V типов
- •Синтез гликогена
- •Особенности синтеза гликогена: гликогенин
- •в роли праймера
- •Цикл Кори
- •Гипогликемия и алкогольная интоксикация
- •Пентозофосфатный путь
- •Неокислительные реакции пентозофосфатного пути
- •Синдром Вернике-Корсакова
- •Генетические дефекты структуры коллагена
- •Биосинтез полиаминов
- •Катаболизм полиаминов
- •Клиническое значение 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •Рекомендуемая литература
- •Основная литература
- •Дополнительная литература
Frederickson D.S., (eds). The metabolic basis of inherited disease, McGraw Hill, New York, 1978, p 1430-1449).
Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
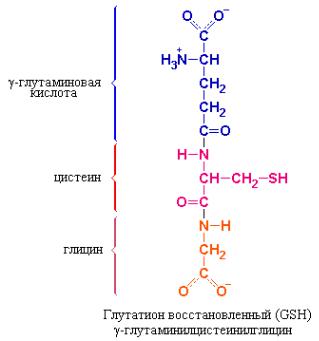
Активные формы кислорода (АФК) генерируемые в ходе различного рода окислительно-восстановительных реакций относящихся к процессам окислительного метаболизма оказывают повреждающее действие на клеточные макромолекулы всех классов и, в конечном счете, могут приводить к гибели клетки. Более того, АФК могут вовлекаться в процессы, лежащие в основе возникновения и развития различных заболеваний человека. Важную роль в антиоксидантной защите клетки играет восстановленная форма особого трипептида – глутатиона (γ- глутаминилцистеинилглицина) (GSH), который благодаря наличию активной свободной сульфгидрильной группы способен «справляться» с окислительным стрессом и поддерживать «нормальное восстановленное состояние клетки».
Окисленная дисульфидная форма глутатиона (GSSG) образующаяся в процессе детоксикации, например, пероксида водорода снова восстанавливается до активного сульфгидрильного состояния с участием NADPH, генерируемого глюкозо-6-фосфат дегидрогеназой в ходе пентозофосфатного пути обмена углеводов. Не удивительно, что клетки со сниженным уровнем глюкозо-6-фосфат дегидрогеназы отличаются повышенной чувствительностью к окислительному стрессу. Это состояние окислительного стресса, как указывалось выше, особенно заметно
проявляется в красных кровяных клетках, при созревании которых утрачиваются органеллы и, в первую очередь, митохондрии, что отличает эти клетки отсутствием иных способов генерирования восстанавливающих эквивалентов.
Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
В 1926 году с начала применения нового для того времени противомалярийного препарата – памахина – было описано тяжелое и загадочное заболевание. Бóльшая часть заболевших малярией хорошо переносили данное лекарственное средство, однако у некоторых пациентов уже в течение нескольких дней после применения препарата появлялись симптомы тяжелой болезни. Моча больных становилась черной, развивалась желтуха, и концентрация гемоглобина резко снижалась. В некоторых случаях из-за массовой гибели эритроцитов наступала смерть пациента. Заболевание получило название лекарственной гемолитической анемии. Лишь 30 лет спустя, в 1956 году, было установлено, что причиной возникновения лекарственной гемолитической анемии является недостаточность или определенные генетические дефекты глюкозо-6-фосфат дегидрогеназы – фермента, катализирующего первую реакцию окислительного этапа пентозофосфатного пути обмена углеводов.
Индукторами развития заболевания у людей с недостаточностью глюкозо-6-фосфат дегидрогеназы служат кроме памахина многие другие лекарственные средства и токсины, обладающие окислительными свойствами. Подобные симптомы могут наблюдаться при приеме
сульфаниламидных препаратов, нитрофурантоина или в случае попадания в организм некоторых гербицидов. Тяжелый гемолиз может быть вызван случайным попаданием в организм токсичных веществ, например нафталина, который содержится во многих средствах от моли. Как причина гемолиза часто упоминается аспирин, но на больных с вариантом A данного заболевания он действия не оказывает. В большинстве случаев болезнь протекает бессимптомно и только комбинация генетического дефекта глюкозо-6-фосфат дегидрогеназы и воздействия химических факторов окружающей среды способствует клиническому проявлению заболевания.
Недостаточность глюкозо-6-фосфат-дегидрогеназы является довольно распространенным заболеванием. Оно наследуется как признак, связанный с полом. У гетерозиготных носителей-женщин имеются две популяции эритроцитов: одна характеризуется нормальной ферментативной активностью, а другая – недостаточной. В большинстве остальных клеток, отличных от эритроцитов, этот фермент детерминируется другим геном. Наиболее обычной формой недостаточности глюкозо-6-фосфат- дегидрогеназы является нарушение А-типа, описанное выше. В целом дефекты гена глюкозо-6-фосфат дегидрогеназы, локализованного в Х-
хромосоме, представляют собой одну из наиболее распространенных энзимопатий, поражающих сотни миллионов людей (по эпидемиологическим данным около 400 миллионов человек). Оказалось, что генетические дефекты глюкозо-6-фосфат-дегидрогеназы чрезвычайно разнородны. К настоящему времени описано, по меньшей мере, 22 типа генетических нарушений структуры данного фермента. Многообразие мутаций лежит в основе либо отсутствия каких-либо клинических проявлений, либо клинического полиморфизма болезни: тяжесть заболевания колеблется от
несфероцитарной гемолитической анемии, проявляющейся спонтанно вскоре после рождения, до гемолитических кризов, провоцируемых различной силы окислителями.
Следует, однако, отметить, что история данного вопроса имеет гораздо более глубокие корни. В древности, в античные времена зерна бобов обыкновенных или овощных (Vicia faba) являлись важным источником питания жителей Средиземноморья и Ближнего Востока. Тем не менее, имеются сведения, что древнегреческий философ и математик Пифагор предостерегал своих учеников и последователей от употребления в пищу бобов Vicia faba, возможно по той причине, что уже в те времена он знал о неблагоприятном воздействии этих бобов на состояние здоровья у некоторых людей, которое нередко имело летальный исход. Недомогание, вызываемое употреблением блюд содержащих бобы Vicia faba, получило впоследствии название фавизма. В состоянии фавизма уже через 24-48 час после приема в пищу бобов начинается лизис эритроцитов с выбросом свободного гемоглобина в кровяное русло. При этом, как и в случае лекарственной гемолитической анемии, развивается желтуха, которая иногда может сопровождаться почечной недостаточностью.
Выше указывалось, что глюкозо-6-фосфат дегидрогеназа ответственна за генерирование NADPH в реакции превращения глюкозо-6-фосфата в 6- фосфоглюконолактон. При этом основная функция NADPH в красных кровяных клетках, состоит в восстановлении дисульфидной формы глутатиона в его сульфгидрильную форму. Непосредственное восстановление глутатиона происходит с участием флавопротеида – глутатионредуктазы – олигомерного белка, состоящего из двух субъединиц с молекулярной массой 50.000 дальтон, каждая. Этот фермент гомологичен ферредоксин-NADP+-редуктазе, которая обеспечивает генерирование NADPH в процессе фотосинтеза. Восстановленная форма глутатиона служит сульфгидрильным буфером, который позволяет поддерживать SH-группы гемоглобина и других белков эритроцитов в восстановленном состоянии. В норме отношение концентрации восстановленного глутатиона к концентрации окисленного составляет величину, равную 500.
Каким же образом происходит генерирование GSH из GSSG и NADPH под действием глутатионредуктазы. В процессе катализа электроны от NADPH не переносятся непосредственно на дисульфидную связь GSSG. Вместо
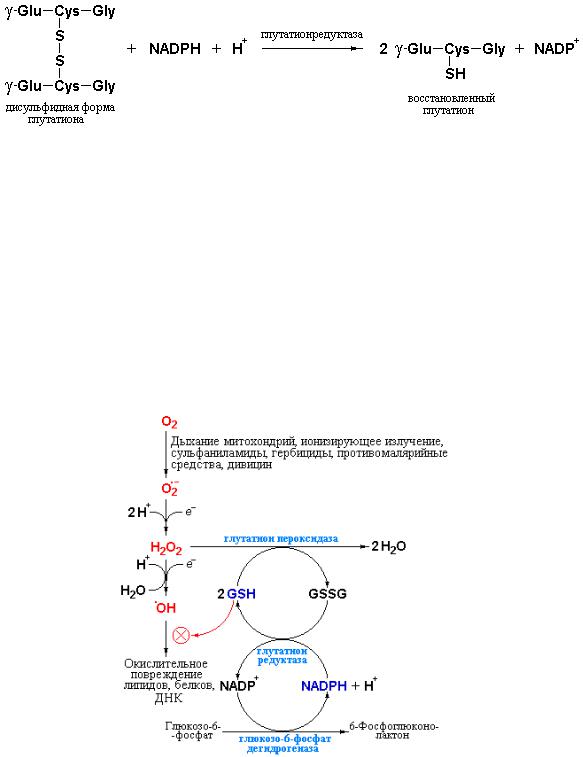
этого, сначала электроны переносятся от NADPH на прочно связанный с ферментом флавин-аденин динуклеотид (FAD) с образованием FADH2. Затем FADH2 восстанавливает специфический дисульфидный мостик между двумя остатками цистеина в одной из субъединиц фермента и, только после этого, электроны переносятся на GSSG, что обеспечивает генерирование двух молекул GSH.
Восстановленный глутатион необходим эритроцитам не только в качестве сульфгидрильного буфера. Это соединение обеспечивает защиту клеток от повреждающего воздействия пероксида водорода (Н2О2) и свободных супероксидных анионов (О2·¯) – высокореакционноспособных форм кислорода генерируемых в качестве побочных продуктов обмена, а также при действии лекарственных средств, например, примахина или природных соединений, таких как дивицин. Общая схема образования АФК в эритроцитах и участие глутатиона, глюкозо-6-фосфат-дегидрогеназы, глутатионредуктазы и глутатионпероксидазы в процессе их детоксикации приведена на рис. 11.4.
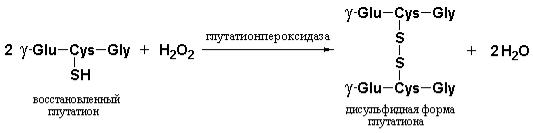
Рис. 11.5 Роль NADPH и глутатиона в защите клеток от действия активных форм кислорода. Восстановленный глутатион (GSH) защищает клетку путем «разрушения» пероксида водорода и свободных НО•-радикалов. Регенерация GSH из его окисленной формы (GSSG) требует участия NADPH образующегося в реакции катализируемой глюкозо-6-фосфат дегидрогеназой (Nelson D.L., Cox. M.M., Lehninger Principles of Biochemistry, W.H. Freeman (ed.), 2004).
В ходе естественной детоксикации пероксида водорода данное соединение превращается в воду с участием глутатионпероксидазы, использующей восстановленную форму глутатиона (GSH). Образующийся в этой реакции окисленный глутатион (GSSG) снова превращается в восстановленную форму под действием глутатионредуктазы в присутствии NADPH. Эффективное разрушение Н2О2 до Н2О и О2 происходит и под действием каталазы, которая также использует NADPH.
Красные кровяные клетки с низким уровнем восстановленного глутатиона отличаются повышенной склонностью к гемолизу. Каковы же биохимические основы многообразных физиологических эффектов GSH. В присутствии памахина, пуринового гликозида Vicia faba – дивицина или многих других оксидантов увеличивается скорость образования активных форм кислорода, главными из которых являются пероксиды. В норме пероксиды эффективно разрушаются глутатионпероксидазой, использующей GSH в качестве восстанавливающего агента. Однако при снижении концентрации GSH накапливающиеся пероксиды начинают повреждать как мембраны эритроцитов, так и множество биомолекул присутствующих в этих клетках.
Избыток Н2О2 повреждает эритроциты различными путями. Вопервых, в присутствии пероксида водорода происходит энергичное окисление атомов железа гемоглобина с образованием его ферри-(Fe3+)- формы – метгемоглобина не способного связывать кислород. В норме образующийся метгемоглобин может снова восстанавливаться до ферро- (Fe2+)-формы под действием NADH-метгемоглобин-редуктазы. Некоторая часть метгемоглобина восстанавливается также под действием сходного, но NADPH-зависимого фермента. Таким образом, восстановленный глутатион крайне важен для поддержания гемоглобина в ферро-(Fe+2)-cостоянии.
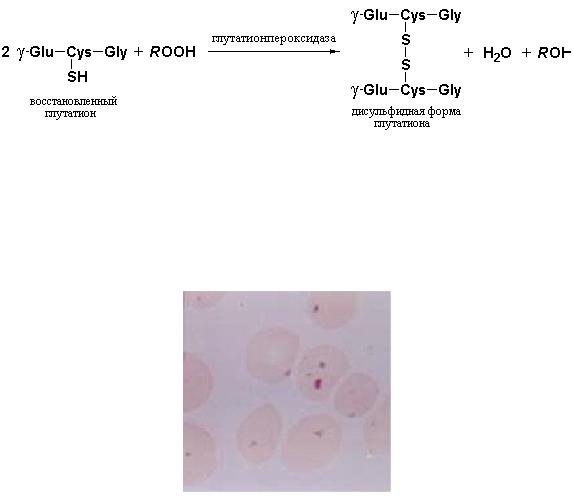
Вторым повреждающим эффектом Н2О2 является атака двойных связей остатков ненасыщенных жирных кислот в составе фосфолипидов эритроцитарных мембран. Образующиеся гидроперексиды жирных кислот инициируют дальнейшие реакции, приводящие к разрыву С-С-связей и, как следствие, к разрушению мембраны эритроцита. Именно этот эффект считают главной причиной индуцированной лекарствами гемолитической анемии. Разрушение перекисей жирных кислот, по-видимому, также катализируется глутатионпероксидазой:
В-третьих, при низкой концентрации восстановленного глутатиона в эритроцитах нарушается процесс восстановления SH-групп гемоглобина, что приводит к образованию ковалентных S-S-сшивок между молекулами гемопротеида и формированию на клеточных мембранах агрегатов этого белка, называемых тельцами Хайнца (рис. 11.6).
Рис. 11.6 Красные кровяные клетки с тельцами Хайнца. На световой микрофотографии показаны эритроциты, выделенные из крови пациента с дефектом глюкозо-6-фосфат дегидрогеназы. Темно окрашиваемые основными красителями частицы внутри клеток, называемые тельцами Хайнца, представляют собой агрегаты денатурированного гемоглобина, которые прикрепляются к плазматической мембране. Эритроциты таких больных чрезвычайно чувствительны к окислительному стрессу. ((Berg J.M., Tymoczko J.L.,
Lubert Stryer, Biochemistry, W.H. Freeman (ed.), 2006))
Мембраны красных кровяных клеток, поврежденные тельцами Хайнца и активными частицами кислорода, подвергаются сильной деформации и, как следствие, клетки лизируются.
Следует, однако, иметь в виду, что в отсутствие окислительного стресса заболевание, связанное с дефектом глюкозо-6-фосфат дегидрогеназы протекает в достаточно легкой форме. Следовательно, описанные выше дефекты глюкозо-6-фосфат дегидрогеназы и их последствия являются ярким примером того, что атипичная реакция человека на лекарственные препараты может иметь генетическую основу.
В некоторых случаях дефекты глюкозо-6-фосфат дегидрогеназы могут иметь эволюционные преимущества
Хорошо известно, что у 11% американцев африканского происхождения встречается одна из форм дефектов глюкозо-6-фосфат дегидрогеназы, при которой активность фермента в эритроцитах снижена в десять раз. Такая высокая частота встречаемости именно этого дефекта глюкозо-6-фосфат дегидрогеназы может говорить о некоторых преимуществах, которыми обладают носители данного гена в определенных условиях среды обитания. Действительно, указанный дефект глюкозо-6- фосфат дегидрогеназы защищает эритроциты носителей гена от возбудителя малярии Plasmodium falciparum. Выживаемость дефектных генов глюкозо-6- фосфат дегидрогеназы, как и в случае серповидноклеточной анемии, повидимому, обусловлена повышенной сопротивляемостью носителей этих генов к малярии. Было показано, что для оптимального роста возбудителя малярии (Plasmodium falciparum) требуются нормально функционирующий пентозофосфатный путь и восстановленный глутатион. Таким образом, заметно сниженная активность глюкозо-6-фосфат дегидрогеназы и признак серповидноклеточности представляют собой параллельные механизмы защиты от малярии, что и обусловливает высокую частоту встречаемости соответствующего гена в тех регионах мира, где распространена малярия.
Весьма интересным является географическое распределение носителей генов дефектной глюкозо-6-фосфат дегидрогеназы. Частота встречаемости данной патологии достигает 25% в некоторых регионах тропической Африки, в отдельных областях Ближнего Востока и Юго-Восточной Азии, т.е. в тех районах, где малярия является основной причиной смертности. В дополнение к указанным эпидемиологическим наблюдениям исследования, проведенные in vitro, показали, что в эритроцитах, дефектных по глюкозо-6- фосфат дегидрогеназе наблюдается ингибирование роста и развития одного из возбудителей малярии – Plasmodium falciparum. Этот паразит оказался весьма чувствительным к оксидативным повреждениям и погибает в условиях окислительного стресса, тогда как сам носитель дефектного гена отличается удовлетворительным самочувствием. Благодаря тонко

сбалансированой устойчивости к малярии и относительно хорошей переносимости окислительного стресса естественный отбор сохраняет дефектный по глюкозо-6-фосфат дегидрогеназе генотип в популяции людей, проживающих в районах с высоким риском заболевания малярией. Только в условиях непреодолимого окислительного стресса, вызываемого действием лекарственных препаратов, гербицидов или вицина пониженная активность глюкозо-6-фосфат дегидрогеназы действительно служит причиной возникновения серьезных медицинских проблем.
Противомалярийный препарат памахин, как полагают, действует в качестве терапевтического средства, вызывая состояние окислительного стресса у паразита. По иронии судьбы противомалярийные препараты могут служить причиной развития заболевания по тем же самым биохимическим механизмам, которые обеспечивают устойчивость к малярии. Интересно, что дивицин также действует как антималярийный препарат и употребление в пищу бобов Vicia faba может обеспечить защиту от малярии. Таким образом, отказываясь от употребления в пищу бобов Vicia faba, многие пифагорейцы с нормальной активностью глюкозо-6-фосфат дегидрогеназы невольно способствуют повышению риска заболевания малярией.
Неокислительные реакции пентозофосфатного пути
Неокислительные реакции пентозофосфатного пути обеспечивают превращение рибозо-5-фосфата в глицеральдегид-3-фосфат и фруктозо-6- фосфат с участием ферментов транскетолазы и трансальдолазы. Эти ферменты создают обратимую связь между пентозофосфатным путем и гликолизом, катализируя следующие реакции:
Суммарный выход трех реакций, как можно видеть – образование двух гексоз и одной триозы из трех пентоз.
Осуществление этих процессов зависит от переноса двухуглеродного фрагмента транскетолазой и трехуглеродного фрагмента трансальдолазой:
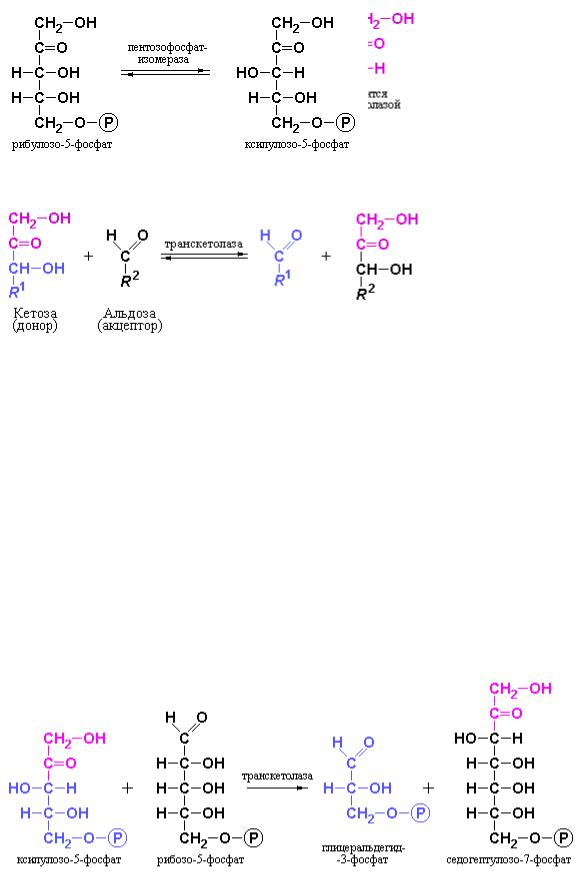
Донором двух- и трехуглеродных фрагментов являются кетозы, а акцептором – альдозы.
Для осуществления первой реакции, включающей взаимодействие двух пентоз необходима эпимеризация части молекулы рибулозо-5-фосфата в ксилулозо-5-фосфат под действием пентозофосфат-изомеразы:
Ксилулозо-5-фосфат выполняет роль донора двухуглеродного фрагмента в первой транскетолазной реакции:
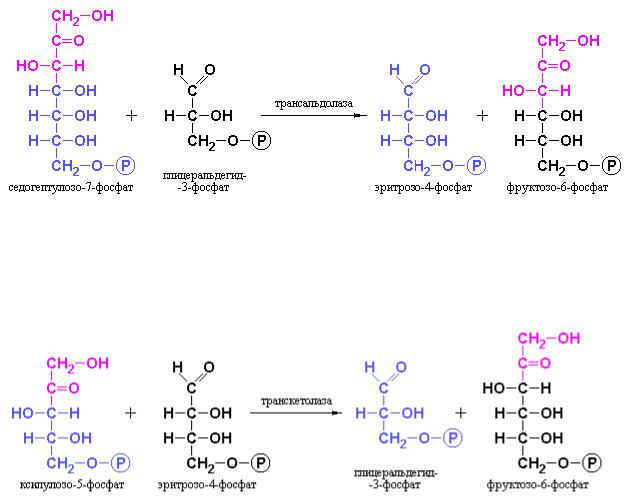
На следующей стадии, катализируемой трансальдолазой, происходит взаимодействие седогептулозо-7-фосфата с глицеральдегид-3-фосфатом с образованием эритрозо-4-фосфата и фруктозо-6-фосфата:
На третьей стадии процесса транскетолаза катализирует синтез фруктозо-6-фосфата и глицеральдегид-3-фосфата из эритрозо-4-фосфата и ксилулозо-5-фосфата:
Таким образом, избыток рибозо-5-фосфата, синтезированного в пентозофосфатном пути, может быть количественно превращен в промежуточные продукты гликолиза.
Ключевым ферментом неокислительных реакций пентозофосфатного пути является транскетолаза, содержащая в качестве простетической группы прочно связанный с активным центром тиаминпирофосфат. Механизм каталитического действия транскетолазы сходен с уже рассматривавшимся механизмом действия пируват-дегидрогеназы и состоит в переносе активированного альдегидного фрагмента на соответствующий акцептор.
Синдром Вернике-Корсакова
Нарушение способности транскетолазы связывать тиаминпирофосфат является причиной нервно-психического расстройства, называемого синдромом Вернике-Корсакова. (Blass J.P., Gibson G.E., Abnormality of a
thiamine-requiring enzyme in patients with Wernicke-Korsakoff syndrome, New Engl. J. Med., 1977, 297, 1367-1370).
Указанное заболевание характеризуется парезом глазодвигательного нерва, ненормальной осанкой и походкой, а также значительным нарушением психики. Особенно заметны проявления дезориентации и сильного ослабления памяти. Известно, что данный синдром развивается у определенного числа алкоголиков или у лиц с длительным нарушением питания.
Данное заболевание значительно чаще встречается у европейцев, чем у неевропейцев при нехватке тиамина в пище.
Проведенные недавно исследования активности транскетолазы в культуре фибробластов показали, что способность связывать тиаминпирофосфат транскетолазой у больных в 10 раз ниже, чем у здоровых людей. При этом было отмечено, что два других тиамин-зависимых фермента
– пируват-дегидрогеназа и α-кетоглутарат-дегидрогеназа не обнаруживают отклонений от нормы при этом заболевании. Поэтому для дифференцированной диагностики нарушений, связанных с дефектами пируват-дегидрогеназы, чрезвычайно важно осуществлять определение активности транскетолазы.
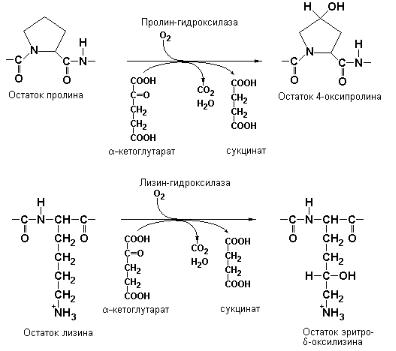
ПРИЛОЖЕНИЕ 5.1
Гидроксилирование и другие модификации белков соединительных тканей
Коллаген является одним из наиболее широко распространенных белков в организме. Он составляет большую часть органической массы кожи, сухожилий, кровеносных сосудов, костей, роговицы и стекловидного тела глаз, а также является компонентом мембран. Близкий по свойствам к коллагену белок – эластин – был обнаружен в эластичных фибриллах соединительных тканей, содержащихся в связках и в стенках кровеносных сосудов. Коллаген синтезируется фибробластами и выделяется в межклеточное пространство, где он полимеризуется, образуя прочный долгоживущий материал. Внутриклеточный предшественник коллагена – проколлаген, так же как и зрелый белок, состоит из трех цепей. Основная форма коллагена в большей части тканей большинства видов организмов (коллаген I) содержит две α1(I)-цепи и одну α2-цепь, в связи с чем его обозначают как [α1(I)]2α2. Коллаген хрящей (коллаген II) содержит три α1цепи и обозначается как [α1(II)]3. Коллаген III, обнаруживаемый в различных тканях, особенно эмбрионов, имеет строение [α1(III)]3.
Каждая цепь проколлагена (мол. масса 140.000 Да) содержит более 1000 аминокислотных остатков. Под действием специфических гидроксилаз происходит гидроксилирование некоторых остатков пролина и лизина в проколлагеновых цепях с образованием 4-оксипролина и оксилизина, соответственно.

Указанные гидроксилирующие ферменты относятся к группе монооксигеназ, способных принимать атомы водорода от α-кетоглутарата, декарбоксилируемого в этом случае в сукцинат. Под действием пролингидроксилазы может также происходить образование 3-оксипролина, но в меньших количествах. Гидроксилирование начинается уже тогда, когда растущие полипептидные цепи проколлагена еще связаны с рибосомами, расположенными на мембранах шероховатого эндоплазматического ретикулума. Полагают, что как пролин-гидроксилаза, так и лизингидроксилаза проколлагена локализованы в пузырьках эндоплазматического ретикулума.
Некоторые гидроксильные группы боковых цепей оксилизина в составе проколлагена подвергаются гликозилированию путем переноса на них галактозильных единиц, а затем дополнительно на некоторые галактозильные группы переносятся гликозильные остатки. Три проколлагеновые цепи связываются друг с другом и образуют тройную спираль еще до их выделения из фибробластов. В межклеточном пространстве проколлаген подвергается действию двух специфических ферментов – проколлаген-пептидаз, которые отщепляют с С-конца каждой из трех цепей полипептид с молекулярной массой приблизительно 35.000 Да, а с N-конца каждой из трех цепей полипептид с молекулярной массой, равной приблизительно 20.000 Да. Аминокислотный состав отщепляемых полипептидов существенно отличается от аминокислотного состава остающегося коллагенового мономера (называемого также тропоколлагеном), который на одну треть состоит из глицина и содержит много пролина. Эти концевые полипептиды связаны друг с другом в молекулах проколлагена дисульфидными мостиками, образующимися до их выделения из клеток. Мономеры коллагена представляют собой трехнитевые «тяжи» диаметром, равным приблизительно 1,5 нм и длиной 300 нм. Когда они достигают места своей окончательной локализации, они связываются друг с другом поперечными связями, образуя коллаген. Этот процесс инициируется окислением аминогрупп боковых цепей некоторых остатков лизина и оксилизина до альдегидных групп, катализируемым медьсодержащими оксидазами.
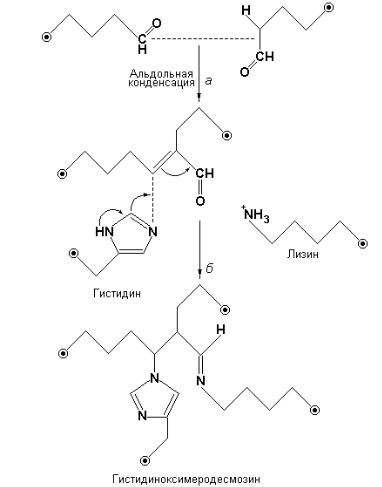
Альдегидные группы вступают в различные реакции, приводящие к образованию поперечных связей между тропоколлагеновыми единицами и к образованию нерастворимых нитей. Одной из реакций является альдольная конденсация, сопровождающаяся отщеплением молекулы воды (рис. 5.1.1, стадия а). Если один из двух альдегидов, участвующих в альдольной конденсации, происходит из оксилизина, то образуются два изомерных продукта. Продукт альдольной конденсации может реагировать дальше: имидазольная группа боковой цепи гистидина способна присоединиться к двойной углерод-углеродной связи, а боковая цепь лизина может образовать со свободным альдегидом Шиффово основание. Результаты этих двух процессов иллюстрируются уравнением на рис. 5.1.1 (стадия б).
Рис. 5.1.1 Альдегидные группы остатков лизина и оксилизина образующиеся под действием лизил-оксидазы вступают далее в различные реакции, приводящие к формированию поперечных связей между единицами тропоколлагена и к образованию нерастворимых нитей.
В конечном продукте, гистидиноксимеродесмозине, связаны друг с другом четыре боковые группы разных аминокислотных остатков. В других
