
- •Автор:
- •ISBN 978-985-6823-61-2
- •Д. Мецлер
- •Введение
- •Пищеварительные ферменты секретируются в виде зимогенов
- •Апикальная сторона
- •Базальная сторона
- •Всасывание и секреция электролитов
- •Секреция соляной кислоты обкладочными клетками желудка
- •Баланс азота и азотистое равновесие
- •Нормы белка в питании
- •Биологическая ценность белков
- •Обмен простых белков
- •Переваривание белков в желудке
- •Действие пепсина
- •Таблица 3.1
- •Субстратная специфичность протеиназ желудочно-кишечного тракта
- •Активный фермент
- •Зимоген
- •Активатор
- •Пепсин А
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Трипсиноген
- •Химотрипсиноген
- •Проэластаза
- •Карбоксипептидаза А
- •Карбоксипептидаза В
- •Аминопептидаза
- •Трипсин
- •Трипсин
- •Трипсин
- •Механизм активации химотрипсиногена
- •Общие свойства семейства сериновых протеиназ
- •Нарушения процессов переваривания белков
- •Механизм действия карбоксипептидазы А
- •Всасывание свободных аминокислот
- •Всасывание интактных белков
- •Лекция № 4
- •Обмен аминокислот в норме и при патологии
- •Общие реакции аминокислот
- •Оксидазы аминокислот
- •Реакции аммиака
- •Цикл мочевины
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат синтетаза
- •Орнитин транскарбамоилаза
- •Аргининосукцинат синтетаза
- •Аргининосукцинат лиаза
- •Аргиназа
- •Обмен индивидуальных аминокислот в норме и при патологии
- •Таблица 5.1
- •Значение клетчатки в питании человека
- •Таблица 6.1
- •Целлюлоза
- •Гемицеллюлоза
- •Лигнин
- •Пектин
- •Фрукты
- •Камеди
- •Непрямые эффекты рафинированных углеводов
- •Переваривание и всасывание углеводов
- •Таблица 6.2
- •Название
- •углевода
- •Тип связи
- •Структура
- •Амилопектин
- •Амилоза
- •Сахароза
- •Трегалоза
- •Молодые грибы
- •Лактоза
- •Фруктоза
- •Фрукты, мед
- •Глюкоза
- •Раффиноза
- •Бобовые
- •Таблица 6.3
- •Продукт реакции
- •Амилоза
- •Глюкоза
- •Глюкоза
- •Глюкоза
- •Сахароза
- •Глюкоза, фруктоза
- •Трегалоза
- •Глюкоза
- •Глюкоза, церамид
- •Лактоза
- •Глюкоза, галактоза
- •Всасывание моносахаридов
- •Таблица 6.4
- •Базальная поверхность
- •Хорошие субстраты
- •Флоризин
- •Цитохалазин В
- •Гипоксические повреждения тканей
- •Субстратные циклы
- •Гипогликемия у недоношенных детей
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Таблица 9.1
- •Cостав пируват-дегидрогеназного комплекса млекопитающих
- •Таблица 9.3
- •Кофакторы и простетические группы пируват-дегидрогеназы
- •Локализация
- •Регуляция пируватдегидрогеназного комплекса
- •Глюконеогенез
- •Особенности синтеза гликогена: гликогенин в роли праймера
- •Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
- •Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
- •Генетические дефекты структуры коллагена
- •ПРИЛОЖЕНИЕ 6.1
- •Функция
- •ПРИЛОЖЕНИЕ 7.1
- •Обмен 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •ПРИЛОЖЕНИЕ 7.2
- •Гликолиз и рак
- •Таблица 7.2.1
- •Белок/фермент
- •Функция
- •Лизосомные болезни накопления
- •Дополнительная литература
- •Окислительное декарбоксилирование
- •Регуляция пируватдегидрогеназного комплекса
- •Нарушения метаболизма, связанные с дефектами
- •пируватдегидрогеназы
- •Глюконеогенез
- •Регуляция активности пируват-карбоксилазы
- •Глюконеогенез и гликолиз регулируются реципрокно
- •Гликогенолиз и гликогенез
- •Ферментативное обеспечение гликогенолиза
- •Болезни накопления гликогена I типа
- •Деградация молекул гликогена в местах ветвления
- •Болезни накопления гликогена II, III и V типов
- •Синтез гликогена
- •Особенности синтеза гликогена: гликогенин
- •в роли праймера
- •Цикл Кори
- •Гипогликемия и алкогольная интоксикация
- •Пентозофосфатный путь
- •Неокислительные реакции пентозофосфатного пути
- •Синдром Вернике-Корсакова
- •Генетические дефекты структуры коллагена
- •Биосинтез полиаминов
- •Катаболизм полиаминов
- •Клиническое значение 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •Рекомендуемая литература
- •Основная литература
- •Дополнительная литература
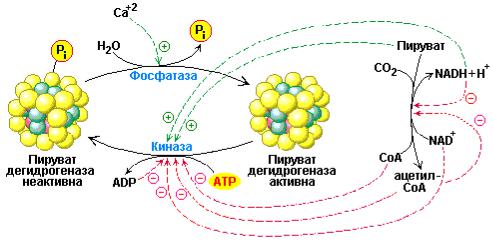
Рис. 9.9 Общая схема механизма пируват-дегидрогеназной реакции: пируватдегидрогеназный мультиферментный комплекс. ТРР – тиаминпирофосфат, Lip – липоамид.
Регуляция пируватдегидрогеназного комплекса
Образование ацетил-S-СоА из пировиноградной кислоты представляет собой ключевой необратимый этап метаболизма. Животные, в том числе млекопитающие и человек, не способны использовать ацетил-S-СоА для последующего его превращения в глюкозу.
Окислительное декарбоксилирование пирувата в ацетил-S-СоА создаёт возможность для дальнейших превращений атомов глюкозы по двум путям:
-полное окисление до СО2 через цикл трикарбоновых кислот с одновременным генерированием энергии.
-включение ацетил-S-СоА в реакции синтеза липидов.
Исходя из общих представлений относительно роли необратимых реакций, есть все основания полагать, что степень проявления активности пируват-дегидрогеназного комплекса выполняет регуляторные функции и сам мультиферментный комплекс должен строго регулироваться. Оказалось, что функционирование пируват-дегидрогеназы, как мультиферментной системы в целом, регулируется тремя путями (рис. 9.10).
Рис. 9.10 Регуляция пируват-дегидрогеназного комплекса. Комплекс ингибируется непосредственными продуктами реакции – NADH и ацетил-СоА. Пируват-дегидрогеназный компонент комплекса также регулируется путем ковалентной модификации. Специфическая протеин киназа фосфорилирует пируват-дегидрогеназу и тем самым ингибирует фермент. С другой стороны фосфопротеин фосфатаза активирует пируват-дегидрогеназу за счет реакции дефосфорилирования фермента. Кроме того, и протеин киназа и фосфопротеин фосфатаза также являются регулируемыми ферментами
(Berg J.M., Tymoczko J.L., Lubert Stryer, Biochemistry, W.H. Freeman
(ed.), 2006).
Во-первых, как было показано, пируват-дегидрогеназная реакция конкурентно ингибируется конечными продуктами – ацетил-S-СоА и NADH. Ацетил-S-СоА подавляет активность трансацетилазного компонента (Е2) ферментного комплекса, а NADH ингибирует дигидролипоил-дегидрогеназу (Е3). Указанные ингибиторные эффекты обращаются в присутствии возрастающих концентраций НS-СоА и NAD.+
Во-вторых, регуляция активности комплекса достигается посредством ковалентной модификации. Пируват-дегидрогеназный комплекс может существовать в двух формах – активной, дефосфорилированной и неактивной, фосфорилированной. Инактивация комплекса происходит при участии Mg2+-ATP-зависимой протеин-киназы, которая прочно связана с мультиферментным комплексом. Реактивация комплекса обеспечивается фосфопротеин-фосфатазой, которая удаляет специфические фосфорильные остатки в ходе Mg2+- и Са2+-зависимой реакции дефосфорилирования.
Mg2+-ATP-зависимая протеин-киназа фосфорилирует три различных остатка серина в α-субъединице пируват-дегидрогеназы (Е1), однако, для ингибирования активности комплекса существенным является фосфорилирование только одного из этих остатков. Кроме того, сайт фосфорилирования присутствует также в трансацетилазном компоненте (Е2), подчеркивая еще раз структурное и механистическое значение кора, образованного тримерами трансацетилазы. Схема, приведенная на рис. 9.10, иллюстрирует основные уровни регуляции мультиферментного пируватдегидрогеназного комплекса.
Ингибирование активной (дефосфо-) пируват-дегидрогеназы достигается не только в присутствии высокого содержания продуктов реакции – ацетил-S-СоА и NADH. Известно, что эти два соединения стимулируют киназу пируват-дегидрогеназы, приводя к превращению фермента из активного в неактивное фосфорилированное состояние. В свою очередь свободные HS-СоА и NAD+ ингибируют киназу пируватдегидрогеназы. Следовательно, фосфорилирование пируват-дегидрогеназы усиливается при высоких соотношениях концентраций [ATP]/[ADP], [ацетил- S-CoA]/[HS-CoA], [NADH]/[NAD+], но ингибируется пируватом, HS-СоА и
NAD+ (см. рис. 9.10). Это означает, что дефосфорилирование комплекса усиливается при повышении концентрации субстрата реакции. Таким образом, дифференцированная регуляция киназы пируват-дегидрогеназы и фосфатазы пируват-дегидрогеназы является главным ключом к регуляции пируват-дегидрогеназного комплекса в целом.
В-третьих, активность ферментного комплекса регулируется по принципу обратной связи и зависит от энергетического заряда клетки. Пируват-дегидрогеназный компонент комплекса специфически ингибируется GTP и активируется АМР.
Вдобавок было обнаружено, что введение инсулина активирует пируват-дегидрогеназу в адипозной ткани, а катехоламины активируют фермент миоцитов. Механизмы этих гормональных сигналов до сих пор плохо изучены, но полагают, что в данном случае имеет место такое перераспределение внутриклеточного Са2+, которое приводит к стимуляции фосфопротеин-фосфатазы в митохондриальном компартменте.
Нарушения метаболизма, связанные с дефектами пируватдегидрогеназы
Особенно большое число заболеваний, связанных с нарушениями обмена пировиноградной кислоты обнаружено у детей. Некоторые из этих заболеваний определяются нарушениями структуры отдельных каталитических или регуляторных субъединиц мультиферментного пируватдегидрогеназного комплекса.
Нарушения функции пируват-дегидрогеназы у детей диагностируются, как повышенный уровень в сыворотке крови молочной кислоты, пировиноградной кислоты и аланина, накопление которых в сумме приводит к хроническому молочнокислому ацидозу. Такие пациенты характеризуются тяжелыми неврологическими дефектами и, в большинстве случаев, нарушения ферментативных функций пируват-дегидрогеназы приводят к смерти.
Однако, в некоторых случаях положительный терапевтический эффект может быть достигнут посредством корректировки диеты, в которой углеводы заменяют кетогенными составляющими. (Sheu K.F., Hu C.C., Utter M.F., Pyruvate dehydrogenase complex activity in normal and deficient fibroblasts, J. Clin. Invest., 1981, 67, 1463-1475 и Stagpoole P.W., Harmon E.M., Curry S.H., Baumgarten T.G., Misbin R.I., Treatment of lactic acidosis with dichloroacetate, N. Engl. J. Med., 1983, 309, 391-402).
Диагностика заболеваний, связанных с нехваткой пируватдегидрогеназы основана на биохимическом определении ферментативной активности целого комплекса или ферментативных активностей отдельных компонентов в клеточной культуре фибробластов, взятых у пациента.
Сильный молочнокислый ацидоз, вызванный ингибированием пируватдегидрогеназы может наблюдаться у людей в состоянии шока. У таких пациентов увеличивается уровень лактата вследствие снижения оксигенирования тканей и увеличения вклада анаэробного метаболизма. В таких случаях пациентам вводят дихлорацетат, который является ингибитором киназы пируват-дегидрогеназы (т.е. Mg2+-ATP-зависимой протеин-киназы), что, в свою очередь, обеспечивает активацию всего мультиферментного комплекса.
Нормальное функционирование пируват-дегидрогеназы зависит не только от целостности структуры отдельных каталитических или
регуляторных субъединиц самого комплекса, но и от целостности структуры ферментов контроля активности пируват-дегидрогеназного комплекса, обеспечивающих его фосфорилирование/дефосфорилирование. Это наглядно демонстрирует клиническая картина, связанная с дефектами фосфопротеин фосфатазы у людей. Из-за того, что фосфатаза дефектна пируватдегидрогеназа остается фосфорилированной, а значит неактивной. Вследствие этого глюкоза распадается до молочной кислоты. Такая ситуация также приводит к развитию хронического молочнокислого ацидоза, который служит причиной повреждения многих тканей и, главным образом, центральной нервной системы.
Характерное описание одного очень мучительного заболевания у людей было приведено еще в 1630 году датским врачом Якобусом Бонитусом. В соответствии с этим описанием люди, страдающие данным заболеванием, называемым бери-бери, «…ходят высоко поднимая ноги, у них дрожат колени. У больных наблюдаются отклонения в характере движений, нарушается чувствительность рук и ног, а иногда и всего тела».
Бери-бери вызывается недостатком в пище тиамина (витамина В1). Болезнь была и остается серьезной проблемой для жителей Дальнего Востока, поскольку рис, их основной продукт питания, беден тиамином. Бери-бери не редко встречается при остром истощении у алкоголиков. Болезнь характеризуется симптомами неврологических заболеваний и сердечной недостаточности. Повреждение периферической нервной системы проявляется в виде болей в конечностях, мышечной слабости, нарушения кожной чувствительности. Сердце может быть увеличено, а минутный объем сниженным.
Исходя из выше сказанного, становится понятным, что данное заболевание связано с нехваткой в пище тиамина, который в виде тиаминпирофосфата служит в качестве простетической группы пируватдегидрогеназы. Кроме того, тиаминпирофосфат выполняет такую же функцию в составе α-кетоглутарат-дегидрогеназы (одного из важнейших ферментов цикла трикарбоновых кислот) и транскетолазы (фермента пентозофосфатного пути, ответственного за перенос двухуглеродных фрагментов с одного сахара на другой). Общей особенностью ферментативных реакций, зависящих от тиаминпирофосфата, является перенос активированного альдегидного фрагмента –СО–СН3.
При бери-бери содержание в крови пирувата и α-кетоглутарата существенно превышает норму. Особенно выражено увеличение уровня пировиноградной кислоты после приема пищи, богатой углеводами, в частности, глюкозой. Ферментативные активности пируват- и α-кетоглутарат-дегидрогеназных комплексов in vivo резко снижены по сравнению с нормой. Кроме того, при бери-бери существенно снижена транскетолазная активность в эритроцитах. Характерным является то обстоятельство, что именно активность транскетолазы определяют при диагностике данного заболевания.
