
- •Автор:
- •ISBN 978-985-6823-61-2
- •Д. Мецлер
- •Введение
- •Пищеварительные ферменты секретируются в виде зимогенов
- •Апикальная сторона
- •Базальная сторона
- •Всасывание и секреция электролитов
- •Секреция соляной кислоты обкладочными клетками желудка
- •Баланс азота и азотистое равновесие
- •Нормы белка в питании
- •Биологическая ценность белков
- •Обмен простых белков
- •Переваривание белков в желудке
- •Действие пепсина
- •Таблица 3.1
- •Субстратная специфичность протеиназ желудочно-кишечного тракта
- •Активный фермент
- •Зимоген
- •Активатор
- •Пепсин А
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Трипсиноген
- •Химотрипсиноген
- •Проэластаза
- •Карбоксипептидаза А
- •Карбоксипептидаза В
- •Аминопептидаза
- •Трипсин
- •Трипсин
- •Трипсин
- •Механизм активации химотрипсиногена
- •Общие свойства семейства сериновых протеиназ
- •Нарушения процессов переваривания белков
- •Механизм действия карбоксипептидазы А
- •Всасывание свободных аминокислот
- •Всасывание интактных белков
- •Лекция № 4
- •Обмен аминокислот в норме и при патологии
- •Общие реакции аминокислот
- •Оксидазы аминокислот
- •Реакции аммиака
- •Цикл мочевины
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат синтетаза
- •Орнитин транскарбамоилаза
- •Аргининосукцинат синтетаза
- •Аргининосукцинат лиаза
- •Аргиназа
- •Обмен индивидуальных аминокислот в норме и при патологии
- •Таблица 5.1
- •Значение клетчатки в питании человека
- •Таблица 6.1
- •Целлюлоза
- •Гемицеллюлоза
- •Лигнин
- •Пектин
- •Фрукты
- •Камеди
- •Непрямые эффекты рафинированных углеводов
- •Переваривание и всасывание углеводов
- •Таблица 6.2
- •Название
- •углевода
- •Тип связи
- •Структура
- •Амилопектин
- •Амилоза
- •Сахароза
- •Трегалоза
- •Молодые грибы
- •Лактоза
- •Фруктоза
- •Фрукты, мед
- •Глюкоза
- •Раффиноза
- •Бобовые
- •Таблица 6.3
- •Продукт реакции
- •Амилоза
- •Глюкоза
- •Глюкоза
- •Глюкоза
- •Сахароза
- •Глюкоза, фруктоза
- •Трегалоза
- •Глюкоза
- •Глюкоза, церамид
- •Лактоза
- •Глюкоза, галактоза
- •Всасывание моносахаридов
- •Таблица 6.4
- •Базальная поверхность
- •Хорошие субстраты
- •Флоризин
- •Цитохалазин В
- •Гипоксические повреждения тканей
- •Субстратные циклы
- •Гипогликемия у недоношенных детей
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Таблица 9.1
- •Cостав пируват-дегидрогеназного комплекса млекопитающих
- •Таблица 9.3
- •Кофакторы и простетические группы пируват-дегидрогеназы
- •Локализация
- •Регуляция пируватдегидрогеназного комплекса
- •Глюконеогенез
- •Особенности синтеза гликогена: гликогенин в роли праймера
- •Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
- •Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
- •Генетические дефекты структуры коллагена
- •ПРИЛОЖЕНИЕ 6.1
- •Функция
- •ПРИЛОЖЕНИЕ 7.1
- •Обмен 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •ПРИЛОЖЕНИЕ 7.2
- •Гликолиз и рак
- •Таблица 7.2.1
- •Белок/фермент
- •Функция
- •Лизосомные болезни накопления
- •Дополнительная литература
- •Окислительное декарбоксилирование
- •Регуляция пируватдегидрогеназного комплекса
- •Нарушения метаболизма, связанные с дефектами
- •пируватдегидрогеназы
- •Глюконеогенез
- •Регуляция активности пируват-карбоксилазы
- •Глюконеогенез и гликолиз регулируются реципрокно
- •Гликогенолиз и гликогенез
- •Ферментативное обеспечение гликогенолиза
- •Болезни накопления гликогена I типа
- •Деградация молекул гликогена в местах ветвления
- •Болезни накопления гликогена II, III и V типов
- •Синтез гликогена
- •Особенности синтеза гликогена: гликогенин
- •в роли праймера
- •Цикл Кори
- •Гипогликемия и алкогольная интоксикация
- •Пентозофосфатный путь
- •Неокислительные реакции пентозофосфатного пути
- •Синдром Вернике-Корсакова
- •Генетические дефекты структуры коллагена
- •Биосинтез полиаминов
- •Катаболизм полиаминов
- •Клиническое значение 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •Рекомендуемая литература
- •Основная литература
- •Дополнительная литература
меньше. Впрочем, представляется маловероятным, чтобы такое декарбоксилирование играло заметную роль в интактных тканях человека.
Реакции аммиака
Конечными продуктами распада аминокислот в организме при высоком содержании белка в пищевом рационе являются аммиак, мочевина, углекислый газ и вода. Один из продуктов распада – аммиак является высокотоксичным соединением для центральной нервной системы, и накопление его в больших количествах представляло бы серьезную опасность для организма. Симптомами аммиачного отравления являются своеобразный тремор, нечленораздельная речь, затуманивание зрения, а в тяжелых случаях отравления коматозное состояние и летальный исход. Эти симптомы подобны тем, которые характерны для синдрома печеночной комы, развивающейся при повышении концентрации аммиака в крови и мозге (см. далее).
Большая часть аммиака устраняется при помощи ряда специфических реакций, в результате которых аммиак превращается в нетоксические соединения, подлежащие экскреции. Однако в некоторых случаях связывание аммиака сопровождается синтезом важнейших метаболитов. В организме постоянно протекают реакции синтеза пуриновых колец, присоединение аминогрупп к пиримидинам с образованием цитозина, а также реакции образования аминосахаров. Все эти процессы зависят от промежуточного образования глутамина, который синтезируется из глутаминовой кислоты и аммиака с участием глутамин синтетазы. Глутамин, являющийся амидом глутаминовой кислоты, представляет собой одну из 20 протеиногенных аминокислот, необходимых для синтеза белка. Кроме того, в почках глутамин является основным источником экскретируемого аммиака. Таким образом, аммиак переносится в кровь в виде нетоксичного, неионизованного амида, который играет важную роль в регуляции рН мочи за счет нейтрализации кислых продуктов обмена аммиаком, высвобождаемым при простом гидролизе амидной группы под действием почечной глутаминазы.
Именно по этой причине уровень глутамина в крови обычно превосходит содержание любой другой аминокислоты. Итак, аммиак, выделяемый при деградации аминокислот в печени, становится доступным в виде глутамина для других органов, отвечающих за синтез пуринов, пиримидинов и других соединений.
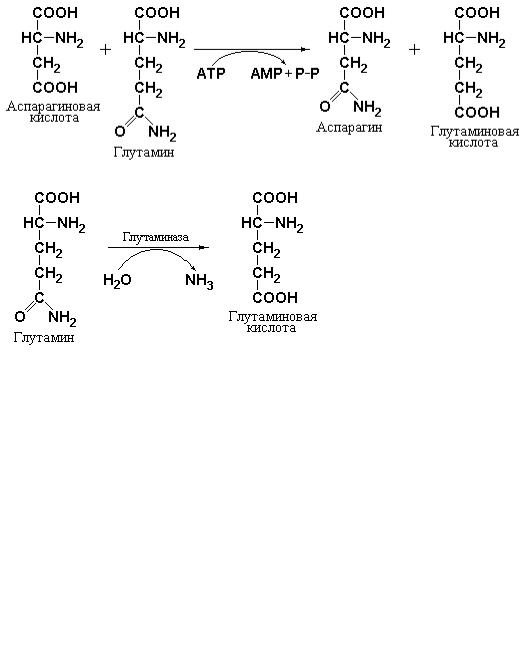
Глутамин также поставляет амидные группы для синтеза другого гомолога – аспарагина. Данная реакция является энергозависимой. АТР необходим для активации β-карбоксильной группы аспартата.
В настоящее время неизвестно имеет ли аспарагин какое-либо другое назначение у млекопитающих и человека кроме, как одна из аминокислот, необходимых для синтеза белка. Вместе с тем установленно, что некоторые быстро делящиеся лейкемические клетки утрачивают способность синтезировать аспарагин и зависят от уровня данного амида в крови. Данные предпосылки являются молекулярной основой возможного терапевтического использования аспарагиназы, катализирующей реакцию удаления амидной группы из аспарагина.
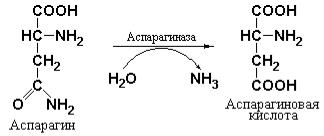
Использование аспарагиназы позволит лишить неопластические клетки необходимых количеств аспарагина, за счет резкого снижения уровня этого соединения в сыворотке крови (Ellem K.A.O., Fabrizio A.M., Jackson L., The dependence of DNA and RNA synthesis on protein synthesis in asparaginasetreated lymphoma cells, Cancer Res., 1970, 30, 515-526).
Цикл мочевины
Как уже упоминалась, некоторая часть NH4+, образующегося при расщеплении аминокислот, расходуется на биосинтез азотистых соединений. У большинства наземных животных и у человека около 80% азота экскретируется в виде мочевины. У птиц и пресмыкающихся NH4+ превращается в мочевую кислоту, которая и выделяется из организма, тогда как у многих водных животных он экскретируется как таковой. Эти три группы организмов носят название уротелических, урикотелических и аммонотелических, соответственно.
У наземных животных и человека мочевина синтезируется в цикле мочевины. Эту последовательность реакций впервые описали Ганс Кребс и Курт Хензеляйт в 1932 году (по этой причине цикл мочевины носит название цикла Кребса-Хензеляйта). Цикл мочевины является, в сущности, первым обнаруженным циклическим метаболическим путем. Один из атомов азота мочевины происходит из аммиака, другой из аспарагиновой кислоты. Углеродный атом мочевины происходит из СО2. Переносчиком этих атомов в цикле служит аминокислота орнитин. Поэтому другое название цикла мочевинообразования – орнитиновый цикл.
Расщепление аминокислот интенсивно происходит во всех органах и тканях человека, однако основная часть мочевины синтезируется в печени. Значение этого органа в обмене азота можно проиллюстрировать на примере явлений гипераммониемии и гепатической комы.
Синдром гепатической комы является следствием увеличения уровня аммиака в крови (гипераммониемия), превышающего нормальную концентрацию NH4+, составляющую 30-60μМ. Потеря сознания вызывается резкой нехваткой АТР в мозге. Дело в том, что аммиак способен проникать через гематоэнцефалический барьер и сдвигать равновесие реакции, катализируемой глутамат-дегидрогеназой, в сторону образования глутаминовой кислоты, что в свою очередь вызывает снижение
концентрации α-кетоглутарата, необходимого для нормального функционирования цикла трикарбоновых кислот:
Глутамат + NADP+ + H2O ← α-кетоглутарат + NADPH + NH4+ + H+
Гипераммониемия, как правило, вызывается неспособностью ферментных систем пациентов обеспечивать образование мочевины с необходимой скоростью для поддержания физиологической концентрации аммиака в крови. Во многих случаях к возникновению данного состояния причастны нарушения структуры ферментов цикла мочевины. Иногда транзиторная (преходящая) гипераммониемия отмечается у новорожденных при задержке синтеза ферментов цикла мочевины в онтогенезе.
Проявления гипераммониемии могут также наблюдаться в тех случаях, когда происходит нарушение нормального кровотока через печень. Переключение циркуляции крови от портальной системы на довольно интенсивный второстепенный кровоток через нижнюю полостную вену в обход печени может иметь место в случае цирроза данного органа. В некоторых случаях такой тип нарушения кровотока в печени устраняется хирургическим путем посредством шунтирования.
Выведение избытка азота с целью некоторой компенсации описанных выше нарушений обмена NH4+ может быть обеспечено за счет альтернативных реакций связывания аммиака. В этом случае удаление азота осуществляется благодаря направленному образованию экскретирующихся аминокислот – глицина и глутамина в ходе, так называемых анаплеротических (запасных) реакций. Биохимической основой анаплеротических реакций выведения избытка азота является способность α- кетоглутарата связывать два эквивалента аммиака с образованием глутамина, а также возможность синтеза глицина из аммиака и СО2 под действием глицин синтазы (см. лекцию 5). При этом осторожное введение органических ароматических кислот – бензойной и/или фенилуксусной сопровождается образованием их конъюгатов с данными аминокислотами, что может компенсировать нарушения цикла мочевины и предотвращать токсичное действие аммиака (см. далее).
Другой подход в лечении людей, страдающих нарушениями цикла мочевины состоит в замене в диете некоторых аминокислот на их α- кетоаналоги с тем, чтобы уменьшить поступление азота в организм и направить аминогруппы не на экскрецию, а на синтез необходимых аминокислот для биосинтеза тканевых белков.
Образование карбамоилфосфата является необходимой предпосылкой функционирования цикла мочевины
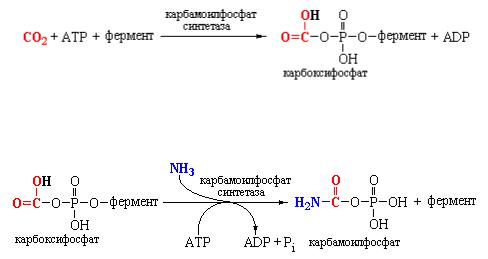
Фактически цикл мочевины начинается с образования цитруллина из диаминокарбоновой кислоты орнитина посредством добавления к последнему NH3 и СО2. Эта реакция зависит от предварительного синтеза
карбамоилфосфата под действием карбамоилфосфат-синтетазы, которая локализована в митохондриях гепатоцитов всех уреотетелических организмов, включая человека. В реакции, катализируемой карбамоилфосфат-синтетазой, одна молекула АТР активирует молекулу СО2 с образованием связанного с ферментом карбоксифосфата:
На второй стадии карбоксифосфат реагирует с аммиаком с образованием
карбамата:
При этом затрачивается вторая молекула АТР, которая реагирует со связанным с ферментом интермедиатом, что сопровождается высвобождением карбамоилфосфата. Изучение процесса образования мочевины позволило доказать, что в клетках печени присутствуют две различные карбамоилфосфат синтетазы.
Карбамоилфосфат-синтетаза I является составной частью матрикса митохондрий гепатоцитов, участвует в функционировании орнитинового цикла и зависит от присутствия специфического активатора – N- ацилированного глутамата (N-ацетилглутамата). Цитоплазматическая форма карбамоилфосфат-синтетазы, обозначаемая как карбамоилфосфатсинтетаза II, участвует в биосинтезе пиримидинов и не зависит от ацилированного глутамата в качестве активатора.
Цитруллин образуется при переносе карбамоильной группы от фосфорилированного производного на δ-аминогруппу орнитина. Реакция катализируется орнитин-транскарбамоилазой и протекает в митохондриях. Реакция высокоспецифична к орнитину, равновесие ее сильно сдвинуто в направлении синтеза цитруллина. Далее, образовавшийся цитруллин переносится из митохондрий в цитоплазму гепатоцитов.

На следующей стадии под действием аргининосукцинат-синтетазы происходит взаимодействие цитруллина с аспарагиновой кислотой.
Следующая стадия зависит от аргининосукцинат-лиазы, катализирущей реакцию образования аргинина. Вторым продуктом реакции является фумаровая кислота – один из интермедиатов цикла трикарбоновых кислот. Реакция протекает по механизму транс-элиминирования. Образовавшийся фумарат может превратиться в щавелевоуксусную кислоту, которая при переаминировании дает аспарагиновую кислоту.
Цикл мочевины завершается гидролизом аргинина до орнитина и мочевины в реакции катализируемой аргиназой.
