
- •Автор:
- •ISBN 978-985-6823-61-2
- •Д. Мецлер
- •Введение
- •Пищеварительные ферменты секретируются в виде зимогенов
- •Апикальная сторона
- •Базальная сторона
- •Всасывание и секреция электролитов
- •Секреция соляной кислоты обкладочными клетками желудка
- •Баланс азота и азотистое равновесие
- •Нормы белка в питании
- •Биологическая ценность белков
- •Обмен простых белков
- •Переваривание белков в желудке
- •Действие пепсина
- •Таблица 3.1
- •Субстратная специфичность протеиназ желудочно-кишечного тракта
- •Активный фермент
- •Зимоген
- •Активатор
- •Пепсин А
- •Трипсин
- •Химотрипсин
- •Эластаза
- •Трипсиноген
- •Химотрипсиноген
- •Проэластаза
- •Карбоксипептидаза А
- •Карбоксипептидаза В
- •Аминопептидаза
- •Трипсин
- •Трипсин
- •Трипсин
- •Механизм активации химотрипсиногена
- •Общие свойства семейства сериновых протеиназ
- •Нарушения процессов переваривания белков
- •Механизм действия карбоксипептидазы А
- •Всасывание свободных аминокислот
- •Всасывание интактных белков
- •Лекция № 4
- •Обмен аминокислот в норме и при патологии
- •Общие реакции аминокислот
- •Оксидазы аминокислот
- •Реакции аммиака
- •Цикл мочевины
- •Регуляция цикла мочевины
- •Наследственные дефекты ферментов цикла мочевины
- •Карбамоилфосфат синтетаза
- •Орнитин транскарбамоилаза
- •Аргининосукцинат синтетаза
- •Аргининосукцинат лиаза
- •Аргиназа
- •Обмен индивидуальных аминокислот в норме и при патологии
- •Таблица 5.1
- •Значение клетчатки в питании человека
- •Таблица 6.1
- •Целлюлоза
- •Гемицеллюлоза
- •Лигнин
- •Пектин
- •Фрукты
- •Камеди
- •Непрямые эффекты рафинированных углеводов
- •Переваривание и всасывание углеводов
- •Таблица 6.2
- •Название
- •углевода
- •Тип связи
- •Структура
- •Амилопектин
- •Амилоза
- •Сахароза
- •Трегалоза
- •Молодые грибы
- •Лактоза
- •Фруктоза
- •Фрукты, мед
- •Глюкоза
- •Раффиноза
- •Бобовые
- •Таблица 6.3
- •Продукт реакции
- •Амилоза
- •Глюкоза
- •Глюкоза
- •Глюкоза
- •Сахароза
- •Глюкоза, фруктоза
- •Трегалоза
- •Глюкоза
- •Глюкоза, церамид
- •Лактоза
- •Глюкоза, галактоза
- •Всасывание моносахаридов
- •Таблица 6.4
- •Базальная поверхность
- •Хорошие субстраты
- •Флоризин
- •Цитохалазин В
- •Гипоксические повреждения тканей
- •Субстратные циклы
- •Гипогликемия у недоношенных детей
- •Синтез глюкозы из других сахаров
- •Фруктоза
- •Манноза
- •Галактоза
- •Таблица 9.1
- •Cостав пируват-дегидрогеназного комплекса млекопитающих
- •Таблица 9.3
- •Кофакторы и простетические группы пируват-дегидрогеназы
- •Локализация
- •Регуляция пируватдегидрогеназного комплекса
- •Глюконеогенез
- •Особенности синтеза гликогена: гликогенин в роли праймера
- •Роль глюкозо-6-фосфат дегидрогеназы в защите клеток от действия активных форм кислорода
- •Дефекты глюкозо-6-фосфат дегидрогеназы и лекарственная гемолитическая анемия
- •Генетические дефекты структуры коллагена
- •ПРИЛОЖЕНИЕ 6.1
- •Функция
- •ПРИЛОЖЕНИЕ 7.1
- •Обмен 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •ПРИЛОЖЕНИЕ 7.2
- •Гликолиз и рак
- •Таблица 7.2.1
- •Белок/фермент
- •Функция
- •Лизосомные болезни накопления
- •Дополнительная литература
- •Окислительное декарбоксилирование
- •Регуляция пируватдегидрогеназного комплекса
- •Нарушения метаболизма, связанные с дефектами
- •пируватдегидрогеназы
- •Глюконеогенез
- •Регуляция активности пируват-карбоксилазы
- •Глюконеогенез и гликолиз регулируются реципрокно
- •Гликогенолиз и гликогенез
- •Ферментативное обеспечение гликогенолиза
- •Болезни накопления гликогена I типа
- •Деградация молекул гликогена в местах ветвления
- •Болезни накопления гликогена II, III и V типов
- •Синтез гликогена
- •Особенности синтеза гликогена: гликогенин
- •в роли праймера
- •Цикл Кори
- •Гипогликемия и алкогольная интоксикация
- •Пентозофосфатный путь
- •Неокислительные реакции пентозофосфатного пути
- •Синдром Вернике-Корсакова
- •Генетические дефекты структуры коллагена
- •Биосинтез полиаминов
- •Катаболизм полиаминов
- •Клиническое значение 2,3-дифосфоглицерата
- •Влияние нарушений гликолиза на транспорт кислорода
- •Рекомендуемая литература
- •Основная литература
- •Дополнительная литература
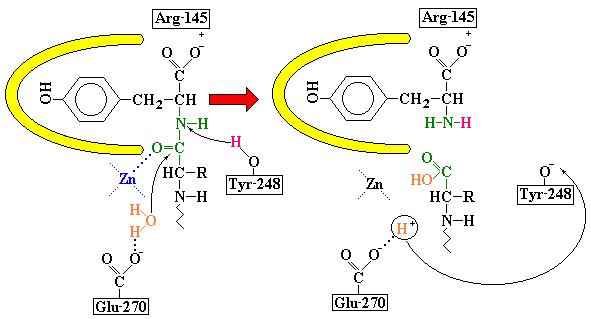
Tyr-248 отдает протон на ее NH-группу и пептидная связь расщепляется. Возникает закономерный вопрос, а какова роль атома цинка в катализе? Взаимодействие цинка с кислородом карбонильной группы сильно поляризует связь C = O, а неполярное окружение цинка усиливает его способность индуцировать диполь. Сильной поляризации карбонильной группы способствует также близость отрицательно заряженной карбоксильной группы Glu-270. Таким образом, карбоксипептидаза А индуцирует такое смещение электронов на субстрате, которое повышает скорость катализа.
Рис. 3.19 Возможный механизм каталитического действия карбоксипептидазы А. Остаток Glu-270 активирует молекулу воды, которая атакует карбонильный атом углерода расщепляемой пептидной связи. Гидролиз осуществляется прямо, без промежуточного образования ангидрида Glu270, постулируемого для другого механизма катализа.
Таким образом, карбоксипептидаза А, отщепляющая С-концевые аминокислоты от олигопептидов, служит примером фермента, в основе каталитического действия которого лежит принцип существенных структурных изменений в области активного центра. Пример карбоксипептидазы А иллюстрирует ту важную роль, которую играет в катализе индуцированное соответствие формы фермента форме субстрата.
Всасывание свободных аминокислот
В результате согласованного действия желудочных и панкреатических эндо- и экзопептидаз, а также олигопептидаз щеточной каемки энтероцитов пищевые белки расщепляются с образованием преимущественно свободных
аминокислот и небольшого количества ди- и трипептидов, которые должны всосаться в кровь (рис. 3.20).
Тонкий кишечник обладает высокой всасывающей способностью по отношению к аминокислотам. Большая часть L-аминокислот может транспортироваться через эпителиальный слой клеток против градиента концентрации, хотя необходимость такого транспорта in vivo не очевидна, так как концентрация аминокислот в просвете кишечника обычно выше, чем в плазме на 0.1 – 0.2 мМ.
Аминокислотный транспорт в тонком кишечнике характеризуется всеми особенностями транспорта, зависящего от переносчиков. Это энергозависимость, селективность в отношении L-изомеров и зависимость от температуры. Кроме того, на эффективность транспорта оказывают влияние генетические дефекты компонентов транспортных систем, обнаруженные у людей.
На основе генетического анализа и экспериментальных данных, полученных при исследовании транспорта амнокислот, было выявлено, по меньшей мере, шесть различных транспортных систем для L-аминокислот, которые локализованы в мембранах щеточной каемки энтероцитов. Эти транспортные системы различаются по специфичности, проявляемой к преимущественному переносу определенных групп аминокислот, а именно:
−нейтральных аминокислот с короткой или полярной боковой цепью (Ser, Thr, Ala);
−нейтральных аминокислот с ароматической или гидрофобной боковой цепью (Phe, Tyr, Met, Val, Ile, Leu);
−иминокислот (Pro, окси-Pro);
−β-аминокислот (β-Ala, таурин);
−оснóвных аминокислот и цистина (Lys, Arg, Cys-Cys);
−кислых аминокислот (Asp, Glu)
Как следует из рис. 3.20, механизм трансэпителиального транспорта L- аминокислот, по-видимому, подобен механизму транспорта D-глюкозы. На апикальной поверхности плазматических мембран клеток щеточной каемки были обнаружены Na+-зависимые транспортные системы аминокислот, и, соответственно, Na+-независимые системы идентифицированы на базальной части плазматических мембран эпителиальных клеток тонкого кишечника. Подобно транспорту D-глюкозы, прямым источником энергии для переноса аминокислот служит электрохимический градиент концентрации ионов Na+ и, косвенно, энергии гидролиза АТР. При трансмембранном переносе всасывающиеся аминокислоты никаким химическим модификациям не подвергаются.
