
- •Предмет колоїдної хімії
- •Класифікація колоїдних систем
- •Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища.
- •Контрольні питання:
- •Поверхневі явища та їх класифікація
- •Класифікація поверхневих явищ
- •Поверхневий натяг
- •Поверхневий натяг деяких речовин на межі з повітрям при 298к.
- •Методи визначення поверхневого натягу
- •Метод капілярного підняття (метод Жюрена).
- •Метод максимального тиску в бульбашці (метод Ребіндера)
- •Сталометричний метод (метод Траубе)
- •Внутрішня (повна) питома поверхнева енергія. Залежність енергетичних параметрів поверхні від температури
- •Принципи формування поверхневого шару
- •Поверхневий натяг органічних речовин на межі з повітрям при 298к.
- •Адгезія, когезія
- •Змочування і розтікання
- •Розтікання рідин. Ефект Марангоні
- •Контрольні питання:
- •Дисперсність і властивості тіл
- •Характеристика величини і форми поверхні
- •Зміна питомої поверхні при подрібненні речовини.
- •Вплив дисперсності на внутрішній тиск
- •Капілярні явища
- •Дисперсність і реакційна здатність речовин
- •Тиск насиченої пари над викривленою поверхнею
- •Вплив дисперсності на температуру фазового переходу
- •Залежність температури топлення калію і срібла від дисперсності.
- •Вплив дисперсності на розчинність твердих тіл
- •Вплив дисперсності на рівновагу хімічних реакцій
- •Контрольні питання:
- •Адсорбційні рівноваги.
- •Основні поняття та визначення.
- •Природа адсорбційних сил
- •Фундаментальне рівняння адсорбції Гіббса
- •Теплота адсорбції.
- •Швидкість фізичної адсорбції
- •Адсорбція газів на однорідній твердій поверхні.
- •Ізотерма адсорбції (закон) Генрі
- •Теорія адсорбції Ленгмюра
- •Теорія полімолекулярної адсорбції бет
- •Адсорбція газів на пористих тілах
- •Класифікація пористих тіл
- •Теорія капілярної конденсації
- •Теорія об’ємного заповнення мікропор
- •Адсорбція на межі тверде тіло – рідкий розчин.
- •Молекулярна адсорбція
- •Іонна адсорбція
- •Адсорбція поверхнево активних речовин з розчину на межі рідина – газ
- •Контрольні питання.
- •Електричні явища на поверхні
- •Поняття про електрокінетичні явища
- •Механізм утворення подвійного електричного шару
- •Термодинамічні співвідношення між поверхневим натягом і електричним потенціалом
- •Теорії будови подвійного електричного шару.
- •Теорія Гельмгольца Перрена.
- •Теорія Гуї - Чепмена
- •Теорія Штерна.
- •Вплив електролітів на подвійний електричний шар.
- •Вплив індиферентних електролітів на подвійний електричний шар.
- •Вплив неіндиферентних (родинних) електролітів
- •Експериментальне визначення електрокінетичного потенціалу
- •Контрольні питання.
- •Методи одержання та очистки колоїдних систем
- •Диспергаційні методи
- •Конденсаційні методи
- •Термодинаміка утворення нової фази при конденсації.
- •Кінетика утворення нової фази
- •Будова міцел
- •Методи очистки колоїдних розчинів
- •Контрольні питання.
- •Агрегативна стійкість дисперсних систем.
- •Фактори агрегативної стійкості ліофобних дисперсних систем.
- •Ізотермічна перегонка в дисперсних системах.
- •Коагуляція.
- •Теорія стійкості дисперсних систем Дєрягіна, Ландау Фервея і Овербека
- •Кінетика коагуляції
- •Контрольні питання
- •Властивості дисперсних систем
- •Молекулярно – кінетичні властивості дисперсних систем
- •Броунівський рух
- •Дифузія.
- •Седиментація та седиментаційна стійкість.
- •Седиментаційний аналіз дисперсності.
- •Оптичні властивості дисперсних систем.
- •Розсіювання світла.
- •Абсорбція світла.
- •Оптичні методи дослідження дисперсних систем.
- •Структурно-механічні властивості дисперсних систем.
- •Реологічних моделі тіл.
- •Розчини поверхнево – активних речовин.
- •Класифікація пар.
- •Міцели пар.
- •Розчини високомолекулярних сполук
- •Утворення і властивості вмс
- •Взаємодія вмс з розчинниками.
- •Молекулярна маса вмс
- •ГрубоДисперсні системи.
- •Суспензії
- •Емульсії.
- •Класифікація та властивості емульсій.
- •Одержання та руйнування емульсій.
- •Основні характеристики та властивості пін.
- •Одержання та руйнування пін.
- •Аерозолі
- •Класифікація та властивості аерозолів
- •Методи одержання та практичне значення аерозолів
- •Порошки
- •Список літератури
Вплив дисперсності на розчинність твердих тіл
Додаткова зміна енергії Гіббса пов’язана з дисперсністю дорівнює:
![]() ,
( 3.0)
,
( 3.0)
де x - розчинність дрібних частинок
x∞- розчинність крупної фази.
![]() (
3.0)
(
3.0)
Із зменшенням радіуса частинок , зростає їх розчинність.
Якщо частинку неправильної форми занурити у насичений розчин, то ділянки з додатною кривизною будуть розчинятися, з від`ємною – нарощуватися. У результаті частинка набуде форми, що відповідає рівноважному стану.
Приклад 3.10
Обчисліть міжфазний натяг в системі CaF2 – вода, якщо розчинність частинок CaF2 діаметром 0,3 мкм перевищує розчинність крупних кристалів на 18%(мас) при температурі 293 К. Густина CaF2 2,5 г/см3.
![]()
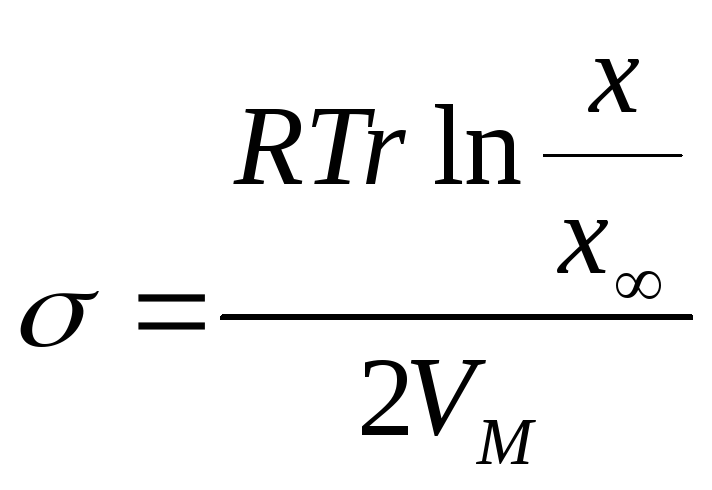 VM
= M/
VM
= M/
(8,314∙293∙0,3∙10-6∙2,5∙103∙ln(1,18))/(2∙78,08∙10-3) = 1,94 Дж/м2
Вплив дисперсності на рівновагу хімічних реакцій
Ступінь дисперсності впливає і на рівновагу в хімічних реакціях:
![]() (
3.0)
(
3.0)
Go – додаткова реакційна здатність.
К - константа рівноваги для подрібнених частинок.
К∞- константа рівноваги для крупних частинок.
Зі збільшенням дисперсності збільшується активність компонентів.
Наприклад для реакції
CaCO3 = CaO + CO2
зі зростанням подрібненості СаСО3, рівновага в реакції зсувається вправо, а збільшення дисперсностіСаОприводить до зсуву рівноваги в реакції вліво.
Контрольні питання:
Якими параметрами характеризується ступінь подрібнення речовини і який зв’язок між цими параметрами?
Дайте означення поняття “питома поверхня”. В яких одиницях вона вимірюється і як пов’язана з дисперсністю?
Як впливає кривизна поверхні і природа рідини на її внутрішній тиск?
Що відбудеться з двома мильними бульбашками різних розмірів, якщо їх з’єднати трубочкою?
Яке рівняння слід використати для визначення тиску в сферичній дощовій краплині? Порівняйте цей тиск з тиском в об’ємі води.
Якими причинами зумовлено підняття (опускання) рідини в капілярах?
Чому в капілярах пара конденсується при більш низькому тиску, ніж на пласкій поверхні?
Як залежить температура агрегатного перетворення від дисперсності конденсованої фази?
Наведіть та проаналізуйте рівняння залежності тиску насиченої пари рідини від ступеня викривлення її поверхні.
Як впливає дисперсність речовини на розчинність та реакційну здатність речовин?
Що буде відбуватися з твердими частинками неправильної форми в ненасиченому розчині?
З якою метою землероби в посуху подрібнюють верхній шар ґрунту?
Адсорбційні рівноваги.
Основні поняття та визначення.
Адсорбція - це самочинний нерівноважний процес перерозподілу компонентів системи між поверхневим шаром та об’ємною фазою. При цьому відбувається концентрування (накопичення) газу чи розчиненої речовини на межі розподілу фаз. Речовина, що адсорбується, називається адсорбатом, а рідина чи тверде тіло, що адсорбує їх -адсорбентом.
Адсорбцію не слід плутати з поняттям «абсорбція», що відповідає процесу поглинання речовини в об’ємі другої речовини.
Внаслідок теплового руху одночасно з адсорбцією відбувається зворотній процес - десорбція.
Кількісно адсорбція може бути виражена:
1.Адсорбція«А»- це кількість адсорбату віднесеного до одиниці маси адсорбенту, [моль/кг], або до одиниці площі поверхні адсорбенту [моль/м2].
2.Адсорбція за Гіббсом«Г»,- це різниця між кількістю молів адсорбату в поверхневому шарі (nS) та кількістю його молів в шарі об’єму розчину такої ж товщини (nV), віднесена до одиниці площі міжфазної поверхні [моль/м2].
Г = (nS – nV)/S ( 4.0)
Якщо концентрація адсорбату в поверхневому шарі більша за об’ємну, адсорбцію Гвважають додатною, а якщо навпаки - від’ємною.
Залежності величини адсорбції від рівноважного тиску (або концентрації) адсорбату при сталій температурі: a=f(p) та a=f(c)називають ізотермами адсорбції.
