
- •Предмет колоїдної хімії
- •Класифікація колоїдних систем
- •Класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища.
- •Контрольні питання:
- •Поверхневі явища та їх класифікація
- •Класифікація поверхневих явищ
- •Поверхневий натяг
- •Поверхневий натяг деяких речовин на межі з повітрям при 298к.
- •Методи визначення поверхневого натягу
- •Метод капілярного підняття (метод Жюрена).
- •Метод максимального тиску в бульбашці (метод Ребіндера)
- •Сталометричний метод (метод Траубе)
- •Внутрішня (повна) питома поверхнева енергія. Залежність енергетичних параметрів поверхні від температури
- •Принципи формування поверхневого шару
- •Поверхневий натяг органічних речовин на межі з повітрям при 298к.
- •Адгезія, когезія
- •Змочування і розтікання
- •Розтікання рідин. Ефект Марангоні
- •Контрольні питання:
- •Дисперсність і властивості тіл
- •Характеристика величини і форми поверхні
- •Зміна питомої поверхні при подрібненні речовини.
- •Вплив дисперсності на внутрішній тиск
- •Капілярні явища
- •Дисперсність і реакційна здатність речовин
- •Тиск насиченої пари над викривленою поверхнею
- •Вплив дисперсності на температуру фазового переходу
- •Залежність температури топлення калію і срібла від дисперсності.
- •Вплив дисперсності на розчинність твердих тіл
- •Вплив дисперсності на рівновагу хімічних реакцій
- •Контрольні питання:
- •Адсорбційні рівноваги.
- •Основні поняття та визначення.
- •Природа адсорбційних сил
- •Фундаментальне рівняння адсорбції Гіббса
- •Теплота адсорбції.
- •Швидкість фізичної адсорбції
- •Адсорбція газів на однорідній твердій поверхні.
- •Ізотерма адсорбції (закон) Генрі
- •Теорія адсорбції Ленгмюра
- •Теорія полімолекулярної адсорбції бет
- •Адсорбція газів на пористих тілах
- •Класифікація пористих тіл
- •Теорія капілярної конденсації
- •Теорія об’ємного заповнення мікропор
- •Адсорбція на межі тверде тіло – рідкий розчин.
- •Молекулярна адсорбція
- •Іонна адсорбція
- •Адсорбція поверхнево активних речовин з розчину на межі рідина – газ
- •Контрольні питання.
- •Електричні явища на поверхні
- •Поняття про електрокінетичні явища
- •Механізм утворення подвійного електричного шару
- •Термодинамічні співвідношення між поверхневим натягом і електричним потенціалом
- •Теорії будови подвійного електричного шару.
- •Теорія Гельмгольца Перрена.
- •Теорія Гуї - Чепмена
- •Теорія Штерна.
- •Вплив електролітів на подвійний електричний шар.
- •Вплив індиферентних електролітів на подвійний електричний шар.
- •Вплив неіндиферентних (родинних) електролітів
- •Експериментальне визначення електрокінетичного потенціалу
- •Контрольні питання.
- •Методи одержання та очистки колоїдних систем
- •Диспергаційні методи
- •Конденсаційні методи
- •Термодинаміка утворення нової фази при конденсації.
- •Кінетика утворення нової фази
- •Будова міцел
- •Методи очистки колоїдних розчинів
- •Контрольні питання.
- •Агрегативна стійкість дисперсних систем.
- •Фактори агрегативної стійкості ліофобних дисперсних систем.
- •Ізотермічна перегонка в дисперсних системах.
- •Коагуляція.
- •Теорія стійкості дисперсних систем Дєрягіна, Ландау Фервея і Овербека
- •Кінетика коагуляції
- •Контрольні питання
- •Властивості дисперсних систем
- •Молекулярно – кінетичні властивості дисперсних систем
- •Броунівський рух
- •Дифузія.
- •Седиментація та седиментаційна стійкість.
- •Седиментаційний аналіз дисперсності.
- •Оптичні властивості дисперсних систем.
- •Розсіювання світла.
- •Абсорбція світла.
- •Оптичні методи дослідження дисперсних систем.
- •Структурно-механічні властивості дисперсних систем.
- •Реологічних моделі тіл.
- •Розчини поверхнево – активних речовин.
- •Класифікація пар.
- •Міцели пар.
- •Розчини високомолекулярних сполук
- •Утворення і властивості вмс
- •Взаємодія вмс з розчинниками.
- •Молекулярна маса вмс
- •ГрубоДисперсні системи.
- •Суспензії
- •Емульсії.
- •Класифікація та властивості емульсій.
- •Одержання та руйнування емульсій.
- •Основні характеристики та властивості пін.
- •Одержання та руйнування пін.
- •Аерозолі
- •Класифікація та властивості аерозолів
- •Методи одержання та практичне значення аерозолів
- •Порошки
- •Список літератури
РОЗДІЛ 1. ВСТУП 6
1.1. Предмет колоїдної хімії 6
1.2. Класифікація колоїдних систем 8
РОЗДІЛ 2. ПОВЕРХНЕВІ ЯВИЩА ТА ЇХ КЛАСИФІКАЦІЯ 11
2.1. Класифікація поверхневих явищ 11
2.2. Поверхневий натяг 12
2.3. Методи визначення поверхневого натягу 13
2.3.1. Метод капілярного підняття (метод Жюрена). 13
2.3.2. Метод максимального тиску в бульбашці (метод Ребіндера) 14
2.3.3. Сталометричний метод (метод Траубе) 15
2.4. Внутрішня (повна) питома поверхнева енергія. Залежність енергетичних параметрів поверхні від температури 16
2.5. Принципи формування поверхневого шару 17
2.6. Адгезія, когезія 19
2.7. Змочування і розтікання 20
2.8. Розтікання рідин. Ефект Марангоні 22
РОЗДІЛ 3. Дисперсність і властивості тіл 25
3.1. Характеристика величини і форми поверхні 25
3.2. Вплив дисперсності на внутрішній тиск 26
3.3. Капілярні явища 27
3.4. Дисперсність і реакційна здатність речовин 29
3.5. Тиск насиченої пари над викривленою поверхнею 30
3.6. Вплив дисперсності на температуру фазового переходу 31
3.7. Вплив дисперсності на розчинність твердих тіл 31
3.8. Вплив дисперсності на рівновагу хімічних реакцій 32
РОЗДІЛ 4. АДСОРБЦІЙНІ РІВНОВАГИ. 34
4.1. Основні поняття та визначення. 34
4.1.1. Природа адсорбційних сил 34
4.1.2. Фундаментальне рівняння адсорбції Гіббса 37
4.1.3. Теплота адсорбції. 39
4.1.4. Швидкість фізичної адсорбції 40
4.2. Адсорбція газів на однорідній твердій поверхні. 41
4.2.1. Ізотерма адсорбції (закон) Генрі 41
4.2.2. Теорія адсорбції Ленгмюра 42
4.2.3. Теорія полімолекулярної адсорбції БЕТ 46
4.3. Адсорбція газів на пористих тілах 51
4.3.1. Класифікація пористих тіл 51
4.3.2. Теорія капілярної конденсації 52
4.3.3. Теорія об’ємного заповнення мікропор 56
4.4. Адсорбція на межі тверде тіло – рідкий розчин. 59
4.4.1. Молекулярна адсорбція 60
4.4.2. Іонна адсорбція 60
4.5. Адсорбція поверхнево активних речовин з розчину на межі рідина – газ 62
РОЗДІЛ 5. Електричні явища на поверхні 68
5.1. Поняття про електрокінетичні явища 68
5.2. Механізм утворення подвійного електричного шару 69
5.3. Термодинамічні співвідношення між поверхневим натягом і електричним потенціалом 70
5.4. Теорії будови подвійного електричного шару. 72
5.4.1. Теорія Гельмгольца Перрена. 72
5.4.2. Теорія Гуї - Чепмена 73
5.4.3. Теорія Штерна. 77
5.5. Вплив електролітів на подвійний електричний шар. 80
5.5.1. Вплив індиферентних електролітів на подвійний електричний шар. 80
5.5.2. Вплив неіндиферентних (родинних) електролітів 81
5.6. Експериментальне визначення електрокінетичного потенціалу 82
РОЗДІЛ 6. МЕТОДИ ОДЕРЖАННЯ ТА ОЧИСТКИ КОЛОЇДНИХ СИСТЕМ 87
6.1. Диспергаційні методи 87
6.2. Конденсаційні методи 88
6.2.1. Термодинаміка утворення нової фази при конденсації. 88
6.2.2. Кінетика утворення нової фази 91
6.3. Будова міцел 93
6.4. Методи очистки колоїдних розчинів 96
РОЗДІЛ 7. Агрегативна стійкість дисперсних систем. 100
7.1. Фактори агрегативної стійкості ліофобних дисперсних систем. 100
7.2. Ізотермічна перегонка в дисперсних системах. 101
7.3. Коагуляція. 103
7.3.1. Теорія стійкості дисперсних систем Дєрягіна, Ландау Фервея і Овербека 103
7.3.2. Кінетика коагуляції 109
РОЗДІЛ 8. Властивості дисперсних систем 113
8.1. Молекулярно – кінетичні властивості дисперсних систем 113
8.1.1. Броунівський рух 113
8.1.2. Дифузія. 114
8.1.3. Седиментація та седиментаційна стійкість. 116
8.1.4. Седиментаційний аналіз дисперсності. 117
8.2. Оптичні властивості дисперсних систем. 120
8.2.1. Розсіювання світла. 120
8.2.2. Абсорбція світла. 123
8.2.3. Оптичні методи дослідження дисперсних систем. 123
8.3. Структурно-механічні властивості дисперсних систем. 125
8.3.1. Реологічних моделі тіл. 128
РОЗДІЛ 9. Розчини поверхнево – активних речовин. 131
9.1. Класифікація ПАР. 131
9.2. Міцели ПАР. 132
РОЗДІЛ 10. РОЗЧИНИ ВИСОКОМОЛЕКУЛЯРНИХ СПОЛУК 134
10.1. Утворення і властивості ВМС 134
10.2. Взаємодія ВМС з розчинниками. 135
10.3. Молекулярна маса ВМС 138
РОЗДІЛ 11. грубоДИСПЕРСНІ СИСТЕМИ. 141
11.1. Суспензії 141
11.2. Емульсії. 142
11.2.1. Класифікація та властивості емульсій. 142
11.2.2. Одержання та руйнування емульсій. 143
11.3. Піни. 144
11.3.1. Основні характеристики та властивості пін. 144
11.3.2. Одержання та руйнування пін. 145
11.4. Аерозолі 145
11.4.1. Класифікація та властивості аерозолів 146
11.4.2. Методи одержання та практичне значення аерозолів 147
11.5. Порошки 148
РОЗДІЛ 12. Список літератури 151
Сталі:
NA = 6,023∙1023 1/моль;
R = 8,314 Дж/моль∙К;
F = 96500 Кл/моль;
0 = 8,85∙10-12
Умовні позначення
- поверхневий натяг;
S – площа поверхні;
S – ентропія;
- хімічний потенціал;
- електричний потенціал;
W –робота;
H – ентальпія;
U – енергія;
G – енергія Гіббса;
T – температура;
p – тиск;
ps – тиск насиченої пари;
c – концентрація;
V – об’єм;
VМ – мольний об’єм;
m – маса;
- кут змочування;
- густина;
H – кривизна поверхні;
a- активність;
- коефіцієнт активності;
A- адсорбція;
Г- адсорбція за Гіббсом;
Q – теплота;
– час.
Від авторів
Структура посібника є традиційною і відповідає програмі курсу “Поверхневі явища та дисперсні системи” для студентів базового напряму “Хімічна технологія та інженерія”. Посібник може бути використаний також для вивчення курсу “Колоїдна хімія” студентами інших базових напрямів.
Для більш глибокого засвоєння студентами фізико-хімічних закономірностей явищ, що вивчаються, в кінці деяких параграфів наведені приклади. Також в кінці кожного розділу наведені контрольні питання та умови задач з відповідями, які можуть бути корисними для самоконтролю при самостійній роботі студента.
Термінологія і означенні фізико-хімічних величин приведені у відповідність з номенклатурними правилами IUPAC з хімії.
Передмова
ВСТУП
Предмет колоїдної хімії
Колоїдна хімія вивчає дисперсні системи та поверхневі явища, що виникають на границі розділу фаз. Засновником колоїдної хімії прийнято вважати Т. Грема, який виконав в 60-х роках ХІХ ст. перші систематичні дослідження колоїдних систем (золів). Надалі колоїдна хімія включила в себе результати, одержані в інших галузях фізики та хімії, і в кінці ХІХ – початку ХХ ст. сформувалась в самостійний розділ хімії.
На основі механічної теорії капілярності, розробленої на поч. ХІХ ст. Т. Юнгом і П. Лапласом, і термодинаміки поверхневих явищ, створеної Дж. Гіббсом в 1878 р., були сформульовані основні напрямки досліджень колоїдної хімії: вивчення процесів утворення нової фази в гомогенних системах, термодинамічної стійкості колоїдних систем, кількісний опис адсорбції на границі розділу фаз. Розвинуті в 1853 р. Г. Гельмгольцем уявлення про будову подвійного електричного шару дозволили дати пояснення електрокінетичним та електрокапілярним явищам. Створення Дж. Релєєм теорії розсіяння світла сприяло кількісному вивченню оптичних властивостей колоїдних систем. Дослідження Ж. Перреном, Т. Сведбергом та Р. Зигмонді броунівського руху колоїдних частинок на основі теорії, розробленої в 1905 р. А. Ейнштейном та М. Смолуховським, дозволило довести реальність існування молекул і справедливість молекулярно-кінетичних уявлень. На основі запропонованої в 1917 р. І. Ленгмюром кінетичної теорії адсорбції були розроблені методи дослідження стану молекул поверхнево-активних речовин в мономолекулярних шарах. В 1928 р. П.А. Ребіндер відкрив явище адсорбційного пониження міцності твердих тіл і в 40-50 рр. на основі розвитку цього напрямку і досліджень структуроутворення в дисперсних системах створив фізико-хімічну механіку. Фізична теорія стійкості колоїдних систем була розроблена в 1937 р. Б.В. Дерягіним разом з Л.Д. Ландау і незалежно від них Е. Фервеєм та Я. Овербеком (теорія ДЛФО). Б.В. Дерягіним також введено поняття про розклинювальний тиск в тонких шарах рідин.
Основні напрями сучасної колоїдної хімії: термодинаміка поверхневих явищ, дослідження адсорбції поверхнево-активних речовин, утворення і стійкості дисперсних систем, їх молекулярно-кінетичні, оптичні і електричні властивості; фізико-хімічна механіка дисперсних структур; розробка теорії механізмів процесів, що відбуваються в дисперсних системах під впливом поверхнево-активних речовин, електричних зарядів, механічної дії тощо.
У зв’язку з тим, що дисперсний стан речовини є універсальним і об’єкти вивчення колоїдної хімії надзвичайно розмаїті, колоїдна хімія тісно пов’язана з фізикою, біологією, геологією, ґрунтознавством, медициною тощо. Різні дисперсні системи (порошки, емульсії, пасти, піни, аерозолі) широко застосовуються в промисловості і сільському господарстві, тому колоїдна хімія є науковою основою багатьох виробництв і технологічних процесів. Серед засобів, які використовуються для керування цими процесами, найбільш дієвим і універсальним є використання поверхнево-активних речовин; останні також широко застосовуються для регулювання поверхневих взаємодій – змочування, миючої дії, мастильної дії, адгезії тощо.
Колоїдна хімія розглядає механізми ряду природничих явищ, таких як утворення і руйнування хмар, утворення осадкових порід, руйнування і вивітрювання гірських порід, іонного обміну в ґрунтах, вітрова та водна ерозія ґрунтів. Колоїдна хімія досліджує процеси, які відбуваються на межі розділу фаз в живих організмах рослинного та тваринного світу, у тому числі в біомембранах; виявляє роль поверхневої активності та її зв’язок з фізіологічною активністю білків, ліпідів тощо.
В останні роки широке розповсюдження здобули, так звані, нанотехнології, в основі яких покладено використання речовин, ступінь дисперсності яких хоча би в одному вимірі сягає 10-9 м., тобто це типові об’єкти колоїдної хімії.
Колоїдна хімія - це наука про поверхневі явища і дисперсні системи.
Поверхневі явища - процеси, які відбуваються на поверхні розділу фаз в міжфазному поверхневому шарі, як результат взаємодії цих фаз.
Сукупність дисперсних (подрібнених) тіл та середовища, в якому вони знаходяться, називають дисперсною системою. Фаза, подрібнена і розподілена в дисперсійному середовищі, називається дисперсною фазою, а суцільна фаза, в якій знаходиться дисперсна фаза називаєтьсядисперсійним середовищем. (рис.1,а)
Основні ознаки об’єктів колоїдної хімії – це гетерогенністьідисперсність.
Гетерогенність – це наявність в системі як мінімум двох фаз, що забезпечує утворення міжфазної поверхні.
Дисперсність - це характеристика розмірів частинок дисперсної фази в дисперсній системі.
Всередині будь-якої гомогенної системи молекули утворюють між собою міжмолекулярні зв’язки (рис.1,б). Молекули, що знаходяться на поверхні мають частково некомпенсовані зв’язки, які певним чином впливають на їх властивості, що відрізняються від властивостей молекул, що знаходяться всередині системи.
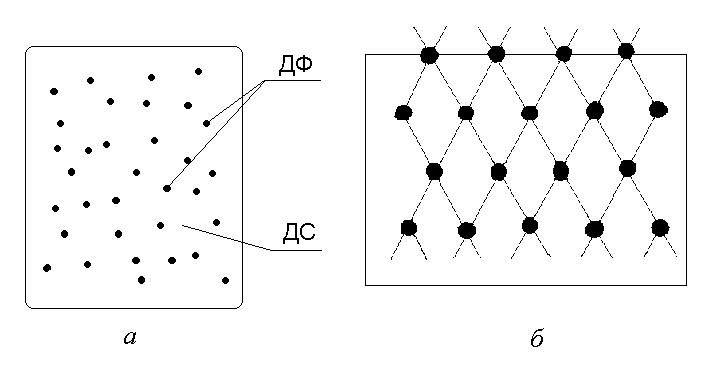
Рис. 1. Структура дисперсної (а) та гомогенної (б) систем.
Ці некомпенсовані зв’язки зумовлюють наявність надлишкової вільної енергії на поверхні, яку називають вільною поверхневою енергією. Завдяки цій енергії відбуваються процеси, які називають поверхневими явищами.
Доведено, що під впливом поверхневої енергії знаходяться до шести шарів молекул вглиб від поверхні, а це приблизно 3000-10000 нм (3·10-6- 1·10-5м). Натомість найменша частинка, що може вважатися окремою фазою згідно молекулярно-кінетичної теорії складається з 20-30 молекул, крім високомолекулярних сполук (ВМС), розмір такої частинки 1-5 нм.
Отже колоїдні системи, це дисперсні системи з розмірами частинок дисперсної фази від 1 до 10000 нм (1·10-9до 1·10-5м).
