
- •Лабораторний практикум
- •Лабораторна робота №1
- •Теоретичні відомості
- •Класифікація дисперсних систем за агрегатним станом
- •Завдання
- •Питання для самопідготовки.
- •Лабораторна робота №2
- •Теоретичні відомості
- •Властивості емульсій
- •Завдання
- •Склад емульсії
- •Характеристики емульсії
- •Вплив електроліту на характеристики емульсії
- •3. Одержання піни методом струшування розчину піноутворювача в циліндрі.
- •Вплив концентрації піноутворювача на рівень піни h
- •4. Одержання піни методом продуву повітря через розчин піноутворювача.
- •Питання для самопідготовки.
- •Лабораторна робота №3
- •Теоретичні відомості
- •Статистичні методи
- •Динамічні методи
- •Завдання
- •Питання для самопідготовки
- •Лабораторна робота №4
- •Коагуляція і стабілізація дисперсних систем.
- •Теоретичні відомості
- •Правила коагуляції
- •Завдання
- •2. Визначення порога коагуляції.
- •Розчини Na2so4 або ch3cooNa
- •Оптична густина золю, d в залежності від об’єму електроліту
- •Захисний об’єм розчину желатину
- •Питання для самопідготовки
- •Тверде тіло – розчин.
- •Теоретичні відомості
- •Завдання
- •І. Ваговий метод
- •Іі. Визначення концентрації крохмалю в розчині.
- •Ііі. Визначення концентрації полімеру в розчині віскозиметричним методом
- •Питання для самопідготовки
- •Лабораторна робота №6
- •Теоретичні відомості
- •Завдання
- •Результати обробки даних седиментаційного аналізу за «методом дотичних»
- •Результати обробки даних седиментаційного аналізу аналітичним методом
- •Питання для самопідготовки
- •Література
Теоретичні відомості
Стійкість – це здатність системи певний час зберігати незмінною свою структуру, тобто розміри частинок та їх рівномірний розподіл в об’ємі системи.
Розмежовують стійкість седиментаційну (кінетику) і агрегативну. Ці два види стійкості різняться за своїм механізмом і вимагають різних підходів до розглядання.
Седиментаційна стійкість – це здатність дисперсної системи зберігати незмінним у часі розподіл частинок в об’ємі системи, тобто здатність системи протидіяти силі тяжіння.
Седиментаційна стійкість визначається головним чином розмірами частинок дисперсної фази:
ліофобні золі (10-5...10-7) – стійкі, для них властива дифузія, яка забезпечує рівномірний розподіл частинок в об’ємі:
потік
седиментації ісед<<
ідиф,
тобто
![]() <<1;
<<1;
мікрогетерогенні системи (від 0,1 до 10мкм) – встановлюється седиментаційно-дифузійна рівновага. Ці системи стійкі, але в них розподіл частинок не рівномірний, а рівноважний; тобто потік седиментації ісед дорівнює потоку дифузії ідиф:
 ≈1,
або ісед≈
ідиф;
≈1,
або ісед≈
ідиф;грубодисперсні системи (>10-3см) – седиментаційно нестійкі, має місце швидка седиментація:
 >>1;
тобто ісед>>
ідиф.
>>1;
тобто ісед>>
ідиф.
Агрегативна стійкість – це здатність системи зберігати незмінним у часі ступінь дисперсності частинок, тобто їх розміри.
При порушені агрегативної стійкості має місце коагуляція. Коагуляцією називається процес злипання частинок з утворенням крупних агрегатів. В результаті коагуляції система втрачає седиментаційну стійкість. Коагуляція - процес довільний, він призводить до зменшення вільної поверхневої енергії.
На коагуляцію впливають:
зміни температури;
дія електричних і електромагнітних полей;
дія світла;
механічна дія;
електроліти та ін.
В основі дії різних факторів на коагуляцію лежить один механізм – зниження енергетичного бар’єру, який перешкоджає коагуляції.
Найбільший практичний інтерес має дія електролітів.
Правила коагуляції
Усі сильні електроліти викликають коагуляцію. Мінімальна концентрація електроліту, при якій починається коагуляція, називається порогом коагуляції. Чим менше поріг коагуляції, тим більша коагулююча здатність електроліту.
Коагулюючою дією володіє не весь електроліт, а тільки іон, знак якого співпадає зі знаком противоіону міцели ліофобного золю, його називають іон – коагулянт.
Коагулююча здатність іона – коагулянту тим більше, чим більше заряд іона.
Ця закономірність кількісно описується правилом Шульце-Гарді:
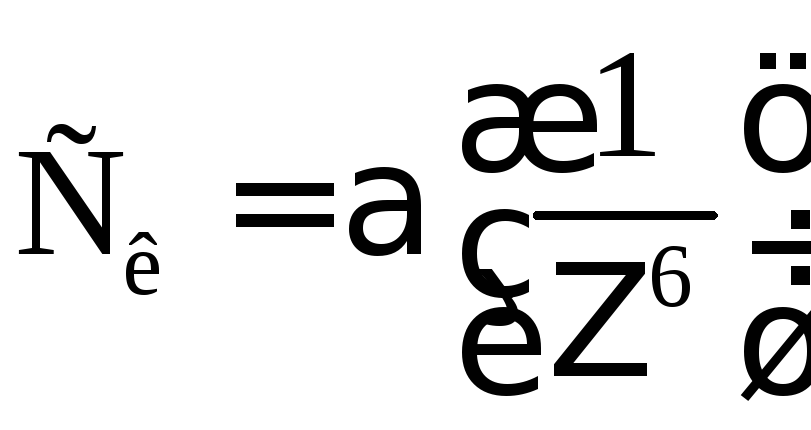 (4.1),
(4.1),
де Ск – концентрація електроліту (поріг коагуляції),
α – постійна для даної системи,
Ζ – заряд іона коагулянту.
4. При однаковій зарядності іонів, їх дія знижується із збільшенням ступеня гідратації. Під дією електроліту може виникнути концентраційна або нейтралізаційна коагуляція.
Концентраційна коагуляція виникає під дією інденферентного електроліту внаслідок стиску дифузного шару противоіонів і зменшення ζ-потенціалу.
Нейтралізаційна коагуляція виникає при введені неінденферентного електроліту, який зв’язує потенціаловизначаючі іони, що веде до зменшення абсолютних величин термодинамічного і електрокінетичного потенціалу.
При дії на золь суміші електролітів виникають три випадки:
адитивна дія (електроліти діють незалежно);
синергізм дії (посилення дії);
антагонізм дії (ослаблення дії одного електроліту іншим).
Теорія стійкості золів розглядає процес коагуляції як результат одночасної дії між частинками сил Ван-дер-Ваальса і сил відштовхування. В залежності від їх співвідношення між частинами виникає позитивний розклінюючий тиск, який протидіє їх з’єднанню, або негативний, який приводить до коагуляції.
Теорія дозволила розрахувати молекулярну і електрокінетичну складові розклінів тиску та побудувати криві потенційної енергії системи в залежності від відстані між частинками.
Потенціальний бар’єр і потенціальні ями визначають агрегативну стійкість і можливість коагуляції золів.
Щоб запобігти агрегації золів та захистити їх від коагулюючої дії електролітів, використовують розчини високомолекулярних сполук (ВМС) та колоїдних поверхнево-активних речовин (ПАР). Цей процес запобігання коагуляції називається колоїдним захистом золів. Стабілізуюча дія ВМС та ПАР ґрунтується на утворенні на поверхні частинок дисперсної фази адсорбційних желеподібних плівок, що приводить як до зменшення міжфазного натягу, так і до виникнення структурно-механічного поверхневого шару.
Захисна здатність полімерів або ПАР відносно вибраного золю визначається захисним числом S – кількістю речовини, яка необхідна для стабілізації одиниці об’єму золю. Захисне число розраховують за формулою:
 ,
г/л золю (4.2)
,
г/л золю (4.2)
де Ссm – концентрація розчину стабілізатора, г/л;
Vзах – об’єм розчину стабілізатора, який потрібен для попередження коагуляції золю, мл;
V – об’єм золю, мл.
Поріг коагуляції та захисне число можна визначити методом турбідиметрії.
