
- •Лабораторний практикум
- •Лабораторна робота №1
- •Теоретичні відомості
- •Класифікація дисперсних систем за агрегатним станом
- •Завдання
- •Питання для самопідготовки.
- •Лабораторна робота №2
- •Теоретичні відомості
- •Властивості емульсій
- •Завдання
- •Склад емульсії
- •Характеристики емульсії
- •Вплив електроліту на характеристики емульсії
- •3. Одержання піни методом струшування розчину піноутворювача в циліндрі.
- •Вплив концентрації піноутворювача на рівень піни h
- •4. Одержання піни методом продуву повітря через розчин піноутворювача.
- •Питання для самопідготовки.
- •Лабораторна робота №3
- •Теоретичні відомості
- •Статистичні методи
- •Динамічні методи
- •Завдання
- •Питання для самопідготовки
- •Лабораторна робота №4
- •Коагуляція і стабілізація дисперсних систем.
- •Теоретичні відомості
- •Правила коагуляції
- •Завдання
- •2. Визначення порога коагуляції.
- •Розчини Na2so4 або ch3cooNa
- •Оптична густина золю, d в залежності від об’єму електроліту
- •Захисний об’єм розчину желатину
- •Питання для самопідготовки
- •Тверде тіло – розчин.
- •Теоретичні відомості
- •Завдання
- •І. Ваговий метод
- •Іі. Визначення концентрації крохмалю в розчині.
- •Ііі. Визначення концентрації полімеру в розчині віскозиметричним методом
- •Питання для самопідготовки
- •Лабораторна робота №6
- •Теоретичні відомості
- •Завдання
- •Результати обробки даних седиментаційного аналізу за «методом дотичних»
- •Результати обробки даних седиментаційного аналізу аналітичним методом
- •Питання для самопідготовки
- •Література
Завдання
І. Визначити поріг коагуляції золю Fe(OH)3.
Одержання гідрозолю Fe(OH)3.
У колбу 250мл з киплячою дистильованої водю додати 10мл 2% розчину FeCl3
FeCl3 + 3H2O → Fe(OH)3↓ + 3HCl
Червоно-коричневий золь, який утворився, охолодити до кімнатної температури. На світлі золь повинен виглядати абсолютно прозорим.
2. Визначення порога коагуляції.
У 10 колб налити піпеткою води та електроліту (розчини Na2SO4 0,03М, або CH3COONa 0,03М), як вказано в табл. 4.1. Потім в усі колби додають по 10мл золю. Вміст колб перемішують струшуванням, записують час початку досліду
Таблиця 4.1
Розчини Na2so4 або ch3cooNa
|
№ колби |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Vводи, мл |
10,0 |
9,0 |
8,5 |
8,0 |
7,5 |
7,0 |
6,5 |
6,0 |
5,5 |
5,0 |
|
Vелектроліту, мл |
0 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
4,5 |
5,0 |
|
Vзолю, мл |
10,0 |
10,0 |
10,0 |
10,0 |
10,0 |
10,0 |
10,0 |
10,0 |
10,0 |
10,0 |
Одночасно з робочими розчинами в 11-ій колбі ставлять контрольний (холостий) дослід, в першій колбі – стандартний (еталонний) дослід. Через те, що коагуляція проходить у часі, електроліт треба додавати послідовно, так, щоб час між введенням електроліту та вимірюванням оптичної густини, становив 3 хв. для Na2SO4 та 7-8 хв. для CH3COONa. Ознакою коагуляції є помутніння досліджуваного розчину порівняно з еталонним, що особливо помітно при проходженні світла.
3. Визначити оптичну густину D золю
На фотоелектрокалориметрі при світофільтрах №8 або №9 (λ = 620...625 нм) в кюветі 10мм послідовно визначають оптичну густину розчинів проти контролю. Одержанні данні занести в таблицю 4.2.
Таблиця 4.2
Оптична густина золю, d в залежності від об’єму електроліту
|
№ колби |
Обєм електроліту, мл |
Оптична густина золю, D | |
|
Електроліт Na2SO4 |
Електроліт CH3COONa | ||
|
1 |
|
|
|
|
2 |
|
|
|
|
3 |
|
|
|
|
4 |
|
|
|
|
5 |
|
|
|
|
6 |
|
|
|
|
7 |
|
|
|
|
8 |
|
|
|
|
9 |
|
|
|
|
10 |
|
|
|
Побудувати графік залежності D = f(Vелектроліту).
Знайти пороговий об’єм електроліту Vk, який викликає швидку коагуляцію золю, та розрахувати поріг коагуляції за формулою:
 (4.3)
(4.3)
де Сел – концентрація розчину електроліту, що викликає коагуляцію;
V – об’єм золю (20мл).
ІІ. Визначити захисне число полімеру (желатину) відносно золю Fe(OH)3.
Приготувати у 10 колбах розчини загальним об’ємом 20мл.
Таблиця 4.3
Захисний об’єм розчину желатину
|
№ колби |
Об’єм розчину желатину, мл Vж |
Об’єм води, мл Vвода |
Оптична густина золю, D |
|
1 |
5,0 |
|
|
|
2 |
4,0 |
|
|
|
3 |
3,5 |
|
|
|
4 |
3,0 |
|
|
|
5 |
2,5 |
|
|
|
6 |
2,0 |
|
|
|
7 |
1,5 |
|
|
|
8 |
1,0 |
|
|
|
9 |
0,5 |
|
|
|
10 |
0 |
|
|
Спочатку у кожну колбу додати по 10мл вихідного розчину золю Fe(OH)3, розчин желатину з таблиці 4.3, води об’ємом (Vвода = 10 – Vж – Vк), де Vк - пороговий об’єм електроліту, Vж – об’єм желатину.
2. Через 5 – 10 хвилин після додавання електроліту визначити оптичну густину розчинів та занести значення у табл. 4.3.
3. Побудувати графік залежності D = f(Vж), знайти захисний об’єм розчину желатину Vзах та розрахувати захисне число
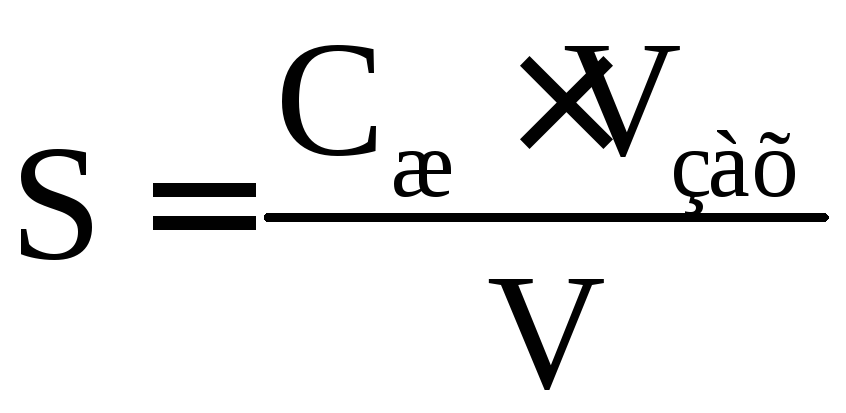 ,
(4.4)
,
(4.4)
(Vзах = 20мл)
