
- •М.Ф. Жоровков
- •Расчет диаграмм состояния бинарных систем в приближении регулярных растворов Учебное пособие
- •Томск-2001
- •Введение
- •Часть I . Равновесие
- •1.Термодинамические параметры
- •3.Отличительные признаки фаз
- •4.Функции состояния
- •5. Понятие о диаграмме состояния
- •6. Равновесие фаз
- •6.1.Термическое равновесие
- •6.2. Механическое равновесие
- •6.3.Собственно фазовое равновесие
- •7. Простейшие диаграммы состояния бинарных систем
- •8. Некоторые простейшие типы диаграмм состояния
- •9. Сложные диаграммы состояния
- •Часть II.Моделирастворов
- •1.Модель идеальных растворов
- •2. Модель регулярных твердых растворов
- •3. Основные допущения модели регулярных растворов
- •4. Модель твердого раствора в статистической теории упорядочивающихся сплавов [6]
- •5. Конфигурационная энтропия
- •Часть III. Расчет диаграмм
- •1. Построение диаграмм состояния
- •2. Уравнения равновесия. Метод касательной. Стимулы превращения.
- •3. Конкуренция фаз и гетерофазных смесей фаз
- •4. Термодинамический потенциал механической смеси фаз
- •5. Минимизация потенциала механической смеси фаз
- •Алгоритм решения уравнений материального баланса.
- •6. Графическое изображение состава многокомпонентной системы
- •7. Барицентрические координаты
- •8. Независимые переменные механической смеси фаз для заданного состава системы
- •9. Диаграммы основных состояний
- •Заключение
- •Литература
- •Часть I . Равновесие…………………………………………………….5
- •Часть II. Модели растворов ………………………………………….23
- •Часть III. Расчет диаграмм……………………………………………41
9. Сложные диаграммы состояния
Любую сложную диаграмму состояния можно расчленить на диаграммы попарного равновесия фаз, части которых реализуются как стабильные [3]. При этом возникает необходимость рассматривать виртуальные фазы для чистых компонентов, которые при данных условиях не реализуются либо реализуются в неравновесных условиях как метастабильные. Для оценки температур виртуальных превращений используется экстраполяция стабильных линий равновесия на чистый компонент, правило Трутона (о постоянстве энтропий плавления чистых элементов) и др. Расчленение д.с. позволяет понять причину появления одних и тех же структур в разных областях концентраций, дает возможность объяснять ряд особенностей кристаллизации в зависимости от скорости охлаждения.
Давление меняет сложные диаграммы состояния двумя способами: оно меняет вид и тип простейших д.с., на которые разлагается сложная диаграмма состояния, и изменяет взаимное положение простейших диаграмм состояния.
Обобщение модели регулярных растворов с учетом избыточного объема позволило провести анализ д.с. бинарных систем при переменном давлении. В обобщенной модели регулярных растворов тип изобарического сечения T-P-Xд.с. (температура, давление, концентрация) определяется энтальпией смешенияEсм+PVсм, гдеVсм– описывает отклонение объема от аддитивности.
Эволюцию T-XсеченийT-P-Xдиаграмм состояний под давлением можно рассмотреть с помощью пространства параметров стабильности и взаимодействия компонентов. Изменению давления в пространстве параметров соответствует движение фигуративной точки из одной области пространства параметров в другую, что связано с переходом д.с. одного типа в другой [3].
Расчленение диаграмм состояний на простейшие позволяет обнаружить связь промежуточных фаз, образующихся в бинарных системах при атмосферном давлении, с фазами компонентов, стабильных при высоких давлениях. В системах с TiиZrтакой фазой является- фаза. Метастабильные при атмосферном давлении фазы возникают также при быстром охлаждении расплава. Термодинамические данные метастабильных фаз могут быть использованы для расчета диаграмм состояния под давлением.
Часть II.Моделирастворов
1.Модель идеальных растворов
Модель идеальных растворов в применении к диаграммам состояния дает только один тип д.с. - «сигару» и лишь в редких случаях удовлетворительно описывает ее.
Пусть компоненты А и В образуют идеальные растворы как в жидком, так и в твердом состоянии. Обозначим за TAиTBтемпературы плавления компонентов А и В. ПустьTA>TB. Рассмотрим состояние системы при температуреT,лежащей в интервале [TB ,TA] (TB<T<TA). Согласно принципам выбора стандартного состояния в термодинамике, термодинамический потенциал стандартного состояния равенG*=XAGA(тв)+XBGB(жид). (3)
Термодинамический потенциал Гиббса для жидкого раствора [4] равен Gжид=G*+XA(ж)GA,пл+RT(XA(ж)ln XA(ж)+ XB(ж)ln XB(ж)). (4)
Для твердого раствора получаем [4] Gтв=G*-XB(тв)GA,пл+RT(XA(тв)ln XA(тв)+ XB(тв)ln XB(тв)). (5)
Если пренебречь небольшим различием
теплоемкости твердого и жидкого состояния
чистых компонентов, то
![]() (6)
гдеHпл,A,,Hпл,B– энтальпии плавления компонентов А и
В.Тпл,А, Тпл,В - температуры плавления компонентов.
(6)
гдеHпл,A,,Hпл,B– энтальпии плавления компонентов А и
В.Тпл,А, Тпл,В - температуры плавления компонентов.
При
равновесии жидкого и твердого раствора
химический потенциал компонента В
одинаков как в жидком, так и в твердом
растворе
тв.=жид,
или ![]() .
(7)
.
(7)
После
дифференцирования и преобразований
получим уравнение, связывающее
концентрации на линии солидуса с
концентрациями ликвидуса
 (8)
(8)
Это
уравнение содержит два неизвестных,
для его решения необходимо использовать
дополнительные предположения. По мере
приближения к Тпл,А,
величины![]() и
и![]() 1,
а следовательно,
1,
а следовательно,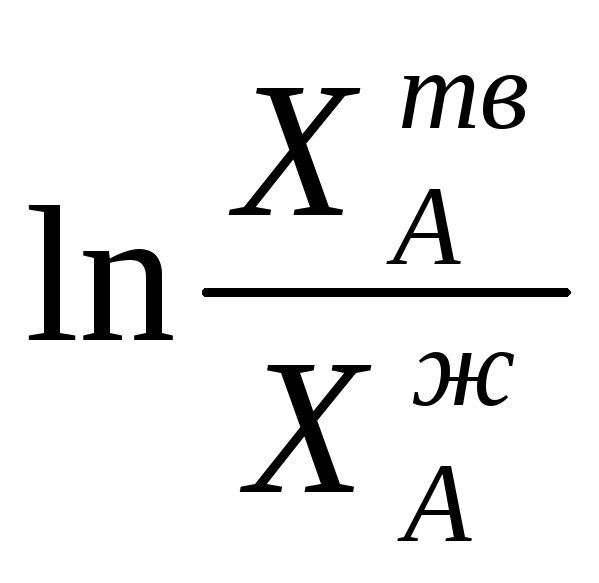
![]() 0, второе слагаемое в левой части (6)
стремится к нулю. Поскольку 1/T1/Tпл,А,
получаем выражение
0, второе слагаемое в левой части (6)
стремится к нулю. Поскольку 1/T1/Tпл,А,
получаем выражение
 . (9)
. (9)
Аналогично
для другого конца диаграммы имеем
 .
(10)
.
(10)
Решая эти уравнения при фиксированных значениях T,получим диаграмму состояния типа «сигары» (рис. 4,a).
