
- •М.Ф. Жоровков
- •Расчет диаграмм состояния бинарных систем в приближении регулярных растворов Учебное пособие
- •Томск-2001
- •Введение
- •Часть I . Равновесие
- •1.Термодинамические параметры
- •3.Отличительные признаки фаз
- •4.Функции состояния
- •5. Понятие о диаграмме состояния
- •6. Равновесие фаз
- •6.1.Термическое равновесие
- •6.2. Механическое равновесие
- •6.3.Собственно фазовое равновесие
- •7. Простейшие диаграммы состояния бинарных систем
- •8. Некоторые простейшие типы диаграмм состояния
- •9. Сложные диаграммы состояния
- •Часть II.Моделирастворов
- •1.Модель идеальных растворов
- •2. Модель регулярных твердых растворов
- •3. Основные допущения модели регулярных растворов
- •4. Модель твердого раствора в статистической теории упорядочивающихся сплавов [6]
- •5. Конфигурационная энтропия
- •Часть III. Расчет диаграмм
- •1. Построение диаграмм состояния
- •2. Уравнения равновесия. Метод касательной. Стимулы превращения.
- •3. Конкуренция фаз и гетерофазных смесей фаз
- •4. Термодинамический потенциал механической смеси фаз
- •5. Минимизация потенциала механической смеси фаз
- •Алгоритм решения уравнений материального баланса.
- •6. Графическое изображение состава многокомпонентной системы
- •7. Барицентрические координаты
- •8. Независимые переменные механической смеси фаз для заданного состава системы
- •9. Диаграммы основных состояний
- •Заключение
- •Литература
- •Часть I . Равновесие…………………………………………………….5
- •Часть II. Модели растворов ………………………………………….23
- •Часть III. Расчет диаграмм……………………………………………41
5. Конфигурационная энтропия
Конфигурационная энтропия упорядоченной
фазы равна [6]
![]() . (50)
. (50)
Для
разупорядоченного твердого раствора
n(R)=C.
Подставляя это значение в (50),
получаем выражение для конфигурационной
энтропии идеального раствора![]() . (51)
. (51)
Конфигурационная энтропия упорядоченной
фазы типа CuAuполучится,
если подставить (37) в (50)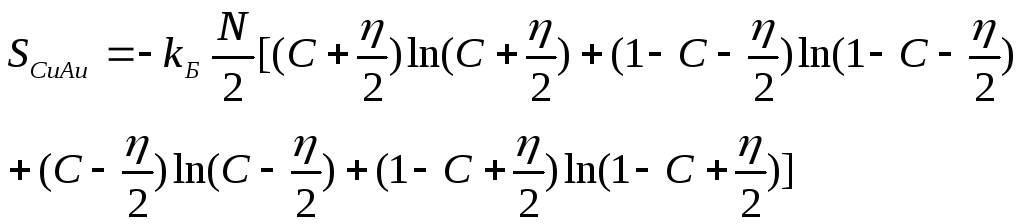 .
(52)
.
(52)
Конфигурационная энтропия фазы типа
Cu3Auполучается подстановкой (44) в (50):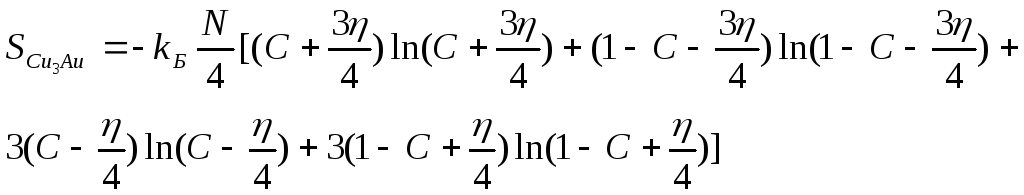 .(53)
.(53)
Равновесное значение параметра дальнего порядка находится минимизацией термодинамического потенциала по параметру порядка.
Часть III. Расчет диаграмм
1. Построение диаграмм состояния
При построении диаграмм состояния целесообразно использовать комплексный подход, включающий анализ, расчет и эксперимент. Построение разбивается на ряд этапов: 1. Определение возможных фаз. 2. Определение параметров стабильности для различных фаз чистых компонентов, включая виртуальные фазы. 3. Оценка параметров взаимодействия. 4. Аналитическое описание зависимостей термодинамических потенциалов каждой фазы от T,P,C, параметров взаимодействия, стабильности и внутренних параметров. 5. Расчет простейших д.с. 6. Конструирование сложных диаграмм из простейших (построение стабильных и метастабильных участков диаграммы состояний). 7. Сопоставление с экспериментальной диаграммой. 8. Корректировка расчетов и экспериментальной диаграммы.
Такой путь позволяет строить диаграмму с наименьшими усилиями. Полученные выражения для термодинамических потенциалов можно использовать при описании других свойств системы и кинетики превращения, а не только расчета диаграмм состояния. Выражения для термодинамических потенциалов позволяют рассчитывать метастабильные участки диаграмм состояния, а также линии T(Xo)– равенства термодинамических потенциалов сосуществующих фаз, стимулы фазовых переходов и т.п. Для получения термодинамических потенциалов каждой из фаз необходимо использовать все известные экспериментальные и теоретические данные о системе: термодинамические свойства, коэффициенты теплового расширения, сжимаемости, концентрационные зависимости плотности или параметров решетки, известные участки диаграмм состояния и т.п. При недостатке данных можно опираться на имеющиеся закономерности свойств от номера групп элементов в периодической таблице элементов, эмпирические правила (Трутона и др.).
При использовании известных участков диаграмм состояния всегда следует помнить, что обратная задача определения термодинамического потенциала по диаграмме состояния неоднозначна, как и все задачи обратного типа, когда по следствиям пытаются установить причины.
2. Уравнения равновесия. Метод касательной. Стимулы превращения.
Для нахождения концентраций сосуществующих в равновесии фаз пользуются методом общей касательной. Обычно в качестве независимых переменных выбирается концентрация одного из компонентов в фазах.
Однако, для получения уравнений общей
касательной может быть использован и
другой выбор независимых переменных.
В качестве независимых переменных можно
выбрать концентрацию одного компонента
в одной из фаз и долю фазы. При таком
выборе дифференциал термодинамического
потенциала dG
двухфазной двухкомпонентной системы
принимает вид [3]:![]() (54)
или
(54)
или![]() , (55)
гдеа1 иа2– доли фаз,а1+а2=1.
, (55)
гдеа1 иа2– доли фаз,а1+а2=1.
Легко показать, что Ga =a2(A- B), аGX=(1-X2)A+X2B) ( - разность химических потенциалов компонентов в сосуществующих фазах).
Условием равновесия системы является
минимум термодинамического потенциала
G двухфазной
двухкомпонентной системы. Следовательно,
выполняется уравнениеdG=0,
из которого (приа20)
получим![]() .
(56) Уравнения (56) являются
уравнениями общей касательной и равенства
химических потенциалов.
.
(56) Уравнения (56) являются
уравнениями общей касательной и равенства
химических потенциалов.
Запись дифференциала в форме (54), математически эквивалентная записи дифференциала через концентрации, дает несколько иную информацию о стимулах превращения по сравнению с той, которая вытекает из рассмотрения разностей химических потенциалов A иB. Последние дают стимулы перехода каждого компонента через границу фаз в предположении независимости этих переходов. Соотношение (54) дает стимулы двух качественно разных процессов: процесса обмена компонентами, стимул которого равенGa, и процесса перестройки структуры, стимул которой равенGX. Перестройка структуры наблюдается при бездиффузионной (изоконцентрационной) кристаллизации сплавов и бездиффузионных полиморфных превращениях в твердом состоянии. ВеличиныGaиGXдают информацию об условиях частичного (неполного) равновесия. ПриGa=0иGX0нет стимула обмена, и может идти только перестройка (геометрически это выражается в том, что касательные к кривым зависимостей термодинамического потенциала от концентрации параллельны). ПриGa0иGX=0нет стимула перестройки, и может идти только обмен компонентами (касательные к кривой G1(X) первой фазы пересекают кривуюG2(X) второй фазы). ПриX1=X2 условиеGX =0описывает линию равных термодинамических потенциаловT0(X). Знание ее необходимо при исследовании изоконцентрационных превращениях. Стимул перестройкиGXопределяет состав и размеры критического зародыша новой фазы.
