
- •М.Ф. Жоровков
- •Расчет диаграмм состояния бинарных систем в приближении регулярных растворов Учебное пособие
- •Томск-2001
- •Введение
- •Часть I . Равновесие
- •1.Термодинамические параметры
- •3.Отличительные признаки фаз
- •4.Функции состояния
- •5. Понятие о диаграмме состояния
- •6. Равновесие фаз
- •6.1.Термическое равновесие
- •6.2. Механическое равновесие
- •6.3.Собственно фазовое равновесие
- •7. Простейшие диаграммы состояния бинарных систем
- •8. Некоторые простейшие типы диаграмм состояния
- •9. Сложные диаграммы состояния
- •Часть II.Моделирастворов
- •1.Модель идеальных растворов
- •2. Модель регулярных твердых растворов
- •3. Основные допущения модели регулярных растворов
- •4. Модель твердого раствора в статистической теории упорядочивающихся сплавов [6]
- •5. Конфигурационная энтропия
- •Часть III. Расчет диаграмм
- •1. Построение диаграмм состояния
- •2. Уравнения равновесия. Метод касательной. Стимулы превращения.
- •3. Конкуренция фаз и гетерофазных смесей фаз
- •4. Термодинамический потенциал механической смеси фаз
- •5. Минимизация потенциала механической смеси фаз
- •Алгоритм решения уравнений материального баланса.
- •6. Графическое изображение состава многокомпонентной системы
- •7. Барицентрические координаты
- •8. Независимые переменные механической смеси фаз для заданного состава системы
- •9. Диаграммы основных состояний
- •Заключение
- •Литература
- •Часть I . Равновесие…………………………………………………….5
- •Часть II. Модели растворов ………………………………………….23
- •Часть III. Расчет диаграмм……………………………………………41
6.3.Собственно фазовое равновесие
Собственно фазовое равновесие определяется равенством химических потенциалов компонентов для всех фаз.
![]() ,
где (1≤i≤k)k – число компонентов
в системе; (1≤l≤α)α- число фаз в системе,μli
– химический потенциал компонентаiвl
–ой фазе.
,
где (1≤i≤k)k – число компонентов
в системе; (1≤l≤α)α- число фаз в системе,μli
– химический потенциал компонентаiвl
–ой фазе.
Независимо от того, при каких внешних условиях (изобарно-изотермических, изохорно-изэнтропических, изохорно-изотермических, изобарно-изэнтропических) рассматривается термодинамическая система, условия равновесия фаз имеют вид [5]: TI=TII= …………=Tα PI=PII=……… =Pα (2) µI=µII=……… =µα.
При отклонении системы от равновесного состояния времена достижения равновесия (времена релаксации) термического, механического и собственно фазового могут сильно (на несколько порядков) различаться друг от друга. Время установления равновесия по составу в фазах (собственно фазовое равновесие) может изменяться от системы к системе от нескольких часов до геологических масштабов времени. Время выравнивания давления в газе составляет 10-13-10-14сек. Поэтому система, равновесная в одном отношении, может быть неравновесной в другом отношении. Таким образом, речь может идти о системах с частичным равновесием, например, системы с запретом на перенос вещества компонентов (независимо друг от друга) из одной фазы в другую через поверхность раздела фаз. В этом случае достигается термическое и механическое равновесие. Линии частичного равновесия могут быть также нанесены на диаграмму состояния. Эти линии необходимы для объяснения кинетики фазовых превращений, для неравновесных процессов. В частности, в системах с частичным равновесием могут возникать фазы, отсутствующие на равновесной диаграмме состояний.
7. Простейшие диаграммы состояния бинарных систем
Если в образовании данной системы участвует несколько веществ, то каждое вещество, которое может быть выделено из системы и существовать вне ее, называется составляющим веществом системы. Составляющие вещества, концентрации которых в рассматриваемой системе могут быть выбраны произвольно, без изменения числа фаз системы, называются компонентами. В отсутствии химических реакций в системе число компонентов, т.е. число независимых составляющих веществ в системе, равно общему числу веществ.
Р ассмотрим
вначале диаграммы состояния (д.с.)
простейших двухкомпонентных систем.
Пусть компоненты простейших систем
претерпевают одно и при этом одинаковое
полиморфное превращение. В таких системах
реализуется только две структуры:
1)
высокотемпературная,
2) низкотемпературная.
ассмотрим
вначале диаграммы состояния (д.с.)
простейших двухкомпонентных систем.
Пусть компоненты простейших систем
претерпевают одно и при этом одинаковое
полиморфное превращение. В таких системах
реализуется только две структуры:
1)
высокотемпературная,
2) низкотемпературная.
Диаграммы состояния могут быть разных типов [1]. К одному типу относят все диаграммы, для которых сохраняются неизменными общее число геометрических объектов, их размерности и взаимное сопряжение для всех геометрических элементов (характерных точек, линий, областей), но могут искажаться форма и размер этих элементов. При переходе от одного типа д.с. к другому должны либо появиться новые элементы, либо исчезнуть прежние. При эволюции диаграмм состояния один тип может перейти в другой [1]. Переход осуществляется через промежуточные, граничные типы д.с. Граничным типом д.с. является, например, диаграмма касания купола расслоения с границами области двухфазности или совпадение азеотропной точки с куполом расслоения (рис.2).
Возможны и другие типы граничных диаграмм. Описав математически локальные особенности граничной диаграммы состояния (г.д.с.), получим систему уравнений, характеризующих данный тип г.д.с. В эти уравнения будут входить температура, давление, концентрации компонентов, а также термодинамические параметры [2], соответствующие тем или иным моделям растворов (идеальных, регулярных, субрегулярных). Термодинамические параметры будем подразделять на параметры стабильности, которые описывают фазовые переходы чистых компонентов (теплота, энтропия и температура превращения), и параметры взаимодействия, характеризующие свойства растворов и упорядоченных структур.Параметры стабильности совместно с параметрами взаимодействия образуют N – мерное пространство, в котором каждой точке соответствует определенная диаграмма состояния. ЭтоN– мерное пространство разбивается(N-1) – мерными гиперповерхностями на области, внутренним точкам которых соответствуют диаграммы одного типа. Для описания этих границ могут быть использованы упоминавшиеся выше уравнения граничных диаграмм состояния. Изучив в пространстве параметров поведение границ, можно узнать структуру пространства параметров [1]. Знание структуры пространства параметров позволяет предсказывать эволюцию диаграммы состояния, когда термодинамические параметры изменяются по известному закону.
Теоретическое изучение диаграмм состояния (д.с.) проводится в трех направлениях: анализ, прогноз и расчет. Развитие всех трех направлений тесно связано друг с другом. Анализ, прежде всего, предполагает исследование возможных типов и их эволюции под действием внешних параметров. Задачей прогноза является определение термодинамических свойств различных фаз (стабильных и виртуальных) для чистых компонентов и по свойствам компонентов предсказать тип д.с.
При расчете д.с. необходимо, используя все известные сведения о термодинамической системе и известные участки диаграммы состояния, вычислить полную д.с. и ее эволюцию под влиянием внешних условий.
Б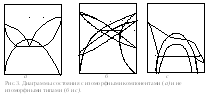 ольшинство
диаграмм состояния имеют области
стабильности трех и более фаз, являются
сложными и могут рассматриваться как
наложение простейших [3]; поэтому
необходимо исследовать все, что касается
простейших диаграмм состояния. Д.с.
относится к простейшей в случае, если
во всей системе происходит одно
превращение 1 рода: полиморфное (плавление,
аллотропическое превращение) или
изоморфное (жидкость – пар, электронные
переходы в твердом состоянии). Простейшие
диаграммы состояния могут включать
область расслоения фаз. При расчленении
сложных диаграмм на простейшие возникает
необходимость рассмотрения виртуальных
переходов компонентов. Оценка параметров
ольшинство
диаграмм состояния имеют области
стабильности трех и более фаз, являются
сложными и могут рассматриваться как
наложение простейших [3]; поэтому
необходимо исследовать все, что касается
простейших диаграмм состояния. Д.с.
относится к простейшей в случае, если
во всей системе происходит одно
превращение 1 рода: полиморфное (плавление,
аллотропическое превращение) или
изоморфное (жидкость – пар, электронные
переходы в твердом состоянии). Простейшие
диаграммы состояния могут включать
область расслоения фаз. При расчленении
сложных диаграмм на простейшие возникает
необходимость рассмотрения виртуальных
переходов компонентов. Оценка параметров
стабильности для ОЦК, ГЦК и ГПУ структур металлов выполнена в [2] и может быть использована для расчетов д.с.
В связи с вопросом о типах простейших д.с. следует отметить принципиальное различие д.с. эвтектического или перетектического типов систем с изоморфными и неизоморфными компонентами. В первом случае эти д.с. относятся к простейшим, границы растворимости в твердой фазе являются стабильными участками единого «купола» расслоения твердого раствора, высокотемпературная часть которого метастабильна. Во втором – д.с. расчленяется на три простейшие д.с. по - парного равновесия фаз, но единого «купола» нет. На д.с. эвтектического или перетектического типа систем изоморфных компонентов внутри «купола» расслоения твердого раствора может метастабильно существовать «купол» расслоения жидкости, который обнаруживается в переохлажденной жидкости.
