
- •Тема 1. Кинематика материальной точки.
- •Тема 2.
- •Тема 3. Работа и энергия. Динамика твердого тела
- •Тема 4. Основы релятивистской механики
- •Тема 5. Основы молекулярной физики
- •5.7.3. Диффузия
- •Тема 6. Физические основы термодинамики
- •6.1. Основные понятия и определения
- •6.3. Уравнение состояния идеального газа
- •6.4. Первый закон термодинамики
- •6.5. Рабочая диаграмма Pv. Работа — функция процесса
- •6.7. Зависимость теплоемкости от условий подвода теплоты. Уравнение Майера для идеального газа
- •6.7.1. Изохорная теплоемкость
- •6.7.2. Изобарная теплоемкость
- •6.7.3. Уравнение Майера для идеального газа
- •6.8. Расчет изменения внутренней энергии
- •6.9. Формулы и таблицы для истинных и средних теплоемкостей. Определение количества теплоты по теплоемкости и разности температур
- •6.10Молекулярно-кинетическая теория теплоемкости
- •6.11. Обратимые и необратимые термодинамические процессы
- •6.12. Второй закон термодинамики
- •6.13.Энтропия
- •6.14. Некоторые свойства энтропии
- •6.15. Теория «тепловой смерти Вселенной»
- •6.16.Тепловая диаграмма Ts. Теплота —функция процесса
- •6.17. Изменение энтропии идеального газа
Тема 6. Физические основы термодинамики
6.1. Основные понятия и определения
Термодинамика — это наука о закономерностях превращения одних видов энергии в другие. Значение термодинамики состоит в том, что она устанавливает принципы наиболее эффективного и оптимального преобразования энергии. Этим термодинамика дает ответ на вопрос, как нужно организовать рабочий процесс в тепловом двигателе, чтобы КПД его был максимальным.
Термодинамической системой называют совокупность макроскопических тел, находящихся в энергетическом (механическом и тепловом) взаимодействии друг с другом и другими телами, окружающими их, а также обменивающихся друг с другом веществом.
Любое взаимодействие в системе связано с энергетическими затратами, и каждое из них имеет хвою, только ему присущую причину, называемую обобщенной силой или потенциалом воздействия, и каждое воздействие приводит к изменению только ему присущей величины, которая называется обобщенной координатой или индикатором воздействия. Воздействие возможно при наличии разности потенциалов данного взаимодействия. Необходимо четко определять обобщенную силу и обобщенную координату каждого взаимодействия. При термическом взаимодействии это соответственно абсолютная температура и энтропия.
Механическое взаимодействие между телами осуществляется посредством механических сил, например сил давления, электромагнитных и др. Тепловое взаимодействие состоит в передаче теплоты. Обмен веществом — в переносе вещества через границы области, занимаемой телом. Все, что не входит в термодинамическую систему, но может оказывать на нее воздействие - объединяется понятием окружающей среды.
В термодинамике производится сопоставление рассматриваемой системы с окружающей средой, изучаются взаимодействия как внутри системы, так и между системой и окружающей средой. Если между системой и окружающей средой возможны все три типа взаимодействия, система называется открытой. В закрытой системе обмен веществом с другими системами отсутствует. Адиабатной называют систему, в которой отсутствует теплообмен с.другими системами. Адиабатными могут быть как открытая, так и закрытая системы. Система, не взаимодействующая с окружающей средой или другими системами ни энергетически, ни веществом, называется изолированной.
Различают термодинамические системы: однородные (однофазные), или гомогенные, и неоднородные (многофазные), или гетерогенные. Гомогенные системы имеют одинаковые или непрерывно и равномерно изменяющиеся химический состав и физические свойства. Например, газ, находящийся в баллоне; атмосферный воздух, давление которого изменяется непрерывно jio высоте; чистые, без сажи, продукты сгорания.
Гетерогенная система состоит из двух или более гомогенных областей, называемых фазами. На границах фаз скачкообразно изменяются химический состав или физические свойства вещества. Например, гетерогенная система из воды и льда имеет одинаковый химический состав, но разные физические свойства, а гетерогенная система из воды и куска сливочного масла — и разный состав, и разные свойства.
Совокупность физических свойств термодинамической системы в рассматриваемых условиях называют состоянием системы. Величины, характеризующие состояние термодинамической системы, называют термодинамическими параметрами: давление — Р, удельный объем — v, температура— Т, внутренняя энергия — и, энтальпия — h, энтропия — s и др. Параметры, не зависящие от размеров системы (ее протяженности, массы), например температуру, давление, называют интенсивными, зависящие же, например объем, энтальпию, энтропию, — экстенсивными или аддитивными.
Если параметры с течением времени не изменяются, то состояние системы называется стационарным.
Состояние, в которое приходит система при постоянных внешних условиях, характеризуемое неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и теплоты, называют равновесным. В 'противном случае состояние называют неравновесным. Состояние системы, при котором во всех её частях температура одинакова, называют термическим равновесием, при одинаковом во всех частях давлении — механическим равновесием.
При подводе или отводе энергии происходит изменение состояния термодинамической системы, то есть происходит изменение значений термодинамических параметров. Изменение состояния системы, характеризуемое изменением термодинамических параметров, называют термодинамическим процессом.
Равновесным называют процесс, представляющий собой непрерывный ряд последовательных равновесных состояний. Другими словами, равновесными считают процессы, при которых в каждый момент времени во всех точках системы одноименные параметры имеют одинаковые значения. Процесс, при котором система проходит через неравновесные состояния, называют неравновесным. Будем изучать только классическую термодинамику, рассматривая «как будто бы равновесные» процессы, по-гречески — «квазистатические», хотя все реальные процессы неравновесны, так как протекают с конечной скоростью и, следовательно, равновесие не успевает установиться во всей системе.
Энергия есть единая мера различных форм движения материи, она характеризует способность систем совершать работу.
Вещество, с помощью которого в тепловой машине совершается работа, называется рабочим телом. Рабочее тело должно обладать способностью к значительному расширению и сжатию. В качестве рабочего тела теоретически можно использовать любое вещество, обладающее этими свойствами. Практическое же применение получили только парогазовые вещества, которые под воздействием давления и при нагревании изменяют свой объем значительно сильнее, чем жидкие и твердые. Это дает возможность получить от них большую работу, чем от жидкостей и твердых тел. Конкретный выбор рабочего тела определяется типом и назначением машины.
Газ, молекулы которого не взаимодействуют друг с другом и имеют размеры значительно меньше, чем расстояние между ними, называется идеальным газом. Если указанные условия не выполняются, газ считается реальным. Введение понятия идеального газа в термодинамику дает возможность найти более простые аналитические зависимости между параметрами. Степень расхождения в свойствах идеальных и реальных газов зависит всякий раз от конкретных условий, в которых находится газ. Водород, азот, гелий и другие газы с малой молярной массой при комнатной температуре и атмосферном давлении ведут себя, как идеальные газы. Поэтому законы идеального газа во многих случаях могут применяться для расчета реальных газов.
б. 2. Термические параметры и функции состояния
Физические величины, характеризующие состояние системы и поддающиеся непосредственному измерению, называются параметрами состояния. В качестве основных параметров состояния удобно выбирать интенсивные величины, которые характеризуют конкретное тепловое состояние вещества и поэтому называются также термическими параметрами состояния. Основными параметрами состояния принято считать абсолютное давление, температуру (п. 5.3 и 5.4) и удельный объем. Объем тела V является экстенсивной величиной, он зависит от массы тела. Удельный объем тела представляет объем единицы массы (1 кг) данного вещества и становится интенсивной величиной, не зависящей от массы:
![]()
Таким
же параметром состояния может быть и
плотность вещества
— масса единицы объема
![]() , кг/м3.
Для удобства
сопоставления удельных объемов или
плотностей принято приводить их к
одинаковым условиям. Наибольшее
распространение
имеют так называемые нормальные
физические условия,
которым соответствуют нормальное
давление в 1 физическую атмосферу и
нормальная температура 0 °С. Объем,
измеренный
в этих условиях, обозначают — VН,
м3.
, кг/м3.
Для удобства
сопоставления удельных объемов или
плотностей принято приводить их к
одинаковым условиям. Наибольшее
распространение
имеют так называемые нормальные
физические условия,
которым соответствуют нормальное
давление в 1 физическую атмосферу и
нормальная температура 0 °С. Объем,
измеренный
в этих условиях, обозначают — VН,
м3.
Термодинамические параметры со сложной физической природой, характеризующие, как и параметры состояния, состояние термодинамической системы, называются функциями состояния системы. Наиболее широко используются в термодинамике следующие функции состояния:
внутренняя энергия U, Дж; u, Дж/кг;
энтальпия Н, Дж; h, Дж/кг;
энтропия S, Дж/К; s, Дж/(кг • К);
изохорно-изотермический потенциал или свободная энергия F = U - TS, Дж;
изобарно-изотермический потенциал или свободная энтальпия Ф = Н - TS, Дж; удельный изобарно-изотермический потенциал или химический потенциал
 =h
—
Ts,
Дж/кг.
=h
—
Ts,
Дж/кг.
Значение перечисленных функций состояния можно определить расчетом только через параметры состояния. Поэтому их и называют функциями состояния.
Всякая система в определенных условиях обладает некоторым запасом полной энергии Е, которая складывается из внутренней и внешней, каждая из них, в свою очередь, состоит из кинетической и потенциальной.
Внутренняя
кинетическая энергия обусловлена
тепловым хаотическим
движением молекул, и это свойство
непосредственно
связано с температурой. Этот вид
внутренней энергии складывается
из кинетической энергии наступательного
—U![]() ,
вращательного
—
,
вращательного
—
![]() и
колебательного —
и
колебательного —
![]() движения
микрочастиц
системы. Внутренняя потенциальная
энергия зависит
от взаимодействия молекул друг с другом,
внутриатомных
и внутриядерных процессов.
движения
микрочастиц
системы. Внутренняя потенциальная
энергия зависит
от взаимодействия молекул друг с другом,
внутриатомных
и внутриядерных процессов.
Внешняя энергия представляет собой кинетическую энергию движения системы относительно других систем или тел окружающей среды тс2/2 и потенциальную энергию внешних
силовых
полей
![]() .
.
Потенциальная
энергия![]() ,
внешних силовых полей, рассматриваемая
в термодинамике, состоит:
,
внешних силовых полей, рассматриваемая
в термодинамике, состоит:
1) из потенциальной энергии Пr положения системы в поле гравитационных сил, равной произведению ускорения свободного падения g на высоту h расположения центра тяжести рассматриваемого рабочего тела массой m кг, от условного уровня отсчета, то есть Пr = mgh; 2) потенциальной энергии Пэм рабочего тела, находящегося в электромагнитном поле (прохождение электропроводящего газа через электромагнитное поле, сопровождаемое непосредственным превращением части его полной энергии в электрическую, — имеет место в магнитогидродинамическом генераторе); 3) потенциальной энергии давления Пд, равной произведению давления на объем ПД= PV, называемой работой проталкивания.
Следовательно,
(6.1)
Поскольку в энергетических установках летательных аппаратов электромагнитные поля не принимают участия в преобразовании энергии, величину Пэм в дальнейшем не учитываем. В большинстве случаев в термодинамике гравитационная составляющая потенциальной энергии системы не рассматривается, так как ее изменение в процессах мало. Окончательно уравнение для полной энергии термодинамической системы имеет вид
(6.2)
![]() , Дж.
, Дж.
Потенциальная энергия давления (работа проталкивания) и кинетическая энергия системы имеют существенное значение при термодинамическом анализе потока газа. Поэтому основным понятием является внутренняя энергия.
Итак, внутренняя энергия может рассматриваться как одна из характеристик состояния термодинамической системы. Однако для термодинамического анализа процессов нет необходимости знать, из каких форм движения материи складывается внутренняя энергия, достаточно знать ее изменение в процессе.
Рассмотрим некоторые свойства внутренней энергии.
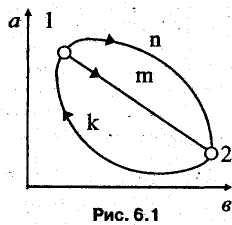
1. Внутренняя энергия является функцией состояния, изменение ее не зависит от характера термодинамического процесса, а определяется начальным и конечным состояниями системы. В связи с этим внутренняя энергия реального газа может быть представлена как функция любой пары параметров состояния:
(6.3)
![]()
Для
круговых процессов 1m2k1
и
1п2к1
можно
записать![]()
![]()
Значит,
величина
![]() и
не
зависит от характера термодинамического
процесса, а определяется начальным и
конечным состояниями
системы. Из математического анализа
известно,
что если значение криволинейного
интеграла не зависит от пути интегрирования,
а определяется лишь начальной и конечной
точками интегрирования, то подынтегральное
выражение
представляет собой полный дифференциал.
Поскольку
из рассмотренного примера следует, что
криволинейный интеграл
от внутренней энергии (и любой другой
функции состояния)
не зависит от пути интегрирования, то
дифференциал внутренней энергии (и
любой другой функции состояния)
является полным. Соответственно в
переменных уравнения
(6.3) полный дифференциал внутренней
энергии реального
газа равен:
и
не
зависит от характера термодинамического
процесса, а определяется начальным и
конечным состояниями
системы. Из математического анализа
известно,
что если значение криволинейного
интеграла не зависит от пути интегрирования,
а определяется лишь начальной и конечной
точками интегрирования, то подынтегральное
выражение
представляет собой полный дифференциал.
Поскольку
из рассмотренного примера следует, что
криволинейный интеграл
от внутренней энергии (и любой другой
функции состояния)
не зависит от пути интегрирования, то
дифференциал внутренней энергии (и
любой другой функции состояния)
является полным. Соответственно в
переменных уравнения
(6.3) полный дифференциал внутренней
энергии реального
газа равен:
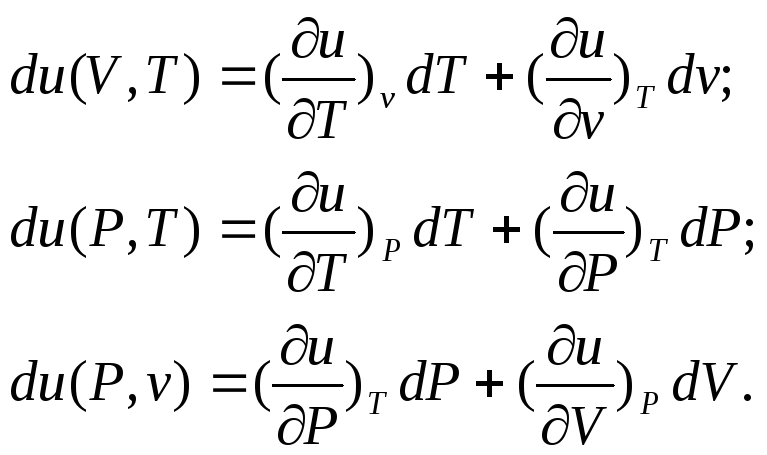 (6.4)
(6.4)
С точки зрения приложений термодинамики наибольший интерес представляет внутренняя энергия в переменных v и Т.
2.
Внутренняя энергия идеального газа
зависит только от
температуры.
Это свойство внутренней энергии
идеального газа
вытекает
из опыта Гей-Люссака и полученного из
него закона
Джоуля: ![]()
то есть внутренняя энергия идеального газа не зависит от объема и давления.
3.
Внутренняя энергия является экстенсивным
свойством системы.
Для системы, состоящей из «n»
макротел с соответственно
удельными значениями внутренней энергии
![]() ее
внутренняя энергия
ее
внутренняя энергия
![]() Для
однородной системы массой m
кг:
U
=
ти,
Дж.
Для
однородной системы массой m
кг:
U
=
ти,
Дж.
Термодинамика оперирует не абсолютными значениями внутренней энергии, а ее изменениями.
Внутренняя энергия может быть выражена в массовых, объемных и мольных единицах измерения.
Для случая открытой системы в виде потока вещества, движущегося с малой скоростью так, что можно пренебречь его кинетической энергией, согласно уравнению (6.2), полная энергия складывается из внутренней энергии системы и потенциальной энергии давления PV. Тогда сумма внутренней энергии и потенциальной энергии давления (работы проталкивания) составляет новую физическую величину, называемую энтальпией, реже, тепловой функцией Гиббса:
Н=U+PV,Дж,
h=и+pv,Дж/кг.
Следовательно, энтальпия есть полная энергия рабочего тела в потоке (открытой системе), определяемая количественно термодинамическим состоянием тела.
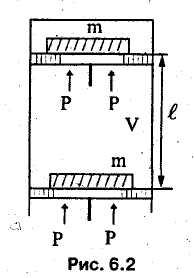
![]() .
Здесь
.
Здесь
![]() —
высота, на которую
поднимается поршень. Энтальпия,
как и внутренняя энергия, и
работа проталкивания, называемая еще
работой вытеснения, является энергетической
функцией состояния,
более полной, чем внутренняя энергия.
Итак, энтальпия — есть полная энергия
вещества в потоке (открытой системе),
движущегося с малой скоростью.
—
высота, на которую
поднимается поршень. Энтальпия,
как и внутренняя энергия, и
работа проталкивания, называемая еще
работой вытеснения, является энергетической
функцией состояния,
более полной, чем внутренняя энергия.
Итак, энтальпия — есть полная энергия
вещества в потоке (открытой системе),
движущегося с малой скоростью.
Рассмотрим некоторые свойства энтальпии.
1.
Энтальпия является функцией состояния,
изменение ее не
зависит от характера термодинамического
процесса, а определяется
начальным и конечным состоянием системы.
Бесконечно
малое изменение энтальпии является
полным дифференциалом.
В круговом процессе
![]() = 0 .
= 0 .
Энтальпия реального газа, как и внутренняя энергия, может быть представлена в виде функции от любой пары параметров состояния:
(6.5)
Аналогичными рассуждениями, что и для внутренней энергии, придем к выводу о том, что изменение энтальпии не зависит от характера термодинамического процесса, а бесконечно малое изменение энтальпии является полным
дифференциалом: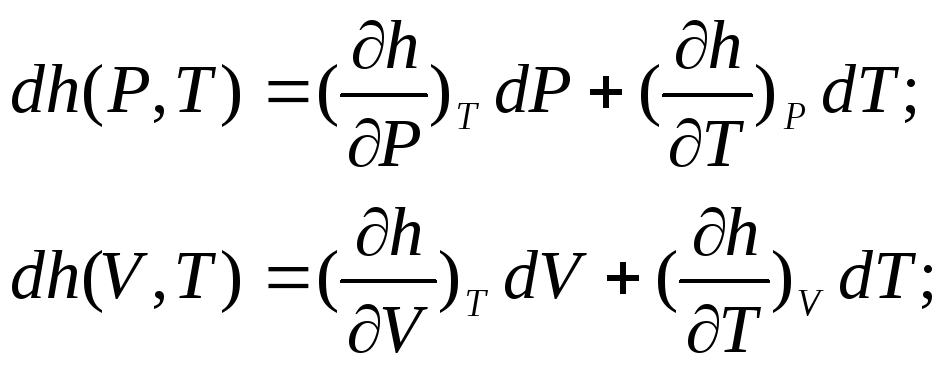 (6.6)
(6.6)
![]()
C точки зрения приложений термодинамики наибольший интерес представляет энтальпия в переменных Р и Т.
2.Энтальпия идеального газа зависит только от температуры. Это свойство энтальпии идеального газа вытекает из опыта Гей-Люссака и полученного из него закона Джоуля:
![]()
то есть энтальпия идеального газа не зависит от объема и давления.
3.Энтальпия
является Интенсивным свойством системы.
Для
системы, состоящей из п
макротел
с удельными значениями![]() ее энтальпия:
ее энтальпия:![]()
Для однородной системы, массой т кг: Н = т h, Дж.
Термодинамика оперирует не абсолютными значениями энтальпии, а ее изменениями.
Энтальпия может быть выражена в массовых, объемных. и мольных единицах измерения.
