
- •Тема 1. Кинематика материальной точки.
- •Тема 2.
- •Тема 3. Работа и энергия. Динамика твердого тела
- •Тема 4. Основы релятивистской механики
- •Тема 5. Основы молекулярной физики
- •5.7.3. Диффузия
- •Тема 6. Физические основы термодинамики
- •6.1. Основные понятия и определения
- •6.3. Уравнение состояния идеального газа
- •6.4. Первый закон термодинамики
- •6.5. Рабочая диаграмма Pv. Работа — функция процесса
- •6.7. Зависимость теплоемкости от условий подвода теплоты. Уравнение Майера для идеального газа
- •6.7.1. Изохорная теплоемкость
- •6.7.2. Изобарная теплоемкость
- •6.7.3. Уравнение Майера для идеального газа
- •6.8. Расчет изменения внутренней энергии
- •6.9. Формулы и таблицы для истинных и средних теплоемкостей. Определение количества теплоты по теплоемкости и разности температур
- •6.10Молекулярно-кинетическая теория теплоемкости
- •6.11. Обратимые и необратимые термодинамические процессы
- •6.12. Второй закон термодинамики
- •6.13.Энтропия
- •6.14. Некоторые свойства энтропии
- •6.15. Теория «тепловой смерти Вселенной»
- •6.16.Тепловая диаграмма Ts. Теплота —функция процесса
- •6.17. Изменение энтропии идеального газа
6.16.Тепловая диаграмма Ts. Теплота —функция процесса
И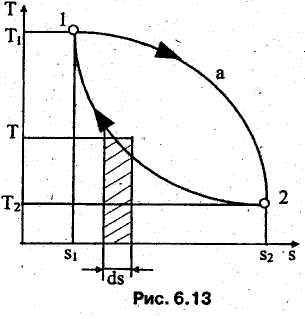 звестно,
что энтропия является функцией состояния
системы!.
В аналитических и графических расчетах
удобно пользоваться
удельной энтропией — s,
Дж/(кгК).
Чтобы рассчитать удельную
теплоту процесса через
энтропию по формуле
звестно,
что энтропия является функцией состояния
системы!.
В аналитических и графических расчетах
удобно пользоваться
удельной энтропией — s,
Дж/(кгК).
Чтобы рассчитать удельную
теплоту процесса через
энтропию по формуле
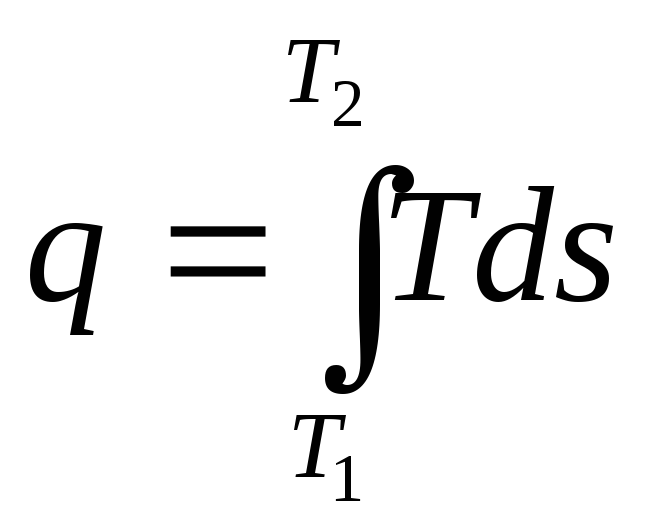 ,
необходимознать
,
необходимознать
уравнение
процесса Т
=
f(s).
Если
же процесс задан графически
в системе координат Ts,
то
и теплоту процесса легко
найти графически. .Исходя
из этой возможности диаграмму
Ts
называют
тепловой
или энтропийной. С помощью
диаграммы удельная теплота
может быть определена графически
площадью под кривой
процесса. Действительно, элементарная
площадка с
основанием
ds
и
высотой Т
равна
Tds,
то
есть элементарной теплоте
![]() q
в
бесконечно малом процессе (рис. 6.13). Вся
площадь 12s2
s1
определяет
удельную теплоту в конечном процессе
12:
q
в
бесконечно малом процессе (рис. 6.13). Вся
площадь 12s2
s1
определяет
удельную теплоту в конечном процессе
12:
![]()
Подводимое
(или отводимое)количество теплоты
q12(q21)
зависит
от характера процесса, так как между
состояниями 1
и 2 можно провести ряд процессов, и
теплота для каждого из них будет иметь
конкретное значение. В случае перехода
системы
из состояния 1 в состояние 2 по траектории
1а2 теплота q1a2
>q12![]() на величину
площади 1а21. Таким образом, теплота
является
функцией процесса.
на величину
площади 1а21. Таким образом, теплота
является
функцией процесса.
Достоинство диаграммы Ts состоит еще ив том, что по направлению кривой процесса легко определить знак теплоты согласно уравнению (6.43). Таким образом, если, например, энтропия уменьшается, то удельная теплота отводится независимо от знака изменения температуры. Следует обратить внимание на последнее утверждение: увеличение или уменьшение температуры в. общем случае не позволяет судить о том, подводится или отводится теплота. Признаком подвода теплоты может служить только рост энтропии, а отвода — ее уменьшение.
Вне процесса понятие теплоты не имеет смысла, так как означает не запас энергии, а ее количество, передаваемое в ходе процесса.
6.17. Изменение энтропии идеального газа
Рассмотрим
уравнения первого закона термодинамики
для закрытых
и открытых систем с учетом того, что
![]() q
=
Tds:
q
=
Tds:
![]()
Разделив обе части уравнений на Т, получим
(6.44)
![]()
![]() (6.45)
(6.45)
Из уравнения состояния идеального газа
Pv = RT (6.46)
получим Р/Т = R/v и v/T = R/P. Подставим полученные выражения соответственно в (6.44) и (6.45):
![]() (6.47)
(6.47)
