
- •Тема 1. Кинематика материальной точки.
- •Тема 2.
- •Тема 3. Работа и энергия. Динамика твердого тела
- •Тема 4. Основы релятивистской механики
- •Тема 5. Основы молекулярной физики
- •5.7.3. Диффузия
- •Тема 6. Физические основы термодинамики
- •6.1. Основные понятия и определения
- •6.3. Уравнение состояния идеального газа
- •6.4. Первый закон термодинамики
- •6.5. Рабочая диаграмма Pv. Работа — функция процесса
- •6.7. Зависимость теплоемкости от условий подвода теплоты. Уравнение Майера для идеального газа
- •6.7.1. Изохорная теплоемкость
- •6.7.2. Изобарная теплоемкость
- •6.7.3. Уравнение Майера для идеального газа
- •6.8. Расчет изменения внутренней энергии
- •6.9. Формулы и таблицы для истинных и средних теплоемкостей. Определение количества теплоты по теплоемкости и разности температур
- •6.10Молекулярно-кинетическая теория теплоемкости
- •6.11. Обратимые и необратимые термодинамические процессы
- •6.12. Второй закон термодинамики
- •6.13.Энтропия
- •6.14. Некоторые свойства энтропии
- •6.15. Теория «тепловой смерти Вселенной»
- •6.16.Тепловая диаграмма Ts. Теплота —функция процесса
- •6.17. Изменение энтропии идеального газа
6.13.Энтропия
Итак, понятие энтропии введено Р. Клаузиусом в 1865 г. С помощью энтропии решаются многие важные теоретические, практические проблемы и не только термодинамические. И вместе с тем, трудно найти другое научное понятие, вокруг которого кипело бы столько страстей и которое вызвало бы столько кривотолков, ошибок и нападок. Последнее обусловлено чрезвычайной широтой участия энтропии в различных технических, биологических, астрофизических и других процессах. Попытаемся здесь и в следующем параграфе разобраться в многоликости этого понятия.
Ранее отмечалось, что термическое состояние рабочего тела характеризуется рядом параметров и функций состояния: Р, v, Т, и, h, s и др. В равновесном состоянии эти величины имеют одинаковые значения по всей массе тела и представляют собой, в сущности, некоторые средние значения результатов поведения громадного числа молекул, составляющих выбранную массу вещества.
В
термодинамике применяются такие методы
исследования и
расчетов, при которых рабочие тела
рассматриваются как нечто
целое, отвлеченно от их атомно-молекулярной
структуры.
С такой точки зрения, полученная Р.
Клаузиусом
функция состояния — энтропия, имеет
физический смысл в том, что
это специфическая величина, характеризующая
только тепловое
взаимодействие системы со средой и что
она меняется
только в этом случае. Любая другая
величина может изменяться при этом,
но только изменение энтропии указывает
на наличие
теплового воздействия (подвод или отвод
теплоты). Этот
вывод следует из формулы (6.58). Действительно,
поскольку
абсолютная температура всегда больше
нуля, то подвод или отвод
теплоты зависит от знака ds.,
то есть при
подводе теплоты энтропия
всегда увеличивается:
![]() q
> 0, ds
> 0,
при отводе—уменьшается:
q
> 0, ds
> 0,
при отводе—уменьшается:
![]() q<
0, ds
< 0. Если энтропия не меняется (s
= const,
ds
=
0), то теплообмена системы с окружающей
средой нет, bq
= 0. Изменение
энтропии, равное нулю, указывает на
отсутствие
передачи энергии рабочему телу в форме
теплоты. Каким
же образом тогда работает тепловой
двигатель, представленный на рис.
6.10. Ведь в нем теплота подводится и
отводится,
а энтропия постоянна — q1
/T1=
q
2
/T2,
s1
=s2.
Это
противоречие
легко объяснить следующим образом. Да,
внешние потоки
энтропии одинаковы, но внутри двигателя
циркулирующее рабочее тело периодически
нагревается и охлаждается. При
подводе теплоты в идеальном двигателе
рабочее тело нагревается
и энтропия его растет, при отводе теплоты
рабочее тело
охлаждается и энтропия его уменьшается
до первоначального
значения. Заметим, что идеальные тепловые
двигатели обратимы.
Это допускает двойную возможность
движения теплоты
от теплоотдатчика к теплоприемнику в
тепловом двигателе
с производством работы и от теплоприемника
к теплоотдатчику в тепловом насосе (или
холодильнике) с затратой работы.
Следовательно, энтропия является
индикатором направленности
протекания термодинамических процессов.
q<
0, ds
< 0. Если энтропия не меняется (s
= const,
ds
=
0), то теплообмена системы с окружающей
средой нет, bq
= 0. Изменение
энтропии, равное нулю, указывает на
отсутствие
передачи энергии рабочему телу в форме
теплоты. Каким
же образом тогда работает тепловой
двигатель, представленный на рис.
6.10. Ведь в нем теплота подводится и
отводится,
а энтропия постоянна — q1
/T1=
q
2
/T2,
s1
=s2.
Это
противоречие
легко объяснить следующим образом. Да,
внешние потоки
энтропии одинаковы, но внутри двигателя
циркулирующее рабочее тело периодически
нагревается и охлаждается. При
подводе теплоты в идеальном двигателе
рабочее тело нагревается
и энтропия его растет, при отводе теплоты
рабочее тело
охлаждается и энтропия его уменьшается
до первоначального
значения. Заметим, что идеальные тепловые
двигатели обратимы.
Это допускает двойную возможность
движения теплоты
от теплоотдатчика к теплоприемнику в
тепловом двигателе
с производством работы и от теплоприемника
к теплоотдатчику в тепловом насосе (или
холодильнике) с затратой работы.
Следовательно, энтропия является
индикатором направленности
протекания термодинамических процессов.
И все было бы просто, если бы свойства энтропии ограничились постоянством в обратимых процессах. И споров вокруг энтропии было бы меньше. Начало же спорам положил Р. Клаузиус более 100 лет назад. И все из-за того, что идеи С. Карно он развил на новом уровне и приложил к необратимым процессам переноса теплоты, в которых возможен только односторонний переход системы в направлении меньшего потенциала. Р. Клаузиус распространил этот вывод на любые необратимые процессы и ввел тем самым принцип возрастания энтропии: во всех реальных процессах преобразования энергии в изолированных системах суммарная энтропия всех участвующих в них тел возрастает. Другими словами, принцип, который рассматривается как второй закон термодинамики, может быть сформулирован и так: какие бы изменения ни происходили в реальных изолированных системах, они всегда ведут к увеличению энтропии системы. Следовательно, энтропия является индикатором направленности необратимых процессов в изолированной системе. При этом, чем больше рост энтропии, тем «реальнее» процесс. Эта же мысль, высказанная в обратном направлении, будет звучать так: увеличить энтропию системы невозможно никаким иным путем, кроме подвода теплоты — либо от другой системы или окружающей сре-
Из изложенного следует, что второй закон термодинамики состоит из констатации двух положений: существования и постоянства энтропии в обратимых процессах и возрастания энтропии в необратимых процессах. Что же касается возможности уменьшения энтропии в изолированной системе, то второй закон ее исключает. Уменьшение энтропии невозможно в принципе, так как предполагает возможность самопроизвольного процесса в направлении большего потенциала.
Более полно раскрывается смысл энтропии, если- исходить из ее статистической трактовки, то есть если рассматривать вещество как совокупность молекул, обладающих определенной массой и скоростью, и определять его термическое состояние, исходя из микроструктуры и определенных закономерностей, которым подчиняются совокупности. Термическое состояние рабочего тела в этом случае будет зависеть от координат каждой молекулы и ее скорости в соответствующий момент времени. Решение такой задачи обычными методами затруднено из-за большого числа молекул и непрерывных взаимодействий между ними. Поэтому здесь применяются способы исследования массовых явлений, так называемая статистика. Применительно к изучению термических явлений она называется статистической термодинамикой и основывается на положениях математической теории вероятности.
Л. Больцман исследовал законы поведения всего множества молекул газа, как системы, и установил, что существует непосредственная связь энтропии с тем состоянием, в котором находится система. Состояние системы в фиксированный момент времени, при котором для каждой молекулы определены положение в пространстве и скорость, называют микросостоянием. Таким образом, микросостояние системы определяется совокупностью параметров, характеризующих состояние каждой микрочастицы системы. Однако молекулы находятся в хаотическом движении и во взаимодействии друг с другом, это приводит к постоянному перераспределению энергии между молекулами, то есть к изменению микросостояний системы. Естественно, что одно и то же макросостояние может быть получено при различном расположении молекул внутри рабочего тела и их скоростях, так как средние значения этих величин по всей массе тела будут одни и. же" же. Иными словами, одному и тому же макросостоянию будет соответствовать большое число микросостояний или при одном и том же макросостоянии может происходить непрерывная смена микросостояний при неизменном давлении, температуре и других параметрах состояния.
Число эквивалентных микросостояний, позволяющих реализовать данное макросостояние, по предложению М. Планка, называют термодинамической вероятностью. Она равна отношению общего числа перестановок всех N частиц между собой в пределах системы, то есть N\, к числу перестановок молекул внутри каждой из энергетических групп, отличающихся распределением молекул в пространстве, по скоростям и энергиям (ге,! л2! п3! ...п\):
Так как число эквивалентных микросостояний велико, то термодинамическая вероятность значительно больше математической. Последняя, как известно, определяется отношением числа интересующих нас событий к числу всех равновозможных я не может быть больше единицы.
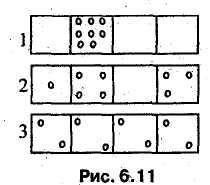
Термодинамическая вероятность наступления того или иного микросостояния зависит от величин, характеризующих молекулярное состояние. Рассмотрим систему, состоящую из восьми Молекул, хаотично движущихся в изолированном Объеме, мысленно разделенной на четыре части. Предположим три возможных состояния системы (рис. 6.11).
Термодинамические вероятности пребывания системы в каждом из трех состояний соответственно равны:
WP1 = AT!/raI! = 8!/8! = l;
W2 = N1/ (п,! га2! п3!) = 8!/(1! 4! 3!) = 280;
W3 = N]/ ( л,! га2! л3! га4) = 8!/(2! 2! 2!2!) = 2520.
В
соответствии со вторым законом
термодинамики и элементарной
логикой система из маловероятного
состояния с W,
самопроизвольно
переходит в состояние с W2
— 280
и далее в состояние
с максимальным значением термодинамической
вероят
136
Из рассмотренного примера следует, что в изолированной системе самопроизвольно происходят только такие процессы, которые идут от менее равновесных состояний к более равновесным. Система стремится к более равновесному состоянию, то есть равновесное состояние более вероятно. Неравновесное состояние возможно, но вероятность его мала (см. ниже).
Необратимые процессы, как было рассмотрено ранее, идут с возрастанием энтропии системы. Причина увеличения энтропии в необратимых процессах состоит в переходе системы от. менее к более вероятным состояниям, то есть в увеличении термодинамической вероятности состояния изолированной системы. Это значит, что энтропия есть некоторая функция термодинамической вероятности состояния системы. Вид функции установлен Л. Больцманом и выражается формулой
S
= k![]() nW
+ const,Дж/К,
nW
+ const,Дж/К,
где к — постоянная Больцмана. Энтропия изолированной системы пропорциональна натуральному логарифму термодинамической вероятности данного состояния системы, то есть энтропия — мера вероятности данного состояния. Формула Л. Больцмана объединила макровеличину — энтропию, с микровеличиной— термодинамической вероятностью данного состояния.
В
необратимых процессах в изолированной
системе состояния
меняются так, что их термодинамическая
вероятность, а значит,
и суммарное значение энтропии растет,
ds
> 0. В
обратимых
процессах в изолированной системе любое
состояние является
равновероятным, ds
= 0. В общем случае имеет место принцип
возрастания энтропии — ds
![]() 0. Получен тот же результат,
что и при феноменологическом толковании
энтропии. Таким
образом, возрастание энтропии изолированных
систем указывает
на наиболее вероятное направление
протекания естественных
процессов. Наиболее вероятным является
равновесное
состояние, при котором система будет
иметь максимальное значение
энтропии. При этом не исключается
возможность маловероятных
событий, называемых флуктуациями, когда
ds
< 0 и имеет место несоблюдение второго
закона термодинамики.
0. Получен тот же результат,
что и при феноменологическом толковании
энтропии. Таким
образом, возрастание энтропии изолированных
систем указывает
на наиболее вероятное направление
протекания естественных
процессов. Наиболее вероятным является
равновесное
состояние, при котором система будет
иметь максимальное значение
энтропии. При этом не исключается
возможность маловероятных
событий, называемых флуктуациями, когда
ds
< 0 и имеет место несоблюдение второго
закона термодинамики.
Кстати, мир Земли — мир постоянной энтропии, так как практически всю теплоту, получаемую от Солнца и от земных источников и в том числе за счет необратимых процессов (горение, механическое трение, электрическое сопротивление, теплообмен, ...), наша планета излучает в космос. В результате такого переизлучения энтропии в природе остаются изменения, по которым можно судить об эволюции природы.
