
- •Тема 1. Кинематика материальной точки.
- •Тема 2.
- •Тема 3. Работа и энергия. Динамика твердого тела
- •Тема 4. Основы релятивистской механики
- •Тема 5. Основы молекулярной физики
- •5.7.3. Диффузия
- •Тема 6. Физические основы термодинамики
- •6.1. Основные понятия и определения
- •6.3. Уравнение состояния идеального газа
- •6.4. Первый закон термодинамики
- •6.5. Рабочая диаграмма Pv. Работа — функция процесса
- •6.7. Зависимость теплоемкости от условий подвода теплоты. Уравнение Майера для идеального газа
- •6.7.1. Изохорная теплоемкость
- •6.7.2. Изобарная теплоемкость
- •6.7.3. Уравнение Майера для идеального газа
- •6.8. Расчет изменения внутренней энергии
- •6.9. Формулы и таблицы для истинных и средних теплоемкостей. Определение количества теплоты по теплоемкости и разности температур
- •6.10Молекулярно-кинетическая теория теплоемкости
- •6.11. Обратимые и необратимые термодинамические процессы
- •6.12. Второй закон термодинамики
- •6.13.Энтропия
- •6.14. Некоторые свойства энтропии
- •6.15. Теория «тепловой смерти Вселенной»
- •6.16.Тепловая диаграмма Ts. Теплота —функция процесса
- •6.17. Изменение энтропии идеального газа
Тема 5. Основы молекулярной физики
Лекция 6. Основы молекулярной физики
5.1. Предмет и метод молекулярной физики. Кинетическая теория
Молекулярная физика изучает физические свойства вещества исходя из его атомно-молекулярной структуры, характера теплового движения микрочастиц и действующих между ними сил. Следовательно, предметом статистической физики являются строение, физические свойства твердых, жидких и, в основном, газообразных макротел, а также физические процессы, происходящие в них. Основой этого раздела физики является экспериментально проверенная кинетическая теория строения вещества, в которой количественные закономерности устанавливают статистическим методом, когда рассматриваются только средние значения характеристик совокупности молекул. Последнее обусловлено тем, что свойства огромного числа молекул отличаются от свойств каждой отдельной молекулы. Движение одной какой-нибудь молекулы не характеризует свойств системы. Таким образом, статистический метод исследования основан на том, что свойства системы определяются свойствами микрочастиц системы и усредненными значениями их динамических и энергетических характеристик. Например, температура тела обусловлена скоростью беспорядочного движения молекул. Однако в фиксированный момент времени молекулы имеют различные скорости, что и создает беспорядочность теплового движения. Поэтому температура тела может быть выражена только через средние значения скорости движения молекул. Из изложенного следует вывод о том, что макроскопические характеристики, а в рассмотренном случае — температура, имеют физический смысл для большого числа молекул. Действительно, говорить о температуре одной молекулы просто нельзя.
Итак, суть статистического метода состоит в том, что для изучения системы огромного числа частиц информация должна иметь обобщенный характер и относиться не к отдельным частицам, а к их совокупности. Законы же поведения совокупностей частиц, исследуемые статистическим методом, называют статистическими. Кинетическая теория основана на следующих положениях:
1. Вещество дискретно — оно состоит из атомов, которые образуют комплексы, называемые молекулами.
2. Молекулы взаимодействуют друг с другом с силой, величина которой зависит от расстояния между молекулами.
3. Молекулы находятся в состоянии непрерывного беспорядочного движения.
Существует и другой, противоположный статистическому, метод исследования системы многих частиц, называемый термодинамическим. При таком подходе достаточно использовать понятия и физические величины, относящиеся к системе в целом. Базируется этот метод на сведениях, данных опытом, и не принимает во внимание, как только что было отмечено, микроструктурных факторов системы. Обратим внимание на то, что под системой понимают конечную область пространства с находящимися в ней физическими объектами исследования. Теория термодинамического метода исследования системы строится на общих законах фундаментального или частного характера, например, закон сохранения энергии и соответственно второй закон термодинамики. Такая теория по своему содержанию является феноменологической. Она рассматривает внутренний механизм процессов, определяющих поведение системы в целом, не опирается на определенную модель внутреннего строения ее и не использует математический аппарат теории вероятностей.
Статистический и термодинамический методы познания дополняют друг друга. Термодинамический метод характеризуется своей общностью. Статистический позволяет понять суть явлений через связь поведения системы в целом с поведением ее компонентов. Комбинированное применение этих методов способствует эффективному решению научных проблем.
В науке широко используются модельные представления реальных явлений, процессов, систем и материальных тел. Модель представляет упрощенный вариант реальной структуры. Моделью, например, материального тела является совокупность атомов и молекул, взаимодействующих между собой по некоторым законам и движущихся соответствующим образом. Сами атомы и молекулы могут быть представлены также различными моделями в зависимости от обстоятельств и характера рассматриваемых явлений, то есть в одних случаях их можно считать материальными точками, в других — абсолютно твердыми телами, в третьих — необходимо знание их структуры. Заметим, что квантовая механика дает это знание. Поэтому моделью материального тела является совокупность атомов и молекул с известными свойствами и законами движения и взаимодействия. Примером модели материального газообразного тела, называемого реальным газом, является идеальный газ. Газ, молекулы которого не взаимодействуют друг с другом и имеют размеры много меньше, чем расстояния между ними, называют идеальным. Простота модели идеального газа дает возможность найти простые аналитические зависимости между его физическими параметрами. В состоянии равновесия модель идеального газа характеризуется объемом, давлением и температурой. Конечно, достоверность получаемых при этом соотношений снижается. А степень расхождения в свойствах идеального и реального газов определяется всякий раз конкретными условиями, в которых находится реальный газ. Водород, азот, гелий, воздух и другие газы с малой молярной массой даже при комнатной температуре и давлении до 30 бар ведут себя, как идеальный газ. Поэтому законы идеального газа во многих случаях могут применяться для расчетов с реальным газом.
5.2. Классическая статистика. Статистика Максвелла
С татистический
метод предполагает исследование каждой
молекулы из совокупности большого числа
микрочастиц. Этозначит,
что допускается принципиальная
возможность расчета
поведения отдельно всех молекул по
законам механики и электродинамики.
Для этого достаточно знать начальные
координаты,
массу, скорость микрочастицы и действующие
на нее
силы. Заметим, что в 1 мм3
газа, например, при нормальных
условиях содержится 2,7 - 101е
молекул. Поэтому поведение
каждой из громадного числа взаимодействующих
друг с другом
молекул все же практически не поддается
такому расчету
с использованием современной вычислительной
техники из-за
чрезвычайно большого объема вычислений
и
требуемого
для
этого времени (несколько тысяч лет).
Однако выход из этого
затруднения был найден. Оказывается,
что для изучения свойств
систем и наблюдаемых в них явлений не
требуется конкретного
знания о движении отдельных частиц.
Дело в том, что
движение большого числа частиц приобретает
не свойственные
механическому движению отдельной
частицы качества, указывающие
на наличие особого движения материи —
молекулярно-теплового.
Специфичность теплового движения
микрочастиц
состоит в том, что оно характеризуется
рядом статистических величин, не присущих
отдельным частицам: температурой,
энтропией и др. Эти статистические
характеристики и
сопутствующие
тепловому движению закономерности
теоретически
определяются с использованием Теории
вероятностей через скорость,
энергию, импульс и др. параметры
микрочастиц. Последние
при этом рассматриваются как случайные
величины. Статистический
метод позволяет оценить вероятность
возможных
численных значений этих величин и их
средние значения.
татистический
метод предполагает исследование каждой
молекулы из совокупности большого числа
микрочастиц. Этозначит,
что допускается принципиальная
возможность расчета
поведения отдельно всех молекул по
законам механики и электродинамики.
Для этого достаточно знать начальные
координаты,
массу, скорость микрочастицы и действующие
на нее
силы. Заметим, что в 1 мм3
газа, например, при нормальных
условиях содержится 2,7 - 101е
молекул. Поэтому поведение
каждой из громадного числа взаимодействующих
друг с другом
молекул все же практически не поддается
такому расчету
с использованием современной вычислительной
техники из-за
чрезвычайно большого объема вычислений
и
требуемого
для
этого времени (несколько тысяч лет).
Однако выход из этого
затруднения был найден. Оказывается,
что для изучения свойств
систем и наблюдаемых в них явлений не
требуется конкретного
знания о движении отдельных частиц.
Дело в том, что
движение большого числа частиц приобретает
не свойственные
механическому движению отдельной
частицы качества, указывающие
на наличие особого движения материи —
молекулярно-теплового.
Специфичность теплового движения
микрочастиц
состоит в том, что оно характеризуется
рядом статистических величин, не присущих
отдельным частицам: температурой,
энтропией и др. Эти статистические
характеристики и
сопутствующие
тепловому движению закономерности
теоретически
определяются с использованием Теории
вероятностей через скорость,
энергию, импульс и др. параметры
микрочастиц. Последние
при этом рассматриваются как случайные
величины. Статистический
метод позволяет оценить вероятность
возможных
численных значений этих величин и их
средние значения.
 Вероятность
возможных численных значений случайной
величины
выражается формулой, называемой законом
распределения
данной физической величины. Одной из
задач статистической
физики и является установление законов
распределения
физических величин по всем
Вероятность
возможных численных значений случайной
величины
выражается формулой, называемой законом
распределения
данной физической величины. Одной из
задач статистической
физики и является установление законов
распределения
физических величин по всем
возможным их численным значениям. Иллюстрацией изложенного, то
есть существования определенных закономерностей в распределении
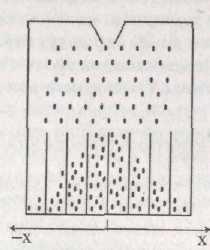
случайных величин, является следующий опыт.
Рис.5.3
Пусть
большое число N
дроби
опускается
через отверстие, расположенное
в середине верхней части
вертикальной
плоскости, на поверхности
которой расположены несколько
тысяч перпендикулярных к
ней стержней. В нижней части плоскости
опытной установки имеются одинаковые
вертикальные желобки (рис. 5.1). Дробинки
в процессе своего движения вниз
испытывают множество столкновений со
стержнями. Движение
дробинок
носит стохастический характер. Как
показывает опыт, распределение дробинок
по желобкам имеет неравномерный
характер. Большая часть попадает в
центральные желобки,
расположенные под отверстием. В крайние
желобки их
попадает меньше (рис. 5.1). Распределение
дробинок по желобкам
имеет практически симметричный характер,
и его называют распределением Максвелла.
Результаты опытов стабильны
в отношении повторяемости по числу
дробинок, попадающих
в определенный желобок. При другом числе
дробинок характер распределения остается
прежним. Если в i-й
желобок
попадает
![]() Ni
дробинок,
то отношение
Ni
дробинок,
то отношение![]() Ni
/N,
показывает,
какая часть дроби от общего числа
попадает в i-й
желобок. Это отношение можно рассматривать
как вероятность попадания
одной дробинки в данный желобок. Поскольку
отношение
Ni
/N,
показывает,
какая часть дроби от общего числа
попадает в i-й
желобок. Это отношение можно рассматривать
как вероятность попадания
одной дробинки в данный желобок. Поскольку
отношение![]() Ni
/N,
зависит
от
ширины
Ni
/N,
зависит
от
ширины
![]() хi
желобка,
то принято вероятность
попадания оценивать относительной
плотностью вероятности
попадания дробинок
в желобок
хi
желобка,
то принято вероятность
попадания оценивать относительной
плотностью вероятности
попадания дробинок
в желобок
![]() Ni/(N
Ni/(N![]() xi
).Диаграмма значений
xi
).Диаграмма значений
![]() Ni/(N
Ni/(N![]() xi
).приведена
на рис. 5.2.
xi
).приведена
на рис. 5.2.
При
![]() x—>0
гистограмма перейдет в плавную кривую,
показанную на рис. 5.2 штриховой линией,
называемую законом распределения или
плотностью вероятности, или плотностью
распределения случайной величины.
x—>0
гистограмма перейдет в плавную кривую,
показанную на рис. 5.2 штриховой линией,
называемую законом распределения или
плотностью вероятности, или плотностью
распределения случайной величины.
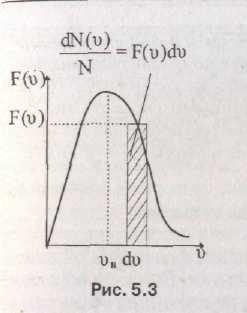
Случайной величиной в рассмотренном опыте является отклонение дробинок х от средней точки х = 0. Закон распределения имеет следующую форму записи F(x) = dN/(Ndx). Формула закона распределения может быть различной для разных случайных величин. В статистической физике определенный интерес представляет закон распределения молекул по скоростям.
Средние скорости молекул некоторых газов и водяного пара в м/с при t = 0°С и Р = 1,013·105 Па равны: водород — 1692, азот — 454, кислород — 425 и водяной пар — 566 м/с. В действительности, однако, существует определенное распределение молекул по скоростям, которое при только что сформулированных условиях выглядит, например, для азота следующим образом:
|
скорость, м/с |
доля числя молекул, имеющих скорость в указанном интервале значений |
|
<100 100-300 300-500 500-700 700-900 >900 |
0.01 0.25 0.42 0.24 0.07 0,01 |
 П
П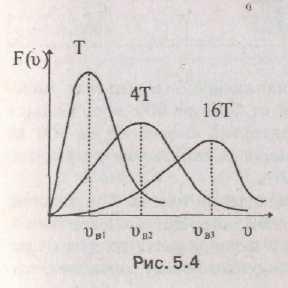 риведенные
данные являются результатом опытов и
теоретических
рассуждений Дж. Максвелла. Дж. Максвелл
считал,
что если газ состоит из очень большого
числа N
молекул,
находящихся в равновесном состоянии
беспорядочного теплового
движения, то в нем устанавливается
стационарное (не меняющееся со временем)
распределение молекул по скоростям,
называемое функцией распределения
молекул по скоростям
F(v)
или
статистикой Максвелла. Если диапазон
скоростей молекул
разбить на бесконечно малые интервалы
dv,
то
на каждый
из них будет приходиться некоторое
число молекул dN(v).
Функция
F(v)
определяет
относительное число молекул dN(v)/N,
скорости
которых находятся в интервале от и до
и + dv,
то
есть F(v)
=
dN(v)/(Ndv).
риведенные
данные являются результатом опытов и
теоретических
рассуждений Дж. Максвелла. Дж. Максвелл
считал,
что если газ состоит из очень большого
числа N
молекул,
находящихся в равновесном состоянии
беспорядочного теплового
движения, то в нем устанавливается
стационарное (не меняющееся со временем)
распределение молекул по скоростям,
называемое функцией распределения
молекул по скоростям
F(v)
или
статистикой Максвелла. Если диапазон
скоростей молекул
разбить на бесконечно малые интервалы
dv,
то
на каждый
из них будет приходиться некоторое
число молекул dN(v).
Функция
F(v)
определяет
относительное число молекул dN(v)/N,
скорости
которых находятся в интервале от и до
и + dv,
то
есть F(v)
=
dN(v)/(Ndv).
Вид функции F(v) для идеального газа был установлен Дж. Максвеллом, которая характеризует распределение относительного числа молекул газа по скоростям в состоянии равновесия,
(5.1)
![]()
где
m
— масса молекулы, кг; к
=
1,3806·10-23
Дж/К — постоянная
Больцмана; Т
—
абсолютная температура, К; и — скорость
молекулы, м/с. Графическое изображение
функции представлено
на рис. 5.3.При
возрастании
![]() множитель
множитель
![]() уменьшается
быстрее,
чем растет множитель
уменьшается
быстрее,
чем растет множитель
![]() 2.
Следовательно, функция F(v),
начинаясь
от нуля, достигает максимума, а затем
асимптотически
стремится к нулю. Кривая распределения
несимметрична
относительно
2.
Следовательно, функция F(v),
начинаясь
от нуля, достигает максимума, а затем
асимптотически
стремится к нулю. Кривая распределения
несимметрична
относительно
![]() в.
Но при достаточно малых значениях
скорости
она станет параболой. Относительное
число молекул dN(v)/N,
скорости
которых находятся в интервале от о до
в.
Но при достаточно малых значениях
скорости
она станет параболой. Относительное
число молекул dN(v)/N,
скорости
которых находятся в интервале от о до
![]() +
+
![]() ,равно
площади F(
,равно
площади F(![]() )d
)d![]() (рис.
5.3). Число молекул в этом интервале
значений скорости остается неизменным.
Иными слова
ми, представленное на рис. 5.3 распределение
оказывается постоянным
во времени. Изменение его для
данного газа возможно при изменении
температуры. С повышением
температуры рассматриваемого
газа скорости молекул растут как
(рис.
5.3). Число молекул в этом интервале
значений скорости остается неизменным.
Иными слова
ми, представленное на рис. 5.3 распределение
оказывается постоянным
во времени. Изменение его для
данного газа возможно при изменении
температуры. С повышением
температуры рассматриваемого
газа скорости молекул растут как
![]() ,
и
естественно, что возрастает при этом и
средняя скорость молекул,
поэтому максимум распределения смещается
в сторону высоких
скоростей (рис. 5.4), а высота
кривой в максимуме понижается. Таким
образом, конкретный вид функции
распределения
зависит от рода газа и его температуры.
Кроме того, общая
площадь, ограниченная кривой распределения
и осью абсцисс, равна единице. Это значит,
что функция F(v)
удовлетворяет
так называемому условию нормировки
,
и
естественно, что возрастает при этом и
средняя скорость молекул,
поэтому максимум распределения смещается
в сторону высоких
скоростей (рис. 5.4), а высота
кривой в максимуме понижается. Таким
образом, конкретный вид функции
распределения
зависит от рода газа и его температуры.
Кроме того, общая
площадь, ограниченная кривой распределения
и осью абсцисс, равна единице. Это значит,
что функция F(v)
удовлетворяет
так называемому условию нормировки
![]()
Из этого условия следует, что площадь, ограниченная кривой распределения и осью абсцисс, для конкретного газа независимо от его температуры остается постоянной. Именно поэтому кривая распределения с ростом температуры растягивается и понижается.
Исследуя
функцию распределения
Максвелла, можно
получить формулы для расчета наиболее
вероятной скорости
молекул
![]() в,
соответствующей максимуму функции
распределения,
и среднюю скорость молекулы. А, исходя
из закона распределения
молекул по скоростям, можно найти
распределение
молекул газа по значениям кинетической
энергии.
в,
соответствующей максимуму функции
распределения,
и среднюю скорость молекулы. А, исходя
из закона распределения
молекул по скоростям, можно найти
распределение
молекул газа по значениям кинетической
энергии.
И последнее, из графического изображения функции распределения очевидно, что число молекул с малыми и большими скоростями незначительно и что большинству молекул характерны скорости, близкие к наиболее вероятной скорости.
Чтобы
наглядно представить себе смысл наиболее
вероятной
скорости и распределения молекул по
скоростям, рассмотрим
еще один пример. В некотором объеме
содержится 10е
молекул
при О °С, движущихся с различными
скоростями. Распределение
числа
![]() молекул по скоростям представлено ниже.Весь
диапазон скоростей разбит на интервалы
молекул по скоростям представлено ниже.Весь
диапазон скоростей разбит на интервалы
![]() —
100
м/с.
—
100
м/с.
Таблица 5.1
Распределение молекул по скоростям
|
|
|
|
|
0-100 |
14 000 |
1.4 |
|
100-200 |
81 000 |
8.1 |
|
200-300 |
165000 |
16.5 |
|
300-400 |
214000 |
21.4 |
|
400-500 |
206000 |
20.6 |
|
500-600 |
151000 |
15.1 |
|
600-700 |
92 000 |
9.2 |
|
700-800 |
48 000 |
4.8 |
|
800-900 |
20 000 |
2.0 |
|
900-1000 |
6 000 |
0,6 |
|
>1000 |
3000 |
0.3 |
|
Всего |
10б |
100 |
Как видно из табл. 5.1, подавляющее большинство молекул имеют скорость в пределах от 200 до 600 м/с. Больше всего молекул приходится на интервал скоростей от 300 до 400 м/с. Наиболее вероятная скорость заключена в этом интервале и равна при О "С * 377 м/с.
И еще об одном, в порядке подведения итогов. Статистические законы распределения, основой которых являются массовость и случайность, применяются в науке, в различных отраслях хозяйства, экономике, вопросах массового обслуживания и т.д.
5.3. Давление. Основное уравнение кинетической теории газов
Хаотическое движение молекул связано с тепловым состоянием тела. В процессе движения молекулы газа ударяются о стенки сосуда. Из-за множества молекул ограждающие газ поверхности воспринимают их удары как действие непрерывной, постоянной и нормально направленной силы. Отнесенная к единице площади сила представляет собой давление газа. На величину давления не влияет ориентация поверхности, на которую давит газ. Обусловлено это беспорядочностью теплового движения молекул, при котором ни одно из направлений не имеет преимущества. Таким образом, давление есть результат силового действия молекул на стенки сосуда. Следует ожидать, что сила удара, а значит, и давление зависят от скорости или кинетической энергии поступательного движения молекул.
Основное
уравнение кинетической теории выражает
зависимость давления концентрации
молекул и идеального газа от среднего
значения кинетической энергии теплового
движения молекул.
Рассмотрим одноатомный идеальный газ,
например, в
цилиндре двигателя внутреннего сгорания
(рис. 5.5) длиной
![]() ,
м,
где
,
м,
где
![]() — скорость молекул газа, м/с;t
— время,
с. Допустим,
что число упругих соударений хаотически
движущихся
молекул газа массой m
между собой значительно меньше числа
упругих ударов о стенку неподвижного
поршня площадью
s,
м2.
Допущение
об упругих
соударениях
молeкул
между собой
и с поверхностью
поршня
предполагает
возможность
изменения
только направления их движения, но не
значений скорости.
В цилиндре с концентрацией молекул п
=
— скорость молекул газа, м/с;t
— время,
с. Допустим,
что число упругих соударений хаотически
движущихся
молекул газа массой m
между собой значительно меньше числа
упругих ударов о стенку неподвижного
поршня площадью
s,
м2.
Допущение
об упругих
соударениях
молeкул
между собой
и с поверхностью
поршня
предполагает
возможность
изменения
только направления их движения, но не
значений скорости.
В цилиндре с концентрацией молекул п
=
![]() м-3
находится
N
= nsvt
молекул,
каждая из которых обладает импульсом
м-3
находится
N
= nsvt
молекул,
каждая из которых обладает импульсом
![]()
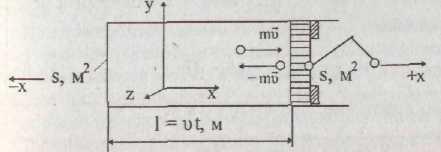
Рис. 5.5
Вследствие упругого соударения с поршнем молекула изменяет направление скорости на противоположное. Изменение импульса одной молекулы равно
![]() .А
сила, с которой молекула действует на
поршень,
.А
сила, с которой молекула действует на
поршень,
![]() Па
Па
С целью упрощения расчетов хаотическое движение молекул рассмотрим как движение по трем направлениям пространства. Следовательно, в любой момент времени вдоль каждой оси движется 1/3 молекул, причем, половина молекул — 1/6, движется вдоль конкретного направления в одну сторону, половина — в диаметрально противоположную. С учетом этого число ударов молекул, движущихся в заданном направлении, о неподвижный поршень равно 1/6(nsvt). При соударениях эти молекулы передадут поршню импульс
![]() Н
Н![]()
Результатом силового ударного воздействия молекул на поршень является давление
![]() Па
(5.2)
Па
(5.2)
Так
как в цилиндре объемом V
=
svt,
м3
содержится N
молекул
газа со скоростями
![]() то
следует в расчетахиспользовать
среднестатистическую скорость, называемую
средней
квадратичной
то
следует в расчетахиспользовать
среднестатистическую скорость, называемую
средней
квадратичной![]() ,
м/с. С учетом этого формула
(5.2) примет вид
,
м/с. С учетом этого формула
(5.2) примет вид
![]() ,Па
(5.3)
,Па
(5.3)
или, принимая во внимание, что n=N/V, м -3,

Преобразуя
последнее равенство, получим основное
уравнение
кинетической теории газов:![]()
или
в виде![]() (5.4)
(5.4)
где <Ек> — средняя кинетическая энергия поступательного движения молекул газа, Дж.
Давление позволяет оценить запас потенциальной энергии сжатой упругой среды, определяет ее возможность производить механическое воздействие. Для измерения давления используют разные единицы. Применяемая в России международная система СИ требует измерения давления в Па. 1 Па - давление, вызываемое силой в 1 Н (1 кгс «= 9,81 Н), равномерно распределенной по поверхности площадью 1 м2. Распространение имеет единица давления в технической системе — кГ/ м2. Как первая, так и вторая единица неудобны тем, что очень малы. На практике применяют более крупные единицы:
105Па = 1 бар = 750 мм рт. ст.;
106 Па = 1 МПа;
104 кГ/м2 =1кГ/см2.
Наряду с этими единицами имеют применение и другие. Соотношения между наиболее используемыми единицами измерения давления:
1
техн. атм. = 1 ата =1 кГ/см2
=1*104![]() кГ/м2
= 0,98105
Па = 980 гПа =
0,98 бар = 735 мм рт.ст. = 10 м вод.ст.; 1 физ.
атм. = 1 ат = 1,033 кГ/см2-
1,033-104
кГ/м2
=1,013*105
Па
= 1013 гПа =
1,013 бар =760 мм рт.ст. = 10,33м вод.ст.
кГ/м2
= 0,98105
Па = 980 гПа =
0,98 бар = 735 мм рт.ст. = 10 м вод.ст.; 1 физ.
атм. = 1 ат = 1,033 кГ/см2-
1,033-104
кГ/м2
=1,013*105
Па
= 1013 гПа =
1,013 бар =760 мм рт.ст. = 10,33м вод.ст.
В некоторых случаях приборы, измеряющие давление, дают показания избыточного (манометрического) давления РИ (PМ) относительно атмосферного — барометрического Pб. Такие приборы называют манометрами. Абсолютное давление Ра в этом случае Ра = Ри + Рб.
Для измерения давления ниже атмосферного используются вакуумметры, которые показывают разность между барометрическим давлением Pб и абсолютным Ра, — так называемый вакуум или разряжение Рв = Pб- Pа . Заметим, что абсолютное и барометрическое давления отсчитываются от нуля.
В практике физических исследований и эксплуатации технических устройств приходится измерять давления в диапазоне от 10-10 до 1011 Па. В различных интервалах давлений пользуются различными методами его измерения. Манометры разделяют на две категории. К первой категории относятся приборы, называемые первичными, которые непосредственно измеряют давление как величину, равную отношению силы к площади. Манометры другой категории измеряют не непосредственное давление, а некоторую связанную с давлением величину. Общие особенности измерения давлений в различных интервалах следующие. В области низкого давления, примерно < 100 Па, используются в основном ионизационные и термоэлектрические вторичные манометры. Для измерения давлений, близких к атмосферному, используются жидкостные манометры в виде U-образных трубок. Манометры для измерения атмосферного давления называют барометрами. Для измерения больших давлений применяются поршневые и вторичные манометры Бурдона. В манометре Бурдона используется эффект относительного движения концов изогнутой трубки при повышении давления в ее полости.
5.4. Температура — мера средней кинетической энергии микрочастиц
Есть основания полагать, что не только давление, но и другая макроскопическая характеристика состояния газа — температура, тоже зависит от кинетической энергии теплового движения микрочастиц.
Не вызывает сомнения, что при смешении газов с разной температурой в результате теплообмена среды придут в состояние теплового равновесия. Что же касается их средних кинетических энергий, то наступление теплового равновесия соответствует также установлению и энергетического равновесия. Это значит, что средняя кинетическая энергия молекул идеального газа связана с его температурой, определяет эту температуру и, следовательно, может служить мерой температуры. Очевидна справедливость и обратной причинно-следственной связи. С целью выяснения количественного соотношения между температурой газа и его кинетической энергией проведем следующие рассуждения.
В идеальном газе отсутствует потенциальная составляющая внутренней энергии. Энергия молекул такого газа состоит только из кинетической энергии поступательного и вращательного движений. Определение каждой из компонент кинетической энергии микрочастицы связано с понятием числа ее степеней свободы. Числом степеней свободы тела называют число независимых координат, устанавливающих положение его в пространстве.
Риc
5.6
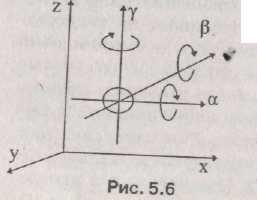 Перемещение,
например, микрочастицы
можно характеризовать тремя
поступательными движениями вдоль
трех осей прямоугольной системы
координат и тремя вращательными
движениями вокруг трех взаимно
перпендикулярных осей, проходящих
через центр массы молекулы
(рис. 5.6), то есть положение молекулы
в пространстве определяется
тремя линейными х,
у, zи
тремя угловыми
Перемещение,
например, микрочастицы
можно характеризовать тремя
поступательными движениями вдоль
трех осей прямоугольной системы
координат и тремя вращательными
движениями вокруг трех взаимно
перпендикулярных осей, проходящих
через центр массы молекулы
(рис. 5.6), то есть положение молекулы
в пространстве определяется
тремя линейными х,
у, zи
тремя угловыми
![]() координатами.
Таким образом, число степеней свободы
ее равно шеcти
и состоит из трех поступательных и трех
вращательных степеней
свободы.
координатами.
Таким образом, число степеней свободы
ее равно шеcти
и состоит из трех поступательных и трех
вращательных степеней
свободы.
Любые ограничения движения тела приводят к уменьшению числа степеней свободы. Рассмотрим изложенное на примерах. Движению вращающегося шара на плоскости соответствует пять степеней свободы: две поступательных и три вращательных. Железнодорожному вагону — одна, а его колесу — две: одна поступательная и одна вращательная.
Д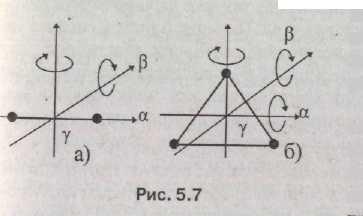 ля
молекулы одноатомного газа число
степеней свободы равно трем, так как
для определения ее положения в
пространстве
достаточно знать только линейные
координаты. Это утверждение
основано на представлении о том, что
вращение молекулы
вокруг собственных осей не изменяет ее
положения в
пространстве. Молекула двухатомного
газа представляет собой
совокупность жестко связанных между
собой химически двух атомов (рис. 5.7). У
каждого из них есть возможность вращения
относительно друг друга. Поэтому
двухатомная молекула
имеет пять степенней свободы: три
поступательные и две вращательные.
Трех- и более атомные молекулы имеют
шесть
степеней свободы.
ля
молекулы одноатомного газа число
степеней свободы равно трем, так как
для определения ее положения в
пространстве
достаточно знать только линейные
координаты. Это утверждение
основано на представлении о том, что
вращение молекулы
вокруг собственных осей не изменяет ее
положения в
пространстве. Молекула двухатомного
газа представляет собой
совокупность жестко связанных между
собой химически двух атомов (рис. 5.7). У
каждого из них есть возможность вращения
относительно друг друга. Поэтому
двухатомная молекула
имеет пять степенней свободы: три
поступательные и две вращательные.
Трех- и более атомные молекулы имеют
шесть
степеней свободы.
Согласно теореме Л, Больцмана о равнораспределении энергии по степеням свободы, на каждую степень свободы поступательного и вращательного движений молекул идеального газа приходится одна и та же средняя кинетическая энергия, равная 0,5 кТ, где к = 1,3806*10 -23 Дж/К — постоянная Больцмана. Полная кинетическая энергия молекулы, имеющей i степеней свободы, равна Еk = 0,5 ikT, Дж.
Для идеального газа любой атомности число степеней свободы поступательного движения молекул всегда равно трем. Поэтому средняя кинетическая энергия поступательного движения каждой из молекул пропорциональна температуре и равна
![]()
![]() (5.5)
(5.5)
Таким образом, средняя кинетическая энергия молекул является функцией температуры и не зависит от массы молекул. Из уравнения (5.5) очевиден смысл молекулярно-кинетического определения температуры
Т
=![]() ,
,
как меры средней кинетической энергии молекул, а абсолютная шкала температур приобретает непосредственный физический смысл. Согласно формуле
![]() ,
,
при
абсолютном нуле поступательное движение
молекул должно
прекратиться. Основное уравнение
кинетической теории идеального
газа можно преобразовать, подставляя
значение
![]() в
формулу(5.4), к видуР
=
пкТ,
Па.
в
формулу(5.4), к видуР
=
пкТ,
Па.
Предположение, сделанное при выводе основного уравнения кинетической теории о том, что молекулы совершают только поступательное движение, не выполняется при низких температурах, так как газ переходит в конденсированную фазу. Следовательно, теряют смысл выводы кинетической теории идеального газа. Заметим, что современная наука с позиций квантовой механики теоретически рассматривает абсолютный нуль как особое состояние материи, при котором существуют некоторые виды движений. Что же касается отрицательных температур, то их, наверное, быть не может, так как кинетическая энергия есть величина положительная. Последний вывод следует из предположения об идеальности газа, которого, как только что было отмечено, и быть не может в окрестности абсолютного нуля. Так вот, абсолютная температура как величина только положительная рассматривалась до 1951 г. Появление оптических квантовых генераторов и эксперименты, связанные с их разработкой, в частности М. Парселла и Р. Паунда, выполненные в Гарвардском университете, заставили научную общественность пересмотреть привычные представления. Вопрос этот сложен. Отметим только, что с позиции теоретико-экспериментальных представлений по данному вопросу отрицательные температуры вплоть до - ее могут иметь место в случае инверсии за-селенностей верхних энергетических уровней. Но при этом необходимо соблюдение еще одного условия — времени установления равновесия между электронами и окружающей частью системы в целом, то есть кристаллической решеткой.
Физическим параметром является термодинамическая температура Т. Термодинамическая температурная шкала устанавливается на основе известных из курса физики свойств цикла Карно и поэтому не зависит от свойств вещества, используемого для измерения температур. При этом используется единственная экспериментально определяемая реперная, то есть опорная, точка, каковой является тройная точка химически чистой воды. Тройной точке воды соответствует такое состояние, иначе говоря, такие значения температуры и давления, при которых в термодинамическом равновесии находятся три агрегатных состояния — лед, жидкая вода и пар. Этому состоянию присваивается температура 273,16 К (0,01 С). Другой точкой является температура абсолютного нуля — ОК. На этом основании определяется размер кельвина. Кельвин — это 1/273,16 часть термодинамической температуры тройной точки воды.
Итак, термодинамическая температурная шкала (ее называют также абсолютной) характеризуется тем, что нулевая точка этой шкалы представляет собой наинизшую термодинамически возможную, но недостижимую температуру. Эта точка называется абсолютным нулем. Между температурой по термодинамической температурной шкале, выраженной в Кельвинах, и градусами Цельсия имеет место соотношение Т = t + 273,15, К, из которого следует, что абсолютный нуль равен —273,15 С.
Кроме того, применяются и другие температурные шкалы: Фаренгейта tф = 1,8 t + 32,°Ф;
Ренкина t Ra = 1,8 (t + 273,15),°Ra;
Реомюра tR = 0,8 t,°R.
Задача измерения температур сводится к исследованиям изменения физических свойств веществ с температурой. Приборы измерения температуры называют термометрами. Их разделяют на первичные и вторичные. Первичные термометры громоздки и сложны в пользовании. Это обусловлено тем, что в качестве термометрического тела в них используются близкие к идеальным разреженные газы, а в качестве термодинамической ведичины — давление. Поэтому газовые термометры, как правило, служат для калибровки и поверки вторичных термометров. Измерение температур первичными термометрами возможно в диапазоне от нескольких Кельвинов до температур свыше тысячи Кельвинов.
Из
вторичных термометров достаточно
распространены жидкостные
термометры (спиртовые, ртутные), термометры
сопротивления,
термопарные элементы и пирометры.
Жидкостные термометры
используются в интервале температур —
200-600 С. Например,
термометры на пентане позволяют
произвести измерение температур от
- 200 до 20
![]() С,
а ртутные термометры — от-
38,87 до 600
С,
а ртутные термометры — от-
38,87 до 600
![]() С.
В термометрах сопротивления используется
зависимость
омического сопротивления проводников
и полупроводников
от температуры. В качестве термометрического
элемента
в них используется платина (- 200—1100
С.
В термометрах сопротивления используется
зависимость
омического сопротивления проводников
и полупроводников
от температуры. В качестве термометрического
элемента
в них используется платина (- 200—1100![]() С), бронза, графит
и другие проводники. Сопротивление
полупроводников с ростом
температуры в противоположность
проводникам уменьшается
с темпом на порядок выше, чем скорость
изменения сопротивления
у металлов. Поэтому термометры на
полупроводниках
весьма чувствительны, и называют их
термисторами. Измерение
температуры с помощью термопар сводится
к измерению разности потенциалов в
электрической цепи, состоящей
из двух разнородных проводников. Диапазон
измеряемых
температур значителен. Так, например,
платино-платинородиевая
термопара используется в интервале
0—1700
С), бронза, графит
и другие проводники. Сопротивление
полупроводников с ростом
температуры в противоположность
проводникам уменьшается
с темпом на порядок выше, чем скорость
изменения сопротивления
у металлов. Поэтому термометры на
полупроводниках
весьма чувствительны, и называют их
термисторами. Измерение
температуры с помощью термопар сводится
к измерению разности потенциалов в
электрической цепи, состоящей
из двух разнородных проводников. Диапазон
измеряемых
температур значителен. Так, например,
платино-платинородиевая
термопара используется в интервале
0—1700![]() С,
а хромель-алюмелевая
— 200—1350
С,
а хромель-алюмелевая
— 200—1350![]() С. В практике измерения температур
используются также медь-константановые,
хромель-копелевые
и другие термические пары.
С. В практике измерения температур
используются также медь-константановые,
хромель-копелевые
и другие термические пары.
При
измерении высоких температур от 1500![]() С
и выше используются термометры, у
которых в качестве термического тела
используется вещество, температуру
которого надо измерить,
а в качестве термической величины —
излучаемая телом электромагнитная
энергия. Законы теплового излучения
тщательно
изучены и позволяют по излучению тела
сделать заключение о его температуре.
Такие термометры называют оптическими
пирометрами. Например, температуру в
доменной печи измеряют
пирометром по цвету пламени. И делают
это следу-
ющим
образом. Глядя в пирометр, регулируют
электрический ток, проходящий через
расположенную в пирометре нить на-icasa
так, чтобы ее яркость совпала с яркостью
пламени в печи. Затем
определяют температуру по шкале.
С
и выше используются термометры, у
которых в качестве термического тела
используется вещество, температуру
которого надо измерить,
а в качестве термической величины —
излучаемая телом электромагнитная
энергия. Законы теплового излучения
тщательно
изучены и позволяют по излучению тела
сделать заключение о его температуре.
Такие термометры называют оптическими
пирометрами. Например, температуру в
доменной печи измеряют
пирометром по цвету пламени. И делают
это следу-
ющим
образом. Глядя в пирометр, регулируют
электрический ток, проходящий через
расположенную в пирометре нить на-icasa
так, чтобы ее яркость совпала с яркостью
пламени в печи. Затем
определяют температуру по шкале.
Создан также акустический термометр для определения температуры воздуха на высотах до 3 км. Он состоит из источника звука и доплеровского радара, измеряющего изменение скорости звука с температурой.
При температуре в области 1 К обычные термометрические величины — давление, омическое сопротивление и др., «не работают», а уравнивание температур измеряемой среды и термического тела при их контакте происходит очень медленно.
Итак, температура характеризует тепловое состояние тела. Она является единственным термодинамическим параметром, определяющим направление самопроизвольного теплообмена. Если между телами или элементами тел не происходит самопроизвольный переход теплоты, то такие тела или элементы тел находятся в тепловом равновесии друг с другом, и температуры этих тел одинаковы.
5.5. Барометрическая формула для изотермической атмосферы
Из уравнений Р = пкТ и Р0 = п0 кТ следует, что n = Р/(кТ), а по = P0/(kT), и распределение Больцмана позволяет установить взаимосвязь давления идеального газа при Т — const с потенциальной энергией его молекул:
Р « P0exp(-mgh/kT), Па,
где
Ро
и P
—
давление воздуха на поверхности океана
и соответственно
на высоте h
в
случае изотермической атмосферы.
Преобразуем
полученное соотношение, заменив m/k
=
mNA/kNA
= =
![]() ,
кгК/Дж, где NA
=
6,022*1023
моль -1
— число Авогадро; тNА=
,
кгК/Дж, где NA
=
6,022*1023
моль -1
— число Авогадро; тNА=![]() —
молярная масса воздуха, кг/моль; kNA
=
1,3806*10 -23
*6,02 *1023
= 8,314Дж/(моль*К)
=
—
молярная масса воздуха, кг/моль; kNA
=
1,3806*10 -23
*6,02 *1023
= 8,314Дж/(моль*К)
=
![]() — универсальная
газовая постоянная; R
—
индивидуальная газовая постоянная,
Дж/(кг*К). С учетом преобразования
предыдущую
формулу перепишем в форме
— универсальная
газовая постоянная; R
—
индивидуальная газовая постоянная,
Дж/(кг*К). С учетом преобразования
предыдущую
формулу перепишем в форме
(5.8)
Р = P0 exp(~gh/RT), Па.
Выражение (5.8) называют барометрической формулой, так как с ее помощью можно найти высоту поднятия летательного аппарата над поверхностью Земли по измеренным давлениям Р и Р0. Последнее используется в авиации. Конкретно — в высотомерах, называемых еще альтиметрами, и приборах для определения высоты над водной поверхностью.
Воздух
в основном состоит из азота и кислорода.
Как известно
из предыдущего материала, соотношение
компонент, а соответственно, и соотношение
парциальных давлений меняются
с высотой. Однако изменение это
несущественно, поскольку
молярные массы азота и кислорода близки
друг к другу по величине.
Поэтому настоящая оговорка имеет всего
лишь теоретический смысл, и воздушную
смесь вполне можно рассматривать
как
один газ со средней молярной массой.
Уместно здесь вспомнить
о часто используемом законе Дальтона.
Закон Дальтона
утверждает, что давление смеси газов
является аддитивной
характеристикой и равно сумме парциальных
давлений ее компонентов,
то есть Р
=![]() ,
Па.
,
Па.
Учитывая,
что т/(кТ)
=
mn0/(nokT)
=
mN0(VoP0
)=
![]() 0Po,
кг/Дж,
где
0Po,
кг/Дж,
где
![]() Po
—
плотность и давление воздуха при h0=
0, барометрическую
формулу для изотермической атмосферы
можно
записать в виде
Po
—
плотность и давление воздуха при h0=
0, барометрическую
формулу для изотермической атмосферы
можно
записать в виде
Р = Ро ехр(- ro gh/ P0 ),Па.
Если P0=101,325 кПа и h измеряется в км, то барометрическую формулу при Т =273,15 К удобно использовать в виде
Р =101,3 exp(-h / 7,99), кПа.
В реальных условиях температура с высотой на некотором участке ее уменьшается, и это делает более зависимым давление от высоты. При некоторых средних условиях, соответствующих среднему давлению Р и средней температуре Т = 288 К на уровне моря, в качестве международной барометрической формулы принимается вплоть до высоты 11000 м
Р = 101,3(1 - 6,5h/288)5,255, Па, где Р — давление, кПа; h — высота, км.
5.6. Распределение молекул газа в поле силы тяжести. Статистика Больцмана
Концентрация молекул в состоянии теплового равновесия и при отсутствии внешних сил будет одинаковой во всех частях располагаемого объема. Если же газ находится в гравитационном поле, то молекулы будут смещаться в сторону действия силы тяжести. Движению молекул в этом направлении, однако, будет препятствовать беспорядочность их теплового движения. Таким образом, возникают противоположные тенденции в движении микрочастиц, результатом которых является установление в силовом поле неравномерного распределения молекул газа по высоте. Концентрация молекул, а следовательно, и плотность газа больше там, где меньше потенциальная энергия его молекул. Теперь ясно, почему воздух, окружающий планету Земля, не разлетается по мировому пространству в результате бесчисленных столкновений молекул друг с другом. Его удерживает земное притяжение. Оно-то и нарушает упомянутое только что равномерное распределение молекул по высоте. Но, с другой стороны, если бы не тепловое движение молекул, то все они под действием гравитации «упали» бы на Землю. Закон распределения концентрации молекул идеального газа в поле сил, работа которых не зависит от траектории перехода системы из начального состояния в конечное, и называемого потенциальным, установлен Л. Больц-маном. Кстати, такие силы принято называть консервативными. К ним относят гравитационные и электростатические силы. Вывод закона распределения молекул газа, сделанный Л. Боль-цманом, сложен, и поэтому рассмотрим упрощенный частный вариант вывода.
 Итак,
рассмотрим количественное распределение
молекул воздуха как однородной системы
в гравитационном поле Земли.
Сила тяготения, действующая на каждую
из молекул, зависит, прежде всего, от
высоты h
над поверхностью Земли
Итак,
рассмотрим количественное распределение
молекул воздуха как однородной системы
в гравитационном поле Земли.
Сила тяготения, действующая на каждую
из молекул, зависит, прежде всего, от
высоты h
над поверхностью Земли
F
=
G![]() ,
Н, где G
=
6,672*10-11,
м3/(кг*с2)
— гравитационная
постоянная, т1
и
т2
—
масса молекулы и масса Земли,
кг, R
— радиус
Земли, м.
,
Н, где G
=
6,672*10-11,
м3/(кг*с2)
— гравитационная
постоянная, т1
и
т2
—
масса молекулы и масса Земли,
кг, R
— радиус
Земли, м.
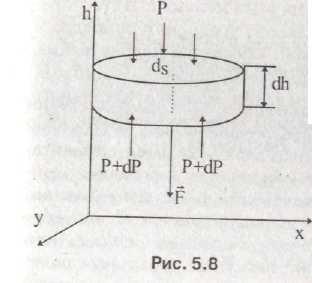
Если допустить, что на высоте h на все молекулы N в пределах бесконечного малого объема dV ,например, цилиндра соснованием площадью ds и высотой dh (рис. 5.8), действует одинаковая по величине и направлению сила F, то суммарная сила поля тяготения равна
![]()
где п = N/V, м -3 — концентрация молекул в элементарном объеме dV, м3. Поскольку воздух находится в динамическом равновесии относительно действующих на его молекулы сил, тогда сила тяготения оказывается уравновешенной действием силы давления со стороны окружающего объем dV, м3 воздуха, что возможно при разности давлений (Р + dP) - Р, Па, вдоль оси h. Действительно, из опыта известно, что атмосферное давление уменьшается при подъеме над поверхностью Земли. Результирующая сила давления на элемент атмосферы объемом dV, м3 по вертикали будет также элементарной и равной dPds, Н. Условие равновесия сил выражается равенством FndV = dPds => Fndhds = dPds => Fndh = dP, Па. Произведение Fdh, Дж, равно элементарной работе силы тяготения при перемещении одной молекулы на расстояние dh, м. И поскольку в потенциальном поле элементарная работа равна изменению потенциальной энергии молекулы, взятому с противоположным знаком, то Fdh = - dEn, Дж. Следовательно,
-ndEп = dP, Па. (5.6)
Поскольку в объеме dV, м 3, Т = const, то согласно основному уравнению кинетической теории Р = пкТ, Па, бесконечно малое изменение давления
(5.7)
dP=kTdn, Па,
прямо пропорционально бесконечно малому изменению концентрации молекул. Сопоставляя равенства (5.6) и (5.7), получим
- ndEn = kTdn, Па.
Откуда dn/n = - dEп(kT). Знак «минус* означает уменьшение концентрации молекул воздуха с увеличением высоты, а следовательно, и потенциальной энергии молекул. Интегрирование полученного дифференциального уравнения приводит к равенству ln п = - dEп(kT) + const. Обозначив концентрацию молекул на поверхности океана при h = 0, когда Еп = mgh = 0, через nо, получим закон распределения молекул идеального газа в любом потенциальном силовом поле, называемый распределением или статистикой Л. Больцмана,
![]() или
или
п = noexp(-mgh/kT), м - 3.
И з
закона Больцмана очевидно, что в
потенциальном силовом поле молекулы
воздуха распределяются так, что их
концентрация
максимальна в области, где потенциальная
энергия
молекул минимальна (рис. 5.9), Концентрация
молекул зависит
от массы молекул, то есть
от рода газа. Медленнее изменяется
по высоте концентрация
газов с меньшей массой молекул.
В связи с этим следует отметить,
что с ростом высоты соотношение между
компонентами
воздуха будет сдвигаться в
сторону увеличения содержания
легких газов. Однако подобное
поведение составляющих воздушной
атмосферы, как показали опыты,
Рис.5.9 наблюдается на
высоте
более 100 км.
з
закона Больцмана очевидно, что в
потенциальном силовом поле молекулы
воздуха распределяются так, что их
концентрация
максимальна в области, где потенциальная
энергия
молекул минимальна (рис. 5.9), Концентрация
молекул зависит
от массы молекул, то есть
от рода газа. Медленнее изменяется
по высоте концентрация
газов с меньшей массой молекул.
В связи с этим следует отметить,
что с ростом высоты соотношение между
компонентами
воздуха будет сдвигаться в
сторону увеличения содержания
легких газов. Однако подобное
поведение составляющих воздушной
атмосферы, как показали опыты,
Рис.5.9 наблюдается на
высоте
более 100 км.
5.7. Кинетические явления: теплопроводность, вязкость, диффузия
Макросистему, в которой поле любого из потенциалов однородно, называют равновесной. В такой системе, отсутствуют перепады физических параметров. В противном случае, когда имеет место неравномерность распределения хотя бы одной физической величины, состояние макросистемы характеризуется как неравновесное. Когда система не изолирована, то можно говорить о равновесном или неравновесном состоянии ее по отношению к окружающей среде. Если система неравновесная, например, в тепловом отношении, относительно среды, то в реальных условиях процесс перехода системы из неравновесного состояния в состояние равновесия с окружающей средой является необратимым. Необратимость процесса обусловлена энергетическими потерями. Реальные процессы необратимы. Неоднородность системы в процессе необратимого взаимодействия с окружающей средой исчезает. Если же внешний источник энергетического воздействия есть, то неоднородность, а следовательно, и неравновесность системы поддерживается неизменной и перенос определенной физической величины или величин будет непрерывным. Необратимые процессы теплопроводности, диффузии и внутреннего трения называют явлениями переноса. Внутреннее трение называют еще вязкостью. В этих явлениях происходит пространственный перенос теплоты, вещества и количества движения. Наблюдаются эти явления в твердых телах, жидкостях и газах, находящихся в неравновесном состоянии. Поскольку до сих пор мы «находимся» в молекулярной физике, то основной интерес для нас представляют газы, как среда, в которой будут рассмотрены явления переноса. В газах теплота переносится с помощью микрочастиц, аналогично переносу вещества диффузией и переносу количества движения при вязком трении. Внутренний механизм явлений переноса один — тепловое движение микрочастиц, направленное в сторону меньшего потенциала. Результатом его могут быть конвективные потоки микрочастиц. Тепловое движение может также сопровождаться излучением электромагнитной энергии микрочастицами. Подобные процессы переноса вещества и теплоты ведут к выравниванию температур. А перенос количества движения обусловлен неизбежным столкновением микрочастиц при этом. Таким образом, явлениями переноса называют процессы, возникающие при нарушении теплового равновесия макросистем, сопровождаемые переносом определенной физической величины и обусловленные тепловым движением микрочастиц, составляющих систему. Единством внутреннего механизма этих явлений объясняется внешнее сходство математического описания указанных процессов переноса,
5.7.1. Теплопроводность
Теория теплопередачи, или теплообмена, излагает современные представления о процессах распространения теплоты в пространстве с неоднородным полем температур. Существует три вида теплообмена: конвекция, тепловое излучение и теплопроводность.
Конвекция осуществляется путем перемещения в гравитационном пространстве неравномерно нагретых объемов среды. Перенос теплоты при этом неразрывно связан с переносом вещества.
Тепловое излучение Связано с пространственным обменом энергией между телами с помощью электромагнитных волн. Теплопроводность определяется тепловым движением микрочастиц с различной кинетической энергией.
В природе и технике чаще всего перенос теплоты осуществляется одновременно тремя способами. Такой совместный процесс переноса теплоты называют сложным теплообменом. Частным, но весьма распространенным случаем сложного теплообмена является теплоотдача — конвективный теплообмен между твердой поверхностью и движущейся средой. Конвективный теплообмен сопровождается переносом вещества, называемым массообменом. Совместное протекание процессов теплообмена и массообмена называют тепломассообменом. Кстати, при нулевой гравитации конвекция будет отсутствовать. И свеча будет гореть медленно, а пламя будет иметь форму шара. Цвет пламени также изменится от желтого до чисто голубого.
Явление теплопроводности в чистом виде имеет место в твердых телах, а в газах и жидкостях только при условии невозможности возникновения в них конвективных потоков. Реально такие условия могут соблюдаться при температурном перепаде примерно в один градус и в тонких газожидкостных прослойках. В металлах основным, но не единственным носителем теплоты, являются свободные электроны, а в жидкостях и диэлектриках передача теплоты осуществляется в основном фонолами, то есть упругими колебаниями кристаллической решетки. Теория теплопроводности использует термодинамический метод исследования, когда вещество рассматривается как сплошная среда, отвлеченно от его атомно-молекулярной структуры. Передача теплоты теплопроводностью имеет место при наличии разности температур. Совокупность значений температур всех точек тела в конкретный момент времени называют температурным полем. Математически температурное поле записывается уравнением вида: Т = f(x, у, z, t), где Т — температура тела, К; х, у, z — координаты точки, м; t — время, с. Такое поле называют нестационарным, а соответствующий ему процесс теплопроводности — неустановившимся. Если же распределение температур не изменяется во времени, то температурное поле называют стационарным, и тогда Т = f(x, у, z), dT/dt = 0. Температура может быть функцией одной, двух и трех координат, а поле соответственно этому - одно-, двух- и трехмерным. Наиболее простым, с точки зрения исследования и математического описания, является одномерное стационарное температурное поле: Т = f(x), dT/dt =0, дТ/ду = дТ/dz =0.
Если соединить в рассматриваемом веществе все точки с одинаковой температурой, то получаемую при этом поверхность Т = const, называют изотермической. Так как конкретная точка в фиксированный момент времени может иметь только одно значение температуры, то понятно, что изотермические поверх- ности не пересекаются. Они либо замыкаются на себя и могут быть сферическими, цилиндрическими и более сложными, либо заканчиваются на границе тела. Интенсивность изменения температуры в направлении х характеризуется производной дТ/дх, К *м - 1, принимающей наибольшее значение по нормали к данной изотермической поверхности дТ/дп = qradT, К*м-1(рис. 5.11). Вектор qrad T называют температурным градиентом. Он характеризует максимальное изменение температуры между изотермическими поверхностями. Направлен в сторону возрастания температуры и противоположную вектору плотности теплового потока q .
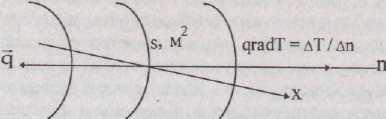
Рис.
5.10
 ысказанной
в первой
трети XIX
столетия,
плотность теплового
потока
ысказанной
в первой
трети XIX
столетия,
плотность теплового
потока
![]() прямо
пропорциональна
градиенту
температуры
прямо
пропорциональна
градиенту
температуры
![]() где
где
![]() —
коэффициент теплопроводности, Вт/(м
*К). Качественноон
характеризует способность вещества
проводить теплоту. Количественно
же он равен теплоте, которая проходит
в единицу времени
через единицу изотермической поверхности
при разности температур
в 1 К на единицу длины в 1 м, то есть при
условии
qradT
= дТ/дп =
1 K*м
-1.
Знак минус
означает диаметрально
противоположную
направленность векторов
плотности теплового потока
и градиента температур
(рис. 5.11).
—
коэффициент теплопроводности, Вт/(м
*К). Качественноон
характеризует способность вещества
проводить теплоту. Количественно
же он равен теплоте, которая проходит
в единицу времени
через единицу изотермической поверхности
при разности температур
в 1 К на единицу длины в 1 м, то есть при
условии
qradT
= дТ/дп =
1 K*м
-1.
Знак минус
означает диаметрально
противоположную
направленность векторов
плотности теплового потока
и градиента температур
(рис. 5.11).
Количество теплоты, предаваемое в единицу времени через поверхность s, м2, называют мощностью теплового потока, или просто мощностью
![]()
Если коэффициент теплопроводности и градиент температуры постоянны, то
Q
=![]() -
.
-
.
Полное количество теплоты, проходящее через поверхность s, м2, за время t, с, называют тепловым потоком и определяют при предыдущих допущениях следующим образом:
Q
=![]() Дж.
Дж.
Значение коэффициента теплопроводности для различных веществ определяют из справочной литературы. Наихудшими проводниками теплоты являются газы. Их коэффициент теплопроводности растет с повышением температуры, и возможные значения его соответствуют интервалу (0,006-0,6) Вт/(м*К). Наибольшей теплопроводностью обладают гелий и водород. Наибольший интерес в авиации представляет воздух. Его коэффициент теплопроводности при 0 0С равен 0,0244 Вт/(м*К). Жидкости имеют меньший интервал значений коэффициента теплопроводности к = 0,07—0,7 Вт/(м*К). Зависимость его от температуры обратная. Коэффициент теплопроводности воды достигает своего максимального значения при 120 °С и уменьшается при дальнейшем росте температуры. Соответственно коэффициент теплопроводности бензина равен 0,15 Вт/(м*К) приО 0С и 101325 Па.
Металлы лучше других веществ проводят теплоту. У них к = 20—418 Вт/(м *К). Самый теплопроводный металл — серебро. Проводящие свойства металлов убывают с ростом температуры.
Материалы
с
![]() <
0,25
Вт/(м*К) используются для тепловой
изоляции.
Многие теплоизоляционные материалы, и
в том числе
используемые в сверхзвуковой авиации
и космонавтике,
имеют пористое строение, что не позволяет
рассматривать их
в виде сплошной среды. Коэффициент
теплопроводности пористой
изоляции, как понятие, условен, поскольку
перенос теплоты в таком материале
характеризуется не только теплопроводностью,
но и конвекцией и излучением через
заполненные
газом поры.
<
0,25
Вт/(м*К) используются для тепловой
изоляции.
Многие теплоизоляционные материалы, и
в том числе
используемые в сверхзвуковой авиации
и космонавтике,
имеют пористое строение, что не позволяет
рассматривать их
в виде сплошной среды. Коэффициент
теплопроводности пористой
изоляции, как понятие, условен, поскольку
перенос теплоты в таком материале
характеризуется не только теплопроводностью,
но и конвекцией и излучением через
заполненные
газом поры.
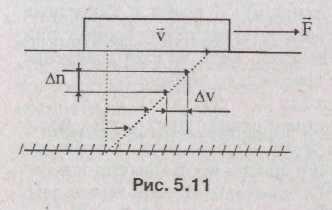
5.7.2. Вязкость
Явление
вязкости (внутреннего трения) имеет
место в газе и
жидкости при наличии градиента скорости
gradv
=
![]() /дп,с
-1,
по
нормали к направлению течения среды.
Обусловлено это тем,
что из-за теплового хаотического движения
происходит обмен
молекулами между отдельными слоями
среды, в результате
чего количество движения «быстрого»
слоя уменьшается, а
«медленного» — увеличивается, что
приводит к торможению
«быстрого» слоя и ускорению «медленного».
Приведенные
рассуждения справедливы и для твердых
тел (самолет, шар,
парашютист и т.п.), движущихся в
газожидкостной cре
де. Очевидно, что в этом случае твердое
тело будет испытывать торможение
за счет частичной передачи своей
кинетической энергии окружающей среде
для преодоления ее сопротивления.
Внутреннее трение становится заметным,
например, при перемещении
в капельной или упругой жидкости
горизонтальной
несущей поверхности в виде пластинки
параллельно земной
поверхности или плоской стенке. Для
такого перемещения
требуется приложить силу F,
равную
силе трения. Силу F,
действующую
на площадь соприкосновения пластины
со средой s,
м2,
определяют из закона Ньютона и называют
силой Ньютона
/дп,с
-1,
по
нормали к направлению течения среды.
Обусловлено это тем,
что из-за теплового хаотического движения
происходит обмен
молекулами между отдельными слоями
среды, в результате
чего количество движения «быстрого»
слоя уменьшается, а
«медленного» — увеличивается, что
приводит к торможению
«быстрого» слоя и ускорению «медленного».
Приведенные
рассуждения справедливы и для твердых
тел (самолет, шар,
парашютист и т.п.), движущихся в
газожидкостной cре
де. Очевидно, что в этом случае твердое
тело будет испытывать торможение
за счет частичной передачи своей
кинетической энергии окружающей среде
для преодоления ее сопротивления.
Внутреннее трение становится заметным,
например, при перемещении
в капельной или упругой жидкости
горизонтальной
несущей поверхности в виде пластинки
параллельно земной
поверхности или плоской стенке. Для
такого перемещения
требуется приложить силу F,
равную
силе трения. Силу F,
действующую
на площадь соприкосновения пластины
со средой s,
м2,
определяют из закона Ньютона и называют
силой Ньютона
![]()
где
![]() —
коэффициент динамической вязкости,
количественноравный
силе внутреннего трения, которая
действует на единицу поверхности слоя
при градиенте скорости qradv
= 1, с -1,
Па*с. Знак
«минус» указывает на противоположную
направленность силы трения и градиента
скорости. Величину, обратную коэффициенту
динамической вязкости, называют
текучестью.
—
коэффициент динамической вязкости,
количественноравный
силе внутреннего трения, которая
действует на единицу поверхности слоя
при градиенте скорости qradv
= 1, с -1,
Па*с. Знак
«минус» указывает на противоположную
направленность силы трения и градиента
скорости. Величину, обратную коэффициенту
динамической вязкости, называют
текучестью.
Динамическую
вязкость среды с плотностью
![]() =
1 кг/м3
называют
кинематической
=
1 кг/м3
называют
кинематической
![]() м2/с.
м2/с.
В аэродинамических расчетах наиболее часто используют кинематическую вязкость.
При движении, например, шарика в жидкости под действием силы тяжести прилегающие к нему слои жидкости также придут в движение в направлении движения шарика. Чем дальше слой от шарика, тем меньше его скорость, движения. В результате наличия разности скоростей между слоями возникают силы внутреннего трения, которые проявляются в форме сопротивления движению шарика. Сила сопротивления для шарика радиусом r, м, определяется формулой Стокса
![]() ,
H.
,
H.
Вязкость среды оказывает влияние на формирование архитектуры пограничного слоя у обтекаемой поверхности, что определяет интенсивность конвективного теплообмена между поверхностью и жидкостью, в том числе между поверхностью фюзеляжа летательного аппарата и горизонтальных несущих поверхностей самолета и воздухом.
Для информации. Динамическая вязкость обычных, не очень вязких, жидкостей имеет порядок 1 мкПа*с. У вязких же жидкостей динамическая вязкость возрастает в тысячи раз. Например, динамическая вязкость воды при 20 °С равна 1,002 • 10 -3 Па • с, бензина — 0,648 • 10 -3, спирта — 1,2 • 10 -3, а глицерина — 1480 Па • с. Напомним, что вязкость газов при той же температуре и атмосферном давлении имеет порядок 10 -5 Па*с. Следует обратить внимание на то, что вязкость жидкостей с увеличением температуры резко снижается, а вязкость газов — возрастает.
