
- •Тема 1. Кинематика материальной точки.
- •Тема 2.
- •Тема 3. Работа и энергия. Динамика твердого тела
- •Тема 4. Основы релятивистской механики
- •Тема 5. Основы молекулярной физики
- •5.7.3. Диффузия
- •Тема 6. Физические основы термодинамики
- •6.1. Основные понятия и определения
- •6.3. Уравнение состояния идеального газа
- •6.4. Первый закон термодинамики
- •6.5. Рабочая диаграмма Pv. Работа — функция процесса
- •6.7. Зависимость теплоемкости от условий подвода теплоты. Уравнение Майера для идеального газа
- •6.7.1. Изохорная теплоемкость
- •6.7.2. Изобарная теплоемкость
- •6.7.3. Уравнение Майера для идеального газа
- •6.8. Расчет изменения внутренней энергии
- •6.9. Формулы и таблицы для истинных и средних теплоемкостей. Определение количества теплоты по теплоемкости и разности температур
- •6.10Молекулярно-кинетическая теория теплоемкости
- •6.11. Обратимые и необратимые термодинамические процессы
- •6.12. Второй закон термодинамики
- •6.13.Энтропия
- •6.14. Некоторые свойства энтропии
- •6.15. Теория «тепловой смерти Вселенной»
- •6.16.Тепловая диаграмма Ts. Теплота —функция процесса
- •6.17. Изменение энтропии идеального газа
6.12. Второй закон термодинамики
Первый закон термодинамика, являясь общим законом сохранения и превращения энергии, представленный в форме, удобной для термодинамического анализа, утверждает, что теплота может превращаться в работу, а работа — в теплоту, не устанавливая условий, при которых возможны эти превращения. Кроме того, первый закон не рассматривает вопроса о возможном направлении протекания процесса; а не зная этого, нельзя предсказать его особенности и результаты.
Условия,
необходимые для осуществления какого-либо
преобразования,
устанавливает второй закон термодинамики.
Он имеет
частный характер, связанный со свойствами
тепловой энергии.
И второе, закон справедлив только для
макропроцессов.
Второй закон термодинамики не может
быть выведал из каких-либо теоретических
положений, а, как и первый, представляет
собой результат обобщения установленных
из опыта фактов.
Существует несколько эквивалентных
формулировок второго закона термодинамики.
Первая и наиболее общая принадлежит
Р. Клаузиусу и утверждает следующее:
«Теплота не может
сама собой переходить от тела с более
низкой температурой
к телу с белее высокой температурой,
или — процесс теплообмена
необратим». Эта формулировка позволила
доказать Р.
Клаузиусу теорему, носящую его имя: «Для
любого обратимого
процесса интеграл от приведенной теплоты
![]() ,
взятыйпо
замкнутому контуру, равен нулю»
,
взятыйпо
замкнутому контуру, равен нулю»
(6.41)
![]() .
.
Равенство интеграла Р. Клаузиуса нулю указывает на существование некоторой функции состояния, которая была названа Р. Клаузиусом — энтропией, то есть
-
:
■ ![]() (6.42)
(6.42)
Уравнение (6.41) называют первым интегралом Клаузиуса. Уравнение (6.42) считают математическим выражением второго закона термодинамики для обратимых процессов.
Чтобы разобраться с теоремой Р. Клаузиуса, рассмотрим схему процесса обратимого преобразования теплоты в работу (рис. 6.10). Для этого необходимо установить связь количеств теплоты q1 и д2 и температур Т1 и Т2.
По
первому закону термодинамики
q2
=
q1—
![]() .
Используяпонятие
термического
коэффициента полезного действия
.
Используяпонятие
термического
коэффициента полезного действия
![]() = (q1-
q2)/q1
=(Т1-—
Т2)/Т1
для
цикла Карно и заменив работу
= (q1-
q2)/q1
=(Т1-—
Т2)/Т1
для
цикла Карно и заменив работу
![]() на
ее значение
на
ее значение
![]() =
q1—
q2=
=
q1—
q2=![]() ,,
предыдущее уравнение можно переписать
в виде: q2
= q1
- ql(Tl
- T2)lT1.
После
упрощений получим q1/T
= q2/T2
.Получается,
что отношения количеств теплоты к
соответствующим температурам на
входе теплового потока в двигатель
и на выходе из него равны. Это следует
понимать как факт наличия тепловой
характеристики, названной энтропией
,,
предыдущее уравнение можно переписать
в виде: q2
= q1
- ql(Tl
- T2)lT1.
После
упрощений получим q1/T
= q2/T2
.Получается,
что отношения количеств теплоты к
соответствующим температурам на
входе теплового потока в двигатель
и на выходе из него равны. Это следует
понимать как факт наличия тепловой
характеристики, названной энтропией
(q/T) = s, Дж/(кгК),
сохраняющей для двигателя постоянное значение в процессах ее подвода и отвода. На рис. 6Д0 показано, что отношения q/T остаются одинаковыми и на входе теплоты, л на выходе. Это свойство величины q/T и обратило на себя внимание Р. Клаузиуса. Он первым придал величине q/T самостоятельное значение и назвал ее энтропией.
Возвратимся
к теореме и интегралу Клаузиуса.
Преобразуем
ql/T1
=
q2/T2
к
виду q1/T1-q2/T2=0,
так
как q2
,согласно
принятому
правилу знаков для теплоты, является
отрицательной
величиной, то получим q1/T1+q2/T2=
0
или s1
+ s2=0.
Для любого
обратимого процесса по замкнутому
контуру интеграл от
приведенной теплоты и составляет понятие
интеграла Клаузиуса
![]() =
0. Соотношениемs
=
q/T
можно
пользоваться
тогда, когда все количество теплоты q
отдается
при одной и той же температуре Т.
Реально
температура при подводе теплоты
(кроме процессов, сопровождающихся
фазовым переходом)
повышается, а при отводе понижается.
Для каждой малой
«порции» теплоты
=
0. Соотношениемs
=
q/T
можно
пользоваться
тогда, когда все количество теплоты q
отдается
при одной и той же температуре Т.
Реально
температура при подводе теплоты
(кроме процессов, сопровождающихся
фазовым переходом)
повышается, а при отводе понижается.
Для каждой малой
«порции» теплоты
![]() q
температура
будет уже другой; Поэтому
энтропию следует подсчитывать для
каждой «порции» теплоты
отдельно в виде ds=
q
температура
будет уже другой; Поэтому
энтропию следует подсчитывать для
каждой «порции» теплоты
отдельно в виде ds=![]() q/T,
а
затем суммировать «порции»
энтропии ds.
В целом
изменение энтропии
q/T,
а
затем суммировать «порции»
энтропии ds.
В целом
изменение энтропии
![]() s
в конечном
процессе
12 будет равно сумме
s
в конечном
процессе
12 будет равно сумме
.
Из
соотношения ds
=
![]() q/T
следует,
что поток теплоты можно представить
как произведение температуры Т,
при
которой она
Передается, на поток энтропии
q/T
следует,
что поток теплоты можно представить
как произведение температуры Т,
при
которой она
Передается, на поток энтропии
![]() q
=
Tds, (6.43)
q
=
Tds, (6.43)
а
в конечном процессе q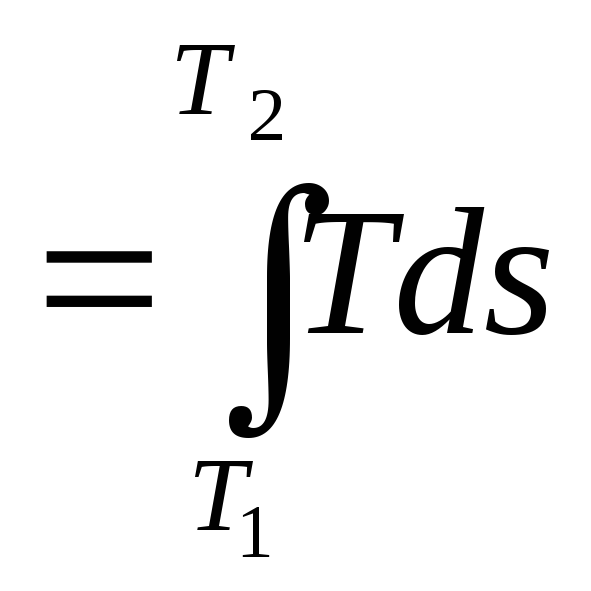 .
.
Второй закон термодинамики устанавливает направление тепловых процессов и утверждает, что самопроизвольный переход теплоты от холодных тел к нагретым невозможен (холодный чайник греть горячую печку не может). Для этого необходимы дополнительные компенсирующие процессы, например подвод механической энергии, осуществляемый в холодильных установках. Если бы самопроизвольный переход теплоты от холодных тел к горячим был возможен, то в равновесной изолированной системе можно было бы без внешнего воздействия получить два источника теплоты с различной температурой. Итак, естественные процессы протекают от большего потенциала к меньшему, поэтому процесс теплообмена необратим.
Одновременно с Р. Клаузиусом в 1851г. В. Томсон предложил другую формулировку второго закона термодинамики: «Не вся теплота, полученная в тепловом двигателе от теплоотдатчика, может перейти в работу, а только некоторая ее часть. Часть теплоты Должна перейти в теплоприемник». Следовательно, для получения работы необходимо иметь источник теплоты с высокой температурой и приемник теплоты с низкой температурой.
Следующая формулировка второго закона, являющаяся следствием формулировки В. Томсона, высказана В. Оствальдом: «Осуществление вечного двигателя второго рода невозможно». Под вечным двигателем второго рода подразумевается такой двигатель, который способен полностью превращать в работу всю теплоту, полученную от одного источника. Если бы можно было осуществить тепловую машину, работающую на одном источнике теплоты, то в качестве таких источников могли бы служить окружающая среда, мировой океану запасы внутренней энергии которых безграничны. Такой двигатель был бы вечным и не противоречащим первому закону. Противоположный механизм, антипод вечного двигателя второго рода, возможен. Это, например, тормозной механизм, наждак, в которых работа полностью превращается в малоценную теплоту трения, что является для них полезным.
Существуют и другие формулировки второго закона термодинамики, например формулировка Л. Больцмана: «Природа стремится от состояний менее вероятных к состояниям более вероятным, или — естественные процессы развиваются необратимо в направлении увеличения беспорядка». Сказанное следует понимать как то, что беспорядок всегда вероятнее, чем относительный порядок. Здесь Л. Больцман отождествляет беспорядок с понятием энтропии и обосновывает тот факт, что любая форма упорядоченного движения, каким является механическое движение газа в целом, стремится перейти в неупорядоченное хаотическое внутримолекулярное движение самостоятельно, то есть работа в теплоту переходит без затруднения. В то же время, перевод теплоты в работу требует дополнительных затрат, добавочного компенсирующего процесса или просто компенсации, как говорил Р. Клаузиус. Формулировка Л. Больцмана с учетом изложенного может быть интерпретирована и так: «Какие бы изменения ни происходили в реальных изолированных системах, они всегда ведут к увеличению энтропии». Формулировка Л. Больцмана самая широкая и содержательная.
