
- •Тема 1. Кинематика материальной точки.
- •Тема 2.
- •Тема 3. Работа и энергия. Динамика твердого тела
- •Тема 4. Основы релятивистской механики
- •Тема 5. Основы молекулярной физики
- •5.7.3. Диффузия
- •Тема 6. Физические основы термодинамики
- •6.1. Основные понятия и определения
- •6.3. Уравнение состояния идеального газа
- •6.4. Первый закон термодинамики
- •6.5. Рабочая диаграмма Pv. Работа — функция процесса
- •6.7. Зависимость теплоемкости от условий подвода теплоты. Уравнение Майера для идеального газа
- •6.7.1. Изохорная теплоемкость
- •6.7.2. Изобарная теплоемкость
- •6.7.3. Уравнение Майера для идеального газа
- •6.8. Расчет изменения внутренней энергии
- •6.9. Формулы и таблицы для истинных и средних теплоемкостей. Определение количества теплоты по теплоемкости и разности температур
- •6.10Молекулярно-кинетическая теория теплоемкости
- •6.11. Обратимые и необратимые термодинамические процессы
- •6.12. Второй закон термодинамики
- •6.13.Энтропия
- •6.14. Некоторые свойства энтропии
- •6.15. Теория «тепловой смерти Вселенной»
- •6.16.Тепловая диаграмма Ts. Теплота —функция процесса
- •6.17. Изменение энтропии идеального газа
6.5. Рабочая диаграмма Pv. Работа — функция процесса

На
рис. 6.3 показан процесс
расширения 1а2
(dv>0).
Начальное
состояние Р1
v1
характеризуется
точкой 1, а конечное
состояние P2v2
— точкой
2. Заштрихованная на
чертеже элементарная площадка
![]() графически
изображает элементарную удельную
работу изменения объема.
Тогда удельная физическая работа
процесса 1а2
графически
изображает элементарную удельную
работу изменения объема.
Тогда удельная физическая работа
процесса 1а2
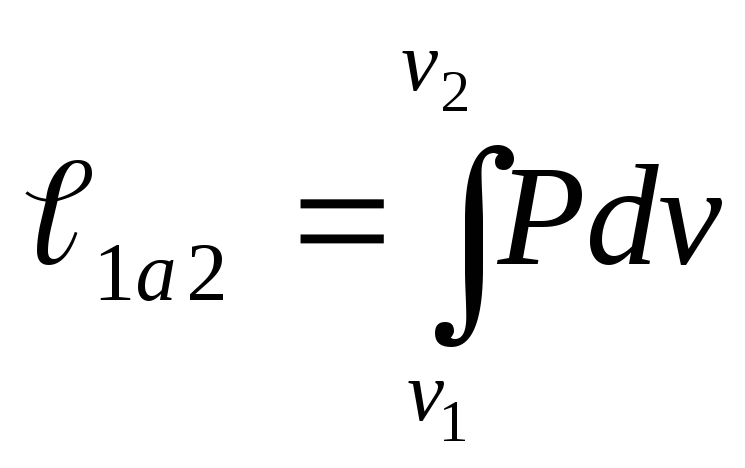
может быть представлена как площадь, ограниченная линией процесса, двумя крайними ординатами и осью абсцисс, то есть площадью Ia2v2v1l.

![]() ,
изображается уже иной
площадью и имеет,
следовательно, иное значение,
в данном случае большее, то
есть площадью 1в2v2v1..
Таким образом,
физическая работа зависит
от характера процесса
и является, следовательно, функцией
процесса. Это свойство
работы имеет, принципиально важное
значение.
,
изображается уже иной
площадью и имеет,
следовательно, иное значение,
в данном случае большее, то
есть площадью 1в2v2v1..
Таким образом,
физическая работа зависит
от характера процесса
и является, следовательно, функцией
процесса. Это свойство
работы имеет, принципиально важное
значение.
Процесс, обратный, например, 2al (рис.6.3), будет представлять собой процесс сжатия, и удельная работа процесса, изображаемая той же штрихованной площадью 2а1v1v22 будет иметь отрицательный знак. При этом происходит подвод энергии к рабочему телу извне.
На рис. 6.4 изображен процесс изменения состояния рабочего тела 1а2 для открытой системы (потока) на диаграмме Pv. Пусть при удельном объеме v происходит бесконечно малое изменение состояния рабочего тела, при котором давление изменяется на dP. Элементарная площадка, заштрихованная на диаграмме, графически изображает элементарную удельную работу открытой системы в соответствии с выражением
![]() =-vdP.
Удельная
работа всего процесса
=-vdP.
Удельная
работа всего процесса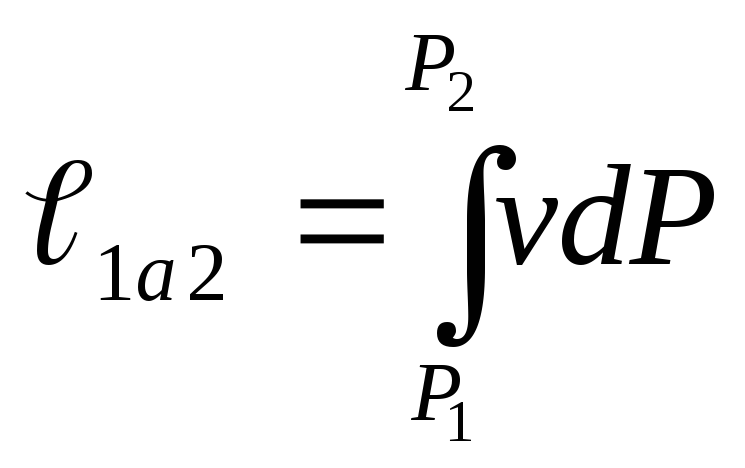 —изображается
площадью 1а2 Р2
Р11.
—изображается
площадью 1а2 Р2
Р11.
В случае перехода системы из состояния 1 в 2 по кривой 1в2 располагаемая работа будет больше на величину площади Iв2al, чем в процессе 1а2. Следовательно, располагаемая работа является также функцией термодинамического процесса.
Как
видно из рис. 6.4, удельная располагаемая
работа открытой системы складывается
из удельной физической работы
![]() ф
в процессе расширения рабочего тела в
закрытой системе,
определяемой площадью 1a2v2v1,l,
и разности удельных потенциальных
энергий рабочего тела при вталкивании
P1V1
= пл.0Р1
1v10
и при выталкивании P2v2
= пл.0Р2v20.
ф
в процессе расширения рабочего тела в
закрытой системе,
определяемой площадью 1a2v2v1,l,
и разности удельных потенциальных
энергий рабочего тела при вталкивании
P1V1
= пл.0Р1
1v10
и при выталкивании P2v2
= пл.0Р2v20.
6.6. Массовая, объемная и мольная, средняя и истинная теплоемкости
Теплоемкостью
называется количество теплоты,
необходимое
для повышения температуры тела на один
кельвин. В зависимости от тою, к какой
количественной единице вещества
подводится
теплота, рассматривается массовая,
мольная и объемная
теплоемкость. Массовая теплоемкость
— это количество
теплоты, необходимое для повышения
температуры 1 кг тела
на 1 кельвин, иначе говоря, это теплоемкость,
отнесенная к
1 кг вещества— с,
Дж/(кг-К).
Соответственно мольная теплоемкость
— теплоемкость, отнесенная к одному
молю—
![]() с(с
с(с![]() ),/Дж/(мольК),
а объемная — к 1 м3
тела -с',
Дж/(м3-К).
Ввиду
того, что в 1 м3
при различных значениях давления и
температуры
содержится различное количество
вещества, объемную
теплоемкость относят к такому количеству
вещества, которое содержится в 1 м3
при нормальных условиях.
),/Дж/(мольК),
а объемная — к 1 м3
тела -с',
Дж/(м3-К).
Ввиду
того, что в 1 м3
при различных значениях давления и
температуры
содержится различное количество
вещества, объемную
теплоемкость относят к такому количеству
вещества, которое содержится в 1 м3
при нормальных условиях.
Соотношение между массовой, объемной и мольной теплоемкостями следующее:
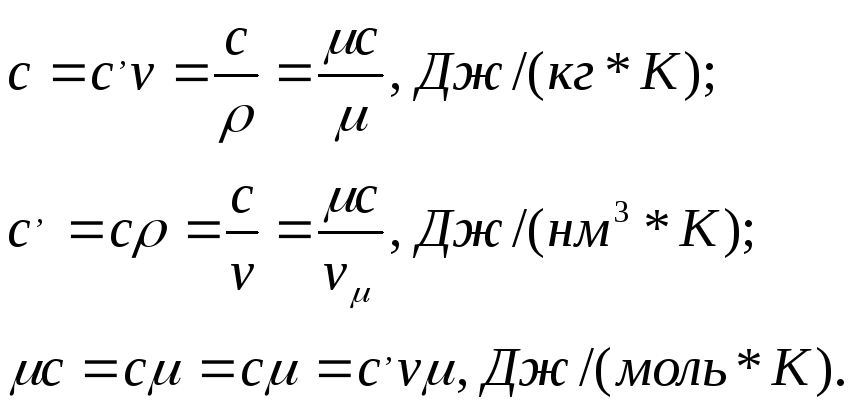
Количество теплоты, подводимое к веществу с целью изменения его температуры на 1 К, зависит от характера термодинамического процесса. Поэтому значения теплоемкости в различных процессах различны, то есть теплоемкость является функцией термодинамического процесса, как и теплота.
Пусть
в некотором процессе 12, общей
характеристикой которого
является постоянство некоторого
параметра n,
к 1 кг вещества, имеющего параметры Р,
v,
T,
подводится
теплота в количестве
ql2,
в
результате чего температура тела
повышается
на
![]() T
=
Т2-
T1,
следовательно, теплоемкость этого тела
равна
T
=
Т2-
T1,
следовательно, теплоемкость этого тела
равна![]() (6.16) и называется средней (m
— индекс усреднения), в данном случае,
массовой теплоемкостью. Средняя
теплоемкость относится
к определенному интервалу температур
(T1,...T
2)
и обозначается
так:
(6.16) и называется средней (m
— индекс усреднения), в данном случае,
массовой теплоемкостью. Средняя
теплоемкость относится
к определенному интервалу температур
(T1,...T
2)
и обозначается
так:
![]() .
Таким образом, средняя теплоемкость в
интервале
температур
.
Таким образом, средняя теплоемкость в
интервале
температур
![]() T
подменяет
собой функцию с
=
f(T)
(рис.
6.5) при
условии, что площадь 12Т2Т11
равна площади 34T2Т13.
T
подменяет
собой функцию с
=
f(T)
(рис.
6.5) при
условии, что площадь 12Т2Т11
равна площади 34T2Т13.
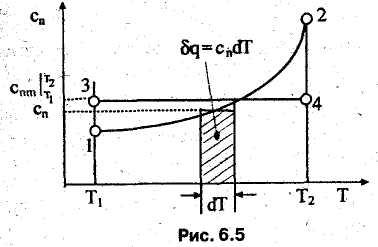
пературы непрерывно уменьшается, стремясь к нулю. Тогда
(6.17)
![]()
и
представляет собой теплоемкость тела
при данной температуре
и называется истинной, реже — мгновенной
массовой теплоемкостью.
Из (6.17) следует:
![]() q
=
cndT
или
для конечного процесса
12
q
=
cndT
или
для конечного процесса
12
![]() (6.18)
(6.18)
Из (6.16) то же количество теплоты можно рассчитать через среднюю теплоемкость
![]() (6.19)
(6.19)
Из
сопоставления (6.18) и (6.19) следует равенство
спт(Т2-Т1)
=![]() dT
и
формула для вычисления средней массовой
теплоемкости
по истинной
dT
и
формула для вычисления средней массовой
теплоемкости
по истинной
1
(6.20)
![]()
