
- •Тема 1. Кинематика материальной точки.
- •Тема 2.
- •Тема 3. Работа и энергия. Динамика твердого тела
- •Тема 4. Основы релятивистской механики
- •Тема 5. Основы молекулярной физики
- •5.7.3. Диффузия
- •Тема 6. Физические основы термодинамики
- •6.1. Основные понятия и определения
- •6.3. Уравнение состояния идеального газа
- •6.4. Первый закон термодинамики
- •6.5. Рабочая диаграмма Pv. Работа — функция процесса
- •6.7. Зависимость теплоемкости от условий подвода теплоты. Уравнение Майера для идеального газа
- •6.7.1. Изохорная теплоемкость
- •6.7.2. Изобарная теплоемкость
- •6.7.3. Уравнение Майера для идеального газа
- •6.8. Расчет изменения внутренней энергии
- •6.9. Формулы и таблицы для истинных и средних теплоемкостей. Определение количества теплоты по теплоемкости и разности температур
- •6.10Молекулярно-кинетическая теория теплоемкости
- •6.11. Обратимые и необратимые термодинамические процессы
- •6.12. Второй закон термодинамики
- •6.13.Энтропия
- •6.14. Некоторые свойства энтропии
- •6.15. Теория «тепловой смерти Вселенной»
- •6.16.Тепловая диаграмма Ts. Теплота —функция процесса
- •6.17. Изменение энтропии идеального газа
6.9. Формулы и таблицы для истинных и средних теплоемкостей. Определение количества теплоты по теплоемкости и разности температур
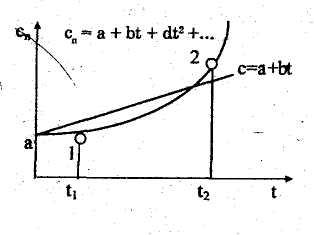 На
основании опытных данных установлено,
что зависимость
истинной теплоемкости реальных газов
от температуры является
криволинейной, как показано на рис.
6.6, и может быть выражена степенным
рядом
сп=
а + bt
+ dt
2
+ef
3+
....
(6.34)
На
основании опытных данных установлено,
что зависимость
истинной теплоемкости реальных газов
от температуры является
криволинейной, как показано на рис.
6.6, и может быть выражена степенным
рядом
сп=
а + bt
+ dt
2
+ef
3+
....
(6.34)
где а, 6, d,... постоянные коэффициенты, численные значения которых зависят от рода газа и характера протекания процесса. В тепловых расчетах часто заменяют нелинейную зависимость теплоемкости от температуры линейной.
В этом случае истинная теплоемкость определяется из
уравнения
![]() (6.35)
(6.35)
где t — температура, °С; b=dc/dt–угловой коэффициент наклона прямой сn = а + bt.
Исходя из (6.20), найдем формулу средней теплоемкости при ее линейном изменении от температуры согласно (6.35)

![]() (6.36)
(6.36)
В случае, если процесс изменения температуры протекает в
интервале
О-t
, то
(6.36) принимает вид![]() (6.37)
(6.37)
Теплоемкость
![]() называют
теплоемкостью средней в
называют
теплоемкостью средней в
интервале
температур
![]() а
теплоемкость
а
теплоемкость
![]() — теплоемкостью
средней в интервале 0—t.
— теплоемкостью
средней в интервале 0—t.
Результаты расчетов истинной и средней в интервале температур О—t массовой или мольной теплоемкостей при
постоянном
объеме и давлении соответственно
по уравнениям (6.34)и (6.37) приведены в
справочной
литературе.
Основной тепло- и хладотехнической
задачей является определение
теплоты, участвующей в процессе. В
соответствии с соотношением
![]() q
=cndT
и
при нелинейной зависимости истинной
теплоемкости от температуры количество
теплоты определяется
заштрихованной элементарной площадкой
на диаграмме
с координатами сnТ
(рис.
6.6). При изменении температуры
от Т1
до
Т2
в
произвольном конечном процессе
количество
подводимой или отводимой теплоты
определяется, согласно (6.38),
следующим образом:
q
=cndT
и
при нелинейной зависимости истинной
теплоемкости от температуры количество
теплоты определяется
заштрихованной элементарной площадкой
на диаграмме
с координатами сnТ
(рис.
6.6). При изменении температуры
от Т1
до
Т2
в
произвольном конечном процессе
количество
подводимой или отводимой теплоты
определяется, согласно (6.38),
следующим образом:
 (6.38)
(6.38)
и определяется на той же диаграмме (рис. 6.6) площадью 12T2T11. Подставив в (6.38) значение сn=f(T) для данного газа по соотношению (6.34) и произведя интегрирование, получим расчетную формулу для определения теплоты в заданном интервале изменения температуры газа, которая, впрочем, следует из (6.16):
![]()
Однако,
поскольку в справочной литературе есть
только средняя
теплоемкость в интервале температур
0—t,
то
количество
теплоты в процессе 12 можно определить
не только по предыдущей
формуле, но итак:
![]() Очевидно
соотношение между теплоемкостями
средними в интервалах
температур T1—T2
и
0-t:
Очевидно
соотношение между теплоемкостями
средними в интервалах
температур T1—T2
и
0-t:
![]()
Количество
теплоты, подводимое (отводимое) к m
кг рабо
чего тела
![]()
Количество теплоты, подводимое к V м3 газа, определяется формулой
![]()
Количество
теплоты, подводимое (отводимое) к н
молям рабочего
тела, равно![]()
6.10Молекулярно-кинетическая теория теплоемкости
Молекулярно-кинетическая теория теплоемкости является весьма приближенной, так как не рассматривает колебательной и потенциальной составляющих внутренней энергии. Поэтому, согласно этой теории, задача состоит в определении распределения подводимой к веществу тепловой энергии между поступательной и вращательной формами внутренней кинетической энергии. Согласно распределению Максвелла-Больцмана, если системе очень_ большого числа микрочастиц сообщить некоторое количество энергии, то она распределяется

Молекула одноатомного газа имеет три степени, свободы, так как ее положение в пространстве определяется тремя координатами, причем для одноатомного газа эти три степени свободы являются степенями свободы поступательного движения.
Для двухатомного газа значения трех координат одного атома еще не определяют положение молекулы в пространстве, так как после определения положения одного атома необходимо учитывать, что второй атом имеет возможность вращательного движения. Для определения положения в пространстве второго атома необходимо знать две его координаты (рис. 6.7), а третья же определится из известного в аналитической геометрии уравнения
![]()
где
![]() —
расстояние между атомами. Таким образом,
при известном
—
расстояние между атомами. Таким образом,
при известном
![]() из
шести координат необходимо знать только
пять. Следовательно, молекула двухатомного
газа имеет пять степеней
свободы, из которых три — поступательного
и две — вращательного
движения.
из
шести координат необходимо знать только
пять. Следовательно, молекула двухатомного
газа имеет пять степеней
свободы, из которых три — поступательного
и две — вращательного
движения.
Молекула
трехатомного газа имеет шесть степеней
свободы
— три поступательного и три вращательного
движения. Это
следует из того, что для определения
положения в пространстве
необходимо знать шесть координат
атомов, а именно:
три координаты первого атома, две
координаты второго атома
и одну координату третьего. Тогда
положение атомов в пространстве
будет полностью определено, так как
расстояния между
ними
![]() -
заданы.
-
заданы.
Если взять газ большей атомности, то есть 4-атомный и более, то число степеней свободы такого газа будет равно также шести, так как положение четвертого и каждого следующего атома будет определяться фиксированным расстоянием его от других атомов.
Согласно молекулярно-кинетической теории вещества, средняя кинетическая энергия поступательного и вращательного движений каждой из молекул пропорциональна температуре
и
равна соответственно![]() и
и![]() —
число степеней свободы
вращательного движения). Поэтому
кинетическая энергия
поступательного и вращательного
движений всех молекул будет
линейной функцией температуры
—
число степеней свободы
вращательного движения). Поэтому
кинетическая энергия
поступательного и вращательного
движений всех молекул будет
линейной функцией температуры
![]() Дж, (6.39)
Дж, (6.39)
(6.40)
![]() Дж.
Дж.
Уравнения (6.39) и (6.40) выражают упомянутый закон равнораспределения энергии по степеням свободы, согласно которому на каждую степень свободы поступательного и вращательного движений молекул приходится одна и та же средняя кинетическая энергия, равная 1/2 (кТ).
Энергия колебательного движения молекул представляет собой сложную возрастающую функцию температуры и только в отдельных случаях при высоких температурах может быть приближенно выражена формулой, аналогичной (6.40). Молекулярно-кинетическая теория теплоемкости не учитывает колебательного движения молекул.
Между
двумя молекулами реального газа
действуют силы отталкивания
и притяжения. Для идеального газа
потенциальная
энергия взаимодействия молекул
отсутствует. С учетом изложенного
внутренняя энергия идеального газа
равна U=![]() .Так
как N=vnNA
,то
.Так
как N=vnNA
,то
![]() Внутренняя энергия одного моля идеального
газа при условии, что универсальная
газовая постоянная определяется
произведением двух констант:
Внутренняя энергия одного моля идеального
газа при условии, что универсальная
газовая постоянная определяется
произведением двух констант:
![]() = kNA,
определяется
следующим образом:
= kNA,
определяется
следующим образом:![]() ,Дж/моль.
,Дж/моль.
Продифференцировав
по Т и зная, что du![]() /dT
=
/dT
=
![]() cr,
получим
мольную
теплоемкость идеального газа при
постоянном объеме
cr,
получим
мольную
теплоемкость идеального газа при
постоянном объеме
![]()
Коэффициент
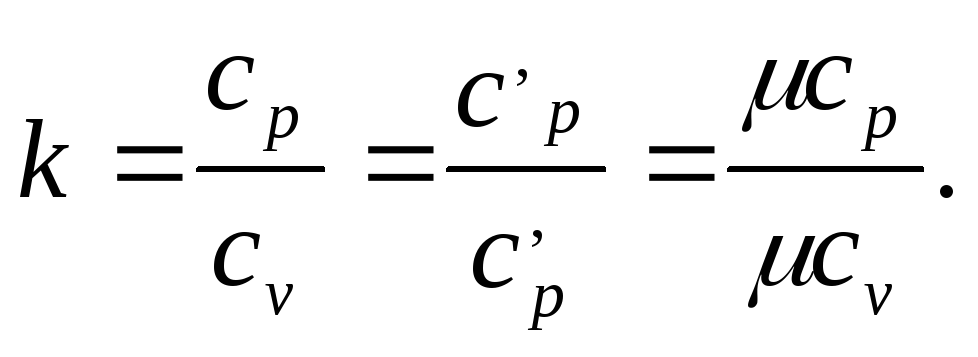 называетсякоэффициентом
Пуассона или показателем адиабаты.
называетсякоэффициентом
Пуассона или показателем адиабаты.
Для идеального газа показатель адиабаты является величиной, зависящей только от атомного строения молекул газа, что и отражено в табл. 6.1. Символическое значение показателя адиабаты можно получить из уравнения Майера сp — cv = R путем следующих преобразований: kcv — cp = R, cv(k-l) - R, откудa к = 1 + R/cv. Из предыдущего равенства следует выражение изохорной теплоемкости через показатель адиабаты cv = =R/(k—1) и затем изобарной теплоемкости: ср.= kR/(k— 1).
Из
уравнения Майера
![]() ср
=
ср
=
![]() получим
выражение для мольной
теплоемкости идеального газа при
постоянном давлении
получим
выражение для мольной
теплоемкости идеального газа при
постоянном давлении
![]() ,
Дж/(моль-К).
,
Дж/(моль-К).
Для
приближенных расчетов при не очень
высоких температурах,
когда энергию колебательного движения
атомов в молекулах
вследствие ее малости можно не учитывать,
допускаются
к использованию полученные мольные
теплоемкости
![]() сv
сv![]() и
и![]() сp
как
функции атомности газов. Значения
теплоемкостей
представлены в табл. 6.1.
сp
как
функции атомности газов. Значения
теплоемкостей
представлены в табл. 6.1.
Таблиц6.1
Значения теплоемкостей по молекулярно-кинетической теории газов
|
Атомность газа |
|
|
|
k | |
|
кал |
Дж |
кал |
Дж | ||
|
моль-град |
моль-К |
моль-град |
моль-К | ||
|
Одноатомный газ Двухатомный газ Трех- и более атомный газ |
3 5 7 |
12,5 20,8 29,1 |
5 7 9 |
20.8 29.1 37.4 |
1,67 1,40 1,28 |

 теплоемкость
теплоемкость