
учебное пособие БРИЛЛЬ
.pdfтканей, что проявляется такими симптомами, как жажда, сухость кожи и слизистых. Когда глюкоза в крови начинает превышать почечный порог выведения (выше 8,8 ммоль/л), нарушается реабсорбция глюкозы и возникает глюкозурия. Избыток глюкозы, выводясь с мочой, увлекает за собой большие количества воды, возникает осмотический диурез. Развивается полиурия, потеря электролитов с мочой, прежде всего калия. Гипокалиемия — важный компонент метаболических нарушений при инсулиновой недостаточности. Постоянная реабсорбция канальцами почек огромного количества глюкозы ведет к истощению их ферментных систем, обеспечивающих обратное всасывание глюкозы. В результате глюкозурия может развиться и при более низких цифрах глюкозы в крови.
Наряду с тяжелыми водно-электролитными расстройствами при дефиците инсулина отмечаются нарушения всех видов обмена веществ. Из-за понижения усвоения глюкозы тканями, особенно мышечной и жировой, двух наиболее важных потребителей глюкозы, резко повышается использование аминокислот в качестве энергетического источника. Усиливается катаболизм белков, а появляющиеся
врезультате этого свободные аминокислоты включаются в глюконеогенез, усугубляя гипергликемию. Распад белков при сахарном диабете особенно характерен для мышечной ткани и лежит в основе заметной при прогрессирующем диабете атрофии мышц, мышечной слабости. Снижение утилизации глюкозы приводит к усиленной мобилизации липидов из жировых депо. При инсулиновой недостаточности 80 % энергии организм получает путем окисления жирных кислот. Усиление распада липидов в жировой ткани приводит к резкому увеличению концентрации свободных жирных кислот, фосфолипидов, триглицеридов в крови. Гиперлипидемия становится одним из дополнительных факторов поражения сосудистых стенок — диабетической ангиопатии. Постепенно развивается специфическая для сахарного диабета диабетическая микроангиопатия — генерализованное дегенеративное поражение капилляров и артериол, характеризующееся пролиферацией эндотелия с утолщением базальной мембраны. Диабетическая микроангиопатия является основной причиной инвалидности и смертности больных сахарным диабетом. В патогенезе диабетической микроангиопатии основную роль играет процесс неферментного гликолизирования коллагена сосудистой стенки. Гликолизирование — это процесс, при котором глюкоза пропорционально ее концентрации
вкрови поступает в клетки инсулиннезависимых тканей, где она, не подвергаясь фосфорилированию, присоединяется к различным клеточным белкам. Глюкоза без предварительного фосфорилирования включается помимо коллагена сосудов также в белки сыворотки крови, гемоглобина, клеток нервной системы, сетчатки и хрусталика глаз, поджелудочной железы, базальной мембраны почек. Накопление продуктов гликолизирования приводит к нарушению функций органов и тканей, изменениям реологических свойств крови, к морфологическим изменениям в стенке сосудов, повышению их проницаемости и микроциркуляторными расстройствами. Скорость гликолизирования и количество гликолизированных белков зависят от величины и длительности гипергликемии.
Кроме того, в патогенез сосудистых осложнений при сахарном диабете вовлечено нарушение функции эндотелия. При диабете особенно страдает способность
сосудов к расширению за счет сниженной выработки эндотелием оксида азота.
621
Использованиежирныхкислотвкачествеэнергетическогоисточникаприводит к накоплению в организме кетоновых тел — ацетоуксусной, β гидроксимасляной кислот,ацетона.Объясняетсяэтотем,чтообразовавшийсяврезультатеβ-окисления ацетил-КОА не может полностью вступить в цикл Кребса из-за недостаточности последнего. Из-за ослабления пентозофосфатного цикла уменьшается образование восстановленного НАДФ, необходимого для осуществления другого альтернативного пути для ацетил-КОА — превращения вновь в жирные кислоты. Недаром говорят, что жиры сгорают в пламени углеводов, а этого пламени при дефиците инсулина нет, поэтому для ацетил-КОА остается один путь превращений — в кетоновые тела. При абсолютной инсулиновой недостаточности (сахарный диабет I типа) скорость образования кетоновых тел намного превышает скорость их утилизации и почечной экскреции, вследствие чего концентрация кетоновых тел в крови увеличивается. При сахарном диабете II типа имеющийся уровень инсулина, несмотря на его недостаточность, все же позволяет регулировать липолиз, не допуская массивного расщепления собственных жиров и развития кетоацидоза.
Накопление кетоновых тел является главной причиной развития ацидоза при сахарном диабете. После истощения буферного резерва кислотно-основное равновесие нарушается, возникает метаболический ацидоз. Способствует развитию ацидоза поступление из клеток в межклеточную жидкость ионов водорода в обмен на натрий, теряемый с мочой.
Дегидратация и гиповолемия являются причинами снижения регионарного кровотока, что, в свою очередь, приводит к гипоксии тканей. Гипоксия периферических тканей способствует активизации в них процессов анаэробного гликолиза и постепенному нарастанию уровня лактата. Относительный недостаток лактатдегидрогеназы при дефиците инсулина и невозможность полной утилизации лактата в цикле Кори являются причинами возникновения лактатацидоза.
Быстрое нарастание концентрации кетоновых тел, лактата, развитие метаболического ацидоза, гиперосмолярность, водно-электролитные расстройства, гипоксия являются главными патогенетическими факторами, которые приводят к развитию диабетической кетоацидотической комы. Особенно она характерна для сахарного диабета I типа и в меньшей степени для диабета II типа. Кома является весьма грозным осложнением сахарного диабета.
622
Глава 23
Патофизиология нервной системы
23.1. Общие закономерности метаболических и функциональных расстройств при патологии различных отделов нервной системы
23.1.1. Этиологические факторы поражения ЦНС
Расстройства деятельности нервной системы могут возникать в результате воздействия на организм разнообразных экзогенных и эндогенных факторов, влияющих на метаболизм, структуру и функцию нервных клеток.
Экзогенные патогенные факторы могут быть специфически избирательно нейротропными, поражающими определенные структуры нервной системы, и неспецифическими, повреждающими не только нервные, но и другие тканевые элементы.
Кэкзогенным факторам естественного или искусственного происхождения, поражающим нервную систему, относятся:
1) Биологические возбудители: вирусы (бешенства, полиомиелита), микроорганизмы (лепра), микробные токсины (ботулинический, столбнячный).
2) Химическиераздражители: спирты (этиловый, метиловый), ядохимикаты (хлорофос), отравляющие вещества, лекарственные соединения.
3) Физические патогенные факторы: ионизирующая радиация, электрический ток, шум, вибрация, электромагнитное поле, механическая травма, высокая и низкая температура.
4) Растительные токсины (стрихнин, кураре).
Кобщим закономерностям метаболических и функциональных расстройств нервной ткани, возникающим на фоне действия разнообразных экзогенных патогенных факторов, относятся: нарушение биоэлектрических процессов в нервных клетках, образования, транспорта, выделения и метаболизма нейромедиаторов, и, соответственно, влияния на проницаемость ионных каналов в нейронах.
Эндогенные патогенные факторы, нарушающие структуру и функцию нервной ткани, формируются при самых разнообразных заболеваниях инфекционной и неинфекционной природы:
1) при наследственных нарушениях деятельности генетического и хромосомного аппарата нейронов;
2) при расстройствах локального и системного кровообращения (тромбоз, эмболия, кровоизлияния, ишемия сосудов головного мозга);
3) при различных эндокринопатиях (сахарном диабете, надпочечниковой недостаточности);
4) при патологии печени и нарушении билирубинового обмена;
5) при патологии почек и развитии почечной недостаточности;
6) при анемиях и гипоксиях различного генеза.
В свою очередь структурные и функциональные сдвиги в ЦНС являются пусковыми механизмами развития расстройств нервной регуляции и трофики различных внутренних органов и систем.
623
Возникновение вторичных регуляторных сдвигов функциональной активности нейронов означает этап эндогенизации патологического процесса. В это время непосредственной причиной развития процесса являются уже не первичные, а вторичные эндогенные механизмы, присущие самой измененной нервной системе. Однако этиологические первопричины и на этом этапе не теряют своего значения: их повреждающее действие ведет к новым повреждениям и к усилению уже возникших или к появлению новых вторичных эндогенных патогенных механизмов.
23.1.2. Метаболические особенности нервной ткани — как фактор риска развития структурных и функциональных изменений при действии патогенных раздражителей
Выраженность поражения нервной системы при воздействии различных патогенных факторов во многом определяется особенностями метаболизма нервной ткани. Наиболее характерной особенностью метаболизма является его очень высокая интенсивность. Головной мозг человека, на долю которого приходится лишь около 2 % общего веса тела, потребляет до 20 % всего кислорода, используемого организмом в покое, и около 20 % всех углеводов. Таким образом, мозг отличается необыкновенно высоким энергетическим обменом. Особенно интенсивно протекает обмен веществ в сером веществе мозга. Потребление кислорода мозгом мало зависит от изменения кровотока и парциального давления кислорода. Высокий уровень обмена сохраняется и при отсутствии большой физиологической активности, например при сне. Вместе с тем следует отметить, что обмен веществ в периферических нервных проводниках коренным образом отличается от обмена самих нервных клеток (ткани мозга). Возбудимость нервного волокна сохраняется в течение многих часов в анаэробных условиях. Это и позволило Н.Е. Введенскому говорить о «неутомляемости» нерва.
Важной особенностью энергетического метаболизма нервной ткани является резкое преобладание в ней аэробных процессов. Весьма характерно для энергетического метаболизма нервной ткани преимущественное использование в качестве субстрата клеточного дыхания глюкозы. Энергия макроэргических фосфатов, образующихся в мозге при окислении глюкозы, расходуется на поддержание ионных градиентов по обе стороны цитоплазматической мембраны, на осуществление аксоплазматического транспорта питательных веществ и внутриклеточных органелл и на синтез структурных компонентов клетки.
Поскольку содержание богатых энергией лабильных фосфатов в нервной ткани невелико, становится понятной необходимость высокой скорости обновления АТФ в мозгу. Наряду с аэробным метаболизмом углеводов, мозговая ткань способна к интенсивному анаэробному гликолизу. Однако гликолиз как источник энергии ни в коем случае не может заменить в ткани мозга клеточное дыхание. Наряду с ярко выраженным катаболизмом, нервная ткань отличается и интенсивными анаболическими процессами.
Нервная система и особенно ее центральные отделы (например, кора и мозжечок) очень чувствительны к гипоксии. При внезапном прекращении подачи кис-
624
лорода мозгу (вдыхание бескислородных газовых смесей, нарушение мозгового кровообращения) у человека через 6–7 с наступает потеря сознания, а через 10– 20 с прекращается нормальная биоэлектрическая активность мозга. Через 4–5 мин после возникновения аноксии мозга наступают необратимые изменения в метаболизме и функции нервных клеток. Филогенетически старые структуры являются более устойчивыми к гипоксии. Так, нейроны мозгового ствола, входящие в состав дыхательного и сосудодвигательного центров, способны переносить аноксию длительностью до 30 мин. При гипоксических состояниях запас макроэргических соединений истощается, прекращаются биосинтетические процессы, накапливается значительное количество недоокисленных метаболитов, прежде всего молочной кислоты, возрастает концентрация неорганического фосфата, аммиака, нарушается внутренняя упорядоченность биохимических процессов. Резко сокращается содержание ацетилхолина, происходит значительный сдвиг в распределении электролитов (калий выходит из нервных клеток, натрий входит в них). Увеличение концентрации внеклеточного калия приводит к деполяризации мембраны нейронов и способствует возникновению судорог. Увеличение концентрации внутриклеточного кальция приводит к активации протеаз, фосфолипаз и эндонуклеаз. Избыточное накопление Са2+ приводит к альтерации внутриклеточных белков и различных структур, фрагментации ДНК и нарушению деятельности генома. Извращение обменных процессов нередко сопровождается накоплением в клетках гликогена. Нарушения обменных процессов сопровождаются резкими изменениями функции нейронов.
Причинами нарушения обмена веществ нервной ткани могут быть гипогликемия, отсутствие или недостаток некоторых витаминов, появление в среде, окружающей нервные клетки, специфических ингибиторов тканевого дыхания или гликолиза и т.д.
При недостаточном поступлении в нервную ткань глюкозы развертывается цепь событий, аналогичная той, что возникает при гипоксии. В этом случае причиной развития патологического процесса редко является нарушение проницаемости гематоэнцефалического барьера для глюкозы. Хотя переход глюкозы из крови в нервные клетки и носит активный характер, однако этот механизм, в отличие от механизма транспорта сахара через мембраны мышечных и печеночных клеток, не контролируется гормонами (в частности, инсулином) и обладает высокой автономностью.
Чаще всего причиной энергетических расстройств, связанных с недостатком глюкозы, является гипогликемия. Именно благодаря высокой чувствительности к гипогликемии нервной системы гипогликемия опасна для организма в целом. Причинами гипогликемии, вызывающей мозговые симптомы, могут быть тяжелые физические нагрузки, почечный диабет, передозировка инсулина, инсулиновая кома, надпочечниковая недостаточность, болезни печени. Падение уровня сахара в крови до 2,2–1,7 ммоль/л вызывает нарушение биотоков мозга, гипогликемические судороги, потерю сознания. При этом интенсивность окислительных процессов в нервной ткани, несмотря на достаточное количество кислорода, снижается на 20–30 %. Конечный итог, тот же, что и при гипоксии, — уменьшение выработки макроэрги-
625
ческих соединений. Длительная гипогликемия вызывает необратимые повреждения коры большого мозга. При сильно выраженной гипогликемии нарушаются и функции, регулируемые стволовыми механизмами.
Зависимость энергетического обмена в нервной ткани от уровня глюкозы в крови, в известной мере, обусловлена отсутствием стабильных запасов гликогена в нервных клетках. Хотя в первый период углеводного голодания в них и наблюдается использование аминокислот в качестве субстрата дыхания, однако такое нарушение обычного типа обмена быстро приводит к серьезным повреждениям нервной клетки.
Авитаминозы, особенно недостаточность витаминов группы В, сопровождаются серьезными расстройствами функции нервной системы. Как известно, одним из узловых процессов обмена углеводов в нервных клетках является окислительное декарбоксилирование пировиноградной кислоты. В сложной коферментной системе пируватоксидазы необходимым компонентом является пирофосфорный эфир тиамина. При его недостатке в организме и в первую очередь в нервной ткани накапливается пировиноградная кислота, дальнейшее окисление которой в цикле трикарбоновых кислот задерживается, что приводит к выпадению наиболее эффективного в общем энергетическом балансе этапа окисления углеводов. Клинической формой недостаточности витамина В1 является полиневрит (болезнь бери-бери). При этом наблюдается не только нарушение энергетического метаболизма, но и накопление обычно быстро окисляющихся метаболитов, нарушение образования ацетилкоэнзима А, необходимого для синтеза медиатора ацетилхолина. Возникают расстройства координации движений, спутанность сознания. Недостаточность тиамина сопровождает, как правило, хронический алкоголизм.
ИздругихвитаминовнеобходимоназватьвитаминРР—никотиноваякислота. Депрессия, головокружение и другие проявления ослабления функции центральной нервной системы являются наиболее ранними клиническими симптомами недостаточности этого витамина. В тяжелых случаях возникают дегенеративные изменения в нейронах коры головного мозга, базальных ганглиях и в мотонейронах спинного мозга и развитие деменции.
Дефицит витамина В12 приводит к расстройствам тактильной и проприоцептивной чувствительности, мышечной слабости, к нарушениям рефлексов и походки. Морфологические исследования обнаруживают очаги демиелинизации и повреждения аксонов в боковых и дорсальных столбах спинного мозга с явлениями валлеровского перерождения. Нарушения деятельности нервной ткани развиваются также при недостатке витамина В6 и Е.
Вызывают нарушения функции нервной системы ряд токсических веществ (цианистыесоединения,сероводород,угарныйгаз),солитяжелыхметаллов(ртуть), мышьяк содержащие яды (арсениты, люизит).
Заметно снижают поглощение кислорода мозгом наркотики и снотворные вещества. Близким к наркотикам действием обладает алкоголь. При острой интоксикации им потребление кислорода мозгом снижается на 30 %.
Мозговые симптомы при уремии также сопряжены с заметным понижением интенсивности дыхания мозга (на 30–35 %) в результате токсического действия азотистых шлаков на ферменты нервных клеток.
626
При значительном накоплении билирубина в крови развивается билирубиновая энцефалопатия, в результате расстройства энергетического метаболизма.
Причинами ослабления окислительных процессов в мозгу могут быть и изменения в содержании гормонов в плазме крови. Так, отчетливое ослабление дыхания мозга отмечается при микседеме и кретинизме — патологических состояниях, вызванных недостаточностью функции щитовидной железы. Поражение нервной системы имеет место при сахарном диабете.
Интенсивность потребления кислорода мозгом зависит также от концентрации ионов калия в окружающей нервные клетки среде.
Нарушения деятельности нервной системы возможны в результате развития типических патологических процессов — воспаления, опухоли, местных нарушений кровообращения.
Опухоль оказывает раздражающее действие на тот или иной нервный центр, вызывая его чрезмерное возбуждение. По мере роста опухоли развивается атрофия нервных клеток и нервных волокон. Увеличение массы опухоли сопровождается повышением внутричерепного давления, уменьшением кровенаполнения головного мозга и его ишемией.
Воспаление является одной из причин нарушения функций нервной системы. Невриты сопровождаются нарушениями проведения нервного импульса, чувствительности, двигательными расстройствами или нарушениями деятельности внутренних органов. Воспаление, возникшее в центральной нервной системе, приводит к нарушению продукции и оттока спинномозговой жидкости, повышению внутричерепного давления, нарушению мозгового кровообращения.
В патогенезе нарушений деятельности центральных отделов нервной системы может иметь значение появление в нервных центрах группы нейронов, которые работают автономно и продуцируют избыточное возбуждение. Такие нейроны Г.Н. Крыжановский (1997) обозначил как генератор патологически усиленного возбуждения (ГПУВ), который в зависимости от локализации может быть причиной чувствительных, двигательных и вегетативных расстройств, нарушений высшей нервной деятельности.
Реализация патогенных воздействий зависит от локализации поражения, его силы и продолжительности: чем сильнее и длительнее эти воздействия, тем значительнее их эффект. Однако даже слабые патогенные воздействия, если они продолжительны и постоянны, могут вызвать глубокие и устойчивые изменения нервной системы. Например, при хроническом действии нейротропных токсинов в очень малых количествах могут возникать глубокие и стойкие патологические изменения в нервной системе. Постоянные и длительные стрессорные психогенные и невротизирующие воздействия могут вызвать устойчивые нарушения высшей нервной деятельности и поведения, психические изменения. Кроме того, возможно потенцирование действия различных факторов.
Повреждения нервной системы, возникающие при действии различных патогенных факторов, являются необходимым условием развития патологических процессов в нервной системе.
Собственно патологические изменения в нервной системе представляют собой два рода явлений:
627
1)альтерация морфологических структур, нарушение функциональных связей, повреждение и разрушение физиологических систем;
2)возникновение новых, патологических по характеру и результатам деятельности интеграций из первично и вторично измененных образований нервной системы.
При этом разнообразные агенты вызывают:
1)изменение электрогенеза мембран нейронов (мембранного потенциала покоя, потенциала действия, емкости и сопротивления мембраны);
2)нарушение проведения нервного импульса по нервным стволам;
3)нарушение синаптической передачи нервного импульса;
4)изменение нейротрофических влияний, образование патотрофогенов;
5)нарушение генома клетки;
6)возможно формирование генераторов патологически усиленного возбуждения.
Одна из важнейших интегративных функций нервной системы — функция управления движениями. Расстройства нервных механизмов управления движениями возникают при повреждении различных отделов центральной нервной системы, хотя наиболее тяжелые расстройства наблюдаются при повреждении двига-
тельной системы, мозжечка и базальных ганглиев.
23.2. Причины и механизмы развития нарушений двигательной активности
Основными компонентами нервной регуляции двигательной активности являются спинной мозг, ствол мозга, моторная (двигательная) и премоторная кора, дополнительные зоны коры, мозжечок и др. Повреждение любого компонента двигательной системы сопровождается появлением двигательных расстройств.
Специфические клетки двигательной системы — мотонейроны — клетки, передающие двигательные команды. Различают высшие и низшие мотонейроны. Тела низших мотонейронов располагаются в вентральных рогах спинного мозга и в ядрах черепных нервов ствола мозга. Аксоны этих мотонейронов непосредственно контактируют с мышечными волокнами. Высшие мотонейроны не выходят за пределы центральной нервной системы. Их тела находятся в коре головного мозга. Аксоны высших мотонейронов направляются в спинной мозг и ствол мозга, образуя соответственно кортикоспинальный и кортикобульбарный тракт. Двигательные «команды», посылаемые высшими мотонейронами, реализуются с помощью сегментарного аппарата спинного мозга и нейронов ствола мозга.
Основой рефлекторного ответа является рефлекторная дуга, включающая афферентные, центральные и эфферентные структуры, связанные с помощью синаптических соединений.
Афферентная часть рефлекторной дуги представлена рефлекторными образованиями, чувствительными нервными волокнами.
Различают экстероцептивные рефлекторные реакции, инициируемые раздражением рецепторов болевой, температурной, тактильной чувствительности, и интероцептивные, запускаемые раздражением хемо-, баро-, осморецепторов, а также
628
проприоцептивные рефлексы в ответ на раздражение проприорецепторов мышц, сухожилий, суставных поверхностей.
В зависимости от состава нейронов выделили 2 вида рефлекторных дуг:
1)простые, моносинаптические, включающие 2 нейрона: чувствительный, афферентный, расположенный в спинальных ганглиях, и эфферентный, двигательный, расположенный в передних рогах спинного мозга. На долю моносинаптических рефлекторных дуг приходится около 2 %;
2)сложные, полисинаптические рефлекторные дуги, включающие помимо афферентных и эфферентных вставочные нейроны, на их долю приходится около 98 %. За исключением моносинаптического рефлекса растяжения и дисинаптической тормозной рефлекторной дуги волокон I в, все рефлекторные дуги включают два или более, последовательно связанных нейронов, т.е. является полисинаптическим. Полисинаптические рефлексы разделяются на вегетативные и соматические. Время рефлекса полисинаптической дуги находятся в обратной зависимости от интенсивности стимуляции. Интенсивность стимуляции влияет и на силу ответа. Усиление ответа основано на постепенном вовлечении новых групп мышц, такой процесс назван иррадиацией.
Активация спинальных рефлекторных дуг обеспечивает регуляцию тонуса скелетных мышц и их движения в соответствии с характером афферентных воздействий.Элементарныебезусловныерефлексыосуществляютсянауровнеотдельных сегментов спинного мозга по жестко детерминированной программе. Регуляция тонуса мышц обеспечивается за счет сухожильных и познотонических рефлексов.
Различают следующие виды нарушений двигательной функции: гипокинезии, гиперкинезии и атаксии (нарушение координации движений).
К гипокинезиям относят парезы и параличи. Парез— это ослабление, а паралич — это полное отсутствие произвольных движений. В зависимости от степени
ихарактера распространения поражения на различные отделы нервной системы выделяют следующие виды гипокинезов:
• моноплегии (от греч. monos — один, plege — удар, поражение) — паралич одной конечности;
• гемиплегия (от греч. hemi — половинный, plege — удар, поражение) — паралич половины тела;
• диплегия (от греч. di — два, plege — удар, поражение) — паралич двух конечностей .
Возможно развитие верхних и нижних параплегий, а также триплегий и тетраплегий, то есть паралич трех или четырех конечностей.
23.2.1. Периферические параличи
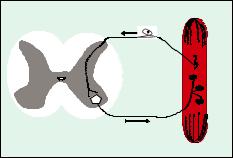
Периферический паралич возникает при повреждении эфферентного отдела спинальной рефлекторной дуги, т.е. при вовлечении в процесс двигательных (моторных) единиц (рис. 23.1).
Каждая двигательная единица состоит из мотонейрона и группы мышечных волокон, которые иннервируются этим мотонейроном. Нарушение функции
629
|
моторных |
нейронов |
спинного |
|
|
мозга имеет место при воздей- |
|||
|
ствии нейротоксинов ботулизма, |
|||
|
столбняка, при спинальной амио- |
|||
|
трофии. Острое специфическое |
|||
|
поражение мотонейронов может |
|||
|
быть вызвано вирусом полиомие- |
|||
|
лита. Поражаются мотонейро- |
|||
Двигательный a - аксон |
ны вентральных рогов спинного |
|||
мозга и мотонейроны черепных |
||||
|
||||
Рис. 23.1. Схема моносинаптической |
нервов. Распространенность по- |
|||
ражения вирусом различна — от |
||||
рефлекторной дуги |
повреждения мотонейронов какой- |
|||
|
||||
|
либо одной мышцы до поражения |
|||
мотонейронов разных мышц всех четырех конечностей с вовлечением черепных |
||||
нервов. Наиболее опасна для жизни гибель мотонейронов дыхательных мышц. |
||||
Механизм избирательности поражения вирусом полиомиелита мотонейронов не |
||||
выяснен. |
|
|
|
|
Тяжелые поражения моторных нейронов наблюдаются также при боковом |
||||
амиотрофическом склерозе, при котором наблюдается прогрессирующая дегенера- |
||||
ция и склероз мотонейронов передних рогов спинного мозга. |
|
|
||
Повреждение нервных проводников наблюдается при травмах, при постдиф- |
||||
терийных полиневритах, аллергическом энцефаломиелите и других демиелинизи- |
||||
рующих заболеваниях. При демиелинизирующих нейропатиях первично разруша- |
||||
ется миелиновая оболочка аксонов при относительной сохранности самих аксонов. |
||||
Как правило, разрушаются отдельные интернодальные участки миелиновой обо- |
||||
лочки, образованные шванновскими клетками. Утрата миелина сопровождается |
||||
замедлением проведения или полной блокадой проведения нервных импульсов. |
||||
Хронические периферические нейропатии могут быть обусловлены многими при- |
||||
чинами, включая наследственные болезни обмена веществ (острая перемежающая- |
||||
ся порфирия), диабет, дефицит витамина В12, свинцовая интоксикация, алкоголизм |
||||
и др. В патогенезе периферических нейропатий участвуют различные механизмы, |
||||
прежде всего изменения кровоснабжения нервов, вызванные повреждением сосу- |
||||
дов периферических нервов. Изменения эндоневральных сосудов особенно выра- |
||||
жены при диабете. Другой механизм периферических нейропатий — нарушение |
||||
аксонального транспорта веществ, необходимого для поддержания жизнедеятель- |
||||
ности аксона. Расстройства аксонального транспорта могут быть связаны с изме- |
||||
нениями кровоснабжения нерва, но могут возникать в связи с повреждений нейро- |
||||
тубулей и нейрофиламентов (отравление свинцом, при применении цитостатиков, |
||||
при хронической алкогольной интоксикации). Разрушение миелиновой оболочки |
||||
может быть обусловлено также появлением антител к основному белку миелина |
||||
или токсином дифтерии. |
|
|
|
|
Развитие периферических параличей может быть связано также с расстрой- |
||||
ствами проведения нервного импульса в мионевральных синапсах, которые явля- |
||||
630
