
0250 / Педиатрия_Майданник
.pdfДиетопрофилактике аллергических болезней у детей уделяется особое внимание. Педиатры и аллергологи единодушно подчеркивают важность как можно более длительного сохранения грудного вскармливания. Пишевые антигены, обычно присутствующие в грудном молоке, переносятся большинством детей, не причиняя им вреда. Однако мать в период лактации обязательно должна соблюдать диету с ограничением коровьего молока и исключением таких сильных аллергенов, как яйца, орехи, рыба, если ее ребенок находится в группе риска.
Некоторые матери, к сожалению, не могут кормить своих детей грудью даже в первые дни жизни. Раннее отнятие от груди для детей с повышенным риском развития аллергии является особенно опасным в плане сенсибилизации к пищевым аллергенам, поэтому за последние десятилетия разработаны специальные гипоаллергенные смеси для вскармливания детей из группы риска.
«HIPP Η.Α.». Для смешанного и искусственного вскармливания детей с высоким риском развития аллергии, а также детей с текущей пищевой аллергией на молочные и соевые смеси специалистами известной австрийской фирмы «HIPP» создан специализированный продукт детского питания — сухая молочная смесь «HIPP H.A.». Антигенность, аллергенность и иммуногенность протеинов коровьего молока в продукте «HIPP Н.А.» значительно уменьшена благодаря специальной технологии изготовления — глубокому ферментативному гидролизу с последующей ультрафильтрацией. В результате этого процесса появляется гидролизат — смесь пептидов и аминокислот с так называемой остаточной антигенностью. 84% пептидов в гипоаллергенном питании «HIPP H.A.» имеют молекулярный вес менее 1500 дальтон, они практически лишены аллергенных свойств, чем и объясняется высокая терапевтическая активность питания «HIPP H.A.» (для сравнения, сильнейший аллерген коровьего молока, β-лактоглобулин, имеет молекулярную массу 36 000 дальтон). Питательная ценность продукта при этом сохраняется. Общее содержание белков в смеси (учитывая и содержание аминокислот) 18 г/1000 мл, что близко к уровню, рекомендуемому для заменителей женского молока. Источником жира в питании «HIPP H.A.» служат исключительно растительные жиры. Соотношение насыщенных и ненасыщенных жирных кислот составляет 40:60. Общее содержание жира составляет 39 г в 1000 мл.
Углеводный компонент «HIPP Н.А.» представлен мальтодекстрином, лактозой, мальтозой и глюкозой, что способствует легкому усваиванию и хорошей переносимости питания «HIPP H.A.». Общее содержание углеводов — 74 г в 1000 мл. Продукт не содержит сахарозы. Энергетическая ценность смеси — 720 ккал в 1000 мл, что соответствует рекомендуемой энергетической ценности для заменителей женского молока. Смесь «HIPP Н.А.» содержит все необходимые минеральные вещества, витамины, обогащена таурином, карнитином, холином и инозитолом. Из-за содержания расщепленных белков гипоаллергенная питательная смесь «HIPP Н.А.» отличается по запаху и вкусу от обычного молочного питания для грудных детей, но, несмотря на это, дети его охотно пьют и хорошо переносят.
1072
При вскармливании детей с высоким риском развития аллергии очень важно в первые 4—6 месяцев не применять никакого другого питания, кроме грудного молока или гимоаллергенной смеси «HIPP Η.Α.». Введенные даже в небольшом количестве, например только на одно кормление, молочная смесь или соевое питание могут значительно снизить защитные свойства грудного молока или гипоаллергениого продукта «HIPP Η.Α.», привести к сенсибилизации и вызвать аллергию.
Первый прикорм детям с высоким риском развития аллергии следует вводить после 6 месяцев, и начинать нужно с овощных пюре. Австрийская фирма «HIPP» является единственным производителем детского питания, которая разработала специальную ступенчатую программу введения прикорма для детей с высоким риском развития аллергии. Продукты питания «HIPP» для этой программы редко вызывают аллергию и имеют ряд преимуществ:
1) БИО-выращивание овощей и фруктов фирмой «HIPP», строгий контроль содержания нитратов, отсутствие консервантов, ароматизаторов, красителей является гарантией того, что ребенок получает действительно качественные продукты для первого прикорма;
2)при изготовлении овощных и фруктовых пюре «HIPP» используется метод пастеризации, благодаря которому витаминная ценность продуктов сохраняется, а аллергенные свойства значительно уменьшаются;
3)овощные и фруктовые пюре «HIPP» имеют нормированный установленный состав, все компоненты которого указаны на баночных этикетках, поэтому можно легко установить источник возможной аллергической реакции;
4)овощные пюре «HIPP», рекомендуемые для первого прикорма, не содержат специй и соли и поэтому не оказывают осмотической нагрузки на почки ребенка;
5)на баночных этикетках овощных и фруктовых пюре «HIPP» обязательно указывается влияние продуктов на стул ребенка; это важно, так как развитию пищевой аллергии у детей часто сопутствуют явления кишечного дисбактериоза.
Итак, первая ступень, первый шаг — овощное пюре «HIPP» из одного вида овощей, например из ранней моркови. Рекомендуется начинать с двух чайных ложек и за 7—10 дней заменить им одно молочное кормление в первой половине дня.
Вторая ступень — после привыкания ребенка к моркови к ней добавляется картофель в виде пюре «HlPP-ранняя морковь с картофелем».
Третья ступень — следующим компонентом, наряду с морковью и картофелем, является говядина в виде пюре «HIPP-говядина с морковью и картофелем».
Благодаря такому ступенчатому введению овощного прикорма меню ребенка с риском развития аллергии постепенно пополняется новыми продуктами, и он постепенно, шаг за шагом, привыкает к новому питанию, которое соответствует его возрастным потребностям.
В качестве второго прикорма вводится рисовая каша вместо одного вечернего молочного кормления. Готовить ее рекомендуется на основе
1073
гипоаллергенного питания «HIPP Η.А.» с добавлением в него «БИОрисового отвара HIPP». Цельное молоко, а также готовые молочные каши в рационе питания ребенка с высоким риском развития аллергии использоваться не должны. В качестве третьего прикорма вводятся фруктовые пюре «HIPP», например, «яблоки с грушами HIPP» или «яблоки с бананами HIPP». Для первого введения рекомендуется смешать 1/2 баночки фруктового пюре «HIPP» с «БИО-рисовым отваром HIPP» и 1 чайной ложкой кукурузного масла.
Выбирать напитки для грудных детей с риском развития аллергии нужно так же тщательно, как и продукты прикорма. Широкий ассортимент фирмы «HIPP» позволяет подобрать ребенку из группы риска соки из тех же фруктов и овощей, что и пюре для прикорма, и тем самым предотвратить развитие аллергических реакций на новые виды фруктов.
Профилактические меры, направленные на предупреждение развития аллергии, очень действенны в первый год жизни. При ступенчатом питании ребенок медленно и постепенно привыкает к прикорму, а в дальнейшем сможет усваивать и продукты, обладающие аллергенными свойствами. Кроме того, многочисленные научные исследования показывают, что использование гипоаллергенного питания в первые 4— 6 месяцев жизни ребенка значительно снижает риск развития аллергических заболеваний в первые 2—3 года его жизни.
При любом приступе важно решить следующие задачи: 1) есть ли показания для госпитализации ребенка, и если да, то направить его в обычное соматическое, пульмонологическое или в отделение интенсивной терапии, реанимации; 2) какое лекарство выбрать для курирования приступа; 3) нужна ли ребенку регидратационная терапия и какая (с частым дыханием ребенок теряет много воды, стимулирует диурез и обычно назначаемый эуфиллин, а густой бронхиальный секрет увеличивает тяжесть приступа, но избыток жидкости может усилить влажность легких и даже способствовать отеку легких); 4) имеется ли у ребенка легочная бактериальная инфекция, и если да, то какой выбрать антибиотик; 5) нужна ли терапия в связи с сопутствующими заболеваниями, патологическими состояниями, а также возможными осложнениями БА; 6) необходим ли ребенку дополнительный кислород и какой избрать способ его назначения.
Показания для госпитализации: неэффективность в полном объеме проведенной терапии (особенно если ребенок в прошлом получал или настоящее время получает глюкокортикоиды); развитие астматического состояния; приступ БА, вызванный или осложненный бесспорной бактериальной инфекцией; психосоциальные особенности семьи.
Поскольку у больных БА во время приступа практически всегда возникает гипоксемия, то для поддержания адекватного уровня Ро (выше 80 мм рт. ст.) необходима кислородотерапия, особенно аппаратная, которая облегчает состояние больного, уменьшает степень гипоксемии. Концентрация кислорода не должна превышать 40%, а его количество составляет 3 л/мин.
У детей раннего возраста при приступе БА, как известно, преобладают вазосекреторные нарушения. Поэтому у больных этой возрастной
1074
группы медикаментозную терапию обычно начинают с применения эуфиллина, ибо адреналин и адреномиметики менее эффективны.
Разовая доза эуфиллина (доза насыщения) обычно составляет 6 мг на 1 кг массы тела у детей до 5 лет и 4—5 мг — у детей более старшего возраста. При легком приступе далее каждые 6 ч применяют эуфиллин в половинной дозе так, чтобы суточная доза составляла 12—15 мг на 1 кг. При средней тяжести приступа упомянутую нагрузочную дозу эуфиллина вводят внутривенно в изотоническом растворе натрия хлорида, как правило, в течение 20 мин, не быстрее чем 25 мг в 1 мин.
Считают, что терапевтический бронходилатирующий уровень эуфиллина в сыворотке крови составляет 10—20 мг/л, хотя у некоторых детей он может быть и меньшим — 5—8 мг/л. При отсутствии выраженной патологии печени и почек у детей старше 1 мес и взрослых доза эуфиллина I мг на 1 кг, введенная медленно внутривенно, создает уровень препарата в крови 2 мг/л.
При поступлении ребенка в стационар оптимально эуфиллин вводят (после суточной «нагрузочной дозы») постоянно капельно внутривенно детям в возрасте от 1 до 9 лет в дозе 1 мг/кг/ч в первые 12 ч и далее — 0,8 мг/кг/ч, 9—16 лет — внутривенно капельно в дозе 0,75 мг/кг/ч.
Длительность полужизни эуфиллина в крови взрослых — 7—9 ч, у детей — 3—5 ч (у недоношенных в первую неделю жизни — 20—30 ч). Следовательно, с учетом отмеченного выше можно рассчитать необходимую дозу препарата, если ребенок получал его в течение 4 ч до планируемого назначения.
При назначении фармакокинетически обоснованных доз эуфиллина с использованием разработанных алгоритмов повышается эффективность лечения и уменьшается вероятность побочных реакций и осложнений.
Побочными эффектами больших доз эуфиллина могут быть тошнота, рвота, бессонница, головная боль, возбуждение, судороги, а также покраснение кожи лица, гипотензия, сердечные аритмии, в том числе и экстрасистолия; сыпь, боль в животе, потеря аппетита, диарея; дегидратация из-за резкой стимуляции диуреза, гиперкалиемия.
У детей старшего возраста острый типичный приступ БА сопровождается доминированием спазма мускулатуры бронхов. Для купирования легкого приступа БА используют бронхоспазмолитики, назначая их в виде ингаляций или внутрь. Обструкция бронхов в этом случае может быть устранена применением агонистов адренергических рецепторов
(табл. 167).
Предпочтение следует отдавать селективным Р2-адреномиметикам, которые являются бронходилататорами, избирательно воздействующими на Р2-адренорецепторы (табл. 168). Наиболее выраженное избирательное влияние на Р2-адренорецепторы оказывают сальбутамол и беротек.
Оказывая выраженное бронхоспазмолитическое действие, эта группа препаратов не вызывает каких-либо выраженных побочных явлений со стороны сердечно-сосудистой системы. Однако не следует назначать
1075
|
|
|
|
Таблица 167 |
|
Результаты активации трех типов адренорецепторов |
|||||
|
|
||||
Физиологические |
Типы адренорецепторов |
||||
ипи патофизиологические |
|
|
|
||
альфа |
бета-1 |
бета-2 |
|||
проявления |
|||||
|
|
|
|
||
Гиперемия и отек слизистой |
Уменьшение |
0 |
0 |
||
оболочки |
|
|
|
|
|
Состояние гладких мышц |
Сокращение |
0 |
Расслабление |
||
|
|
|
|
бронхов |
|
Освобождение |
эндогенных |
Увеличение |
0 |
Снижение |
|
спазмогенов |
|
|
|
|
|
Мукоцилиарный |
клиренс |
0 |
0 |
Увеличение |
|
Состояние периферических |
Сокращение |
0 |
Расширение |
||
кровеносных сосудов |
|
|
|
||
Тахикардия и тенденция |
0 |
Усиление |
0 |
||
к аритмии |
|
|
|
|
|
|
|
|
|
|
|
Таблица 168
Характеристика селективных β2-адреномиметиков в сравнении с адреналином
Препарат |
Действие на адрено- |
Длитель- |
Бронхорас- |
|
||||
рецепторы |
|
|||||||
ность |
ширяющая |
Пути введения |
||||||
|
||||||||
|
альфа |
бета-1 |
|
бета-2 |
действия |
активность |
|
|
|
|
|
|
|
|
|
|
|
Адреналин |
+ + + |
+ + + |
+ + + + |
30—40 |
1 |
в/м |
||
(эпинефрин) |
|
|
|
|
мин |
|
|
|
Изадрин |
— |
++ |
+++ |
1 ч |
0,75 |
п/к, в/м, |
||
(изопротенол, |
|
|
|
|
|
|
под язык, |
|
изопреналин, |
|
|
|
|
|
|
ингаля- |
|
эуспиран, |
|
|
|
|
|
|
ционно |
|
новодрин) |
|
|
|
|
|
|
|
|
Орципреналина |
— |
+ |
++ |
4 ч |
0,5 |
n/κ, в/м, |
||
сульфат |
|
|
|
|
|
|
ингаляци- |
|
(метапротеренол, |
|
|
|
|
|
|
онно, |
|
алупент, астмопент) |
|
|
|
|
|
|
внутрь |
|
Беротек |
- |
+- |
+++ |
6 ч |
0,75 |
То же |
||
(фенотерол) |
|
|
|
|
|
|
|
|
Тербуталин |
— |
+- |
++ |
7 ч |
0,5 |
То же |
||
(бриканил) |
|
|
|
|
|
|
|
|
Сальбутамол |
— |
+- |
++++ |
4—6 ч |
0,75 |
То же |
||
(албутерол, вентолин) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1076
симпатомиметические препараты часто, поскольку бесконтрольное их применение нередко приводит к возникновению резистентности к ним, а у ряда детей — к побочным реакциям со стороны сердечно-сосудистой системы. Во избежание развития кардиотоксического эффекта аэрозоль симпатомиметических препаратов следует назначать не более 4 раз в день.
Для купирования легкого приступа БА предпочтение отдают ингаляционному использованию орципреналина (алупента. астмопента, ипрадола), сальбутамола (альбутерола, вентолина) или тербуталина.
Следует отметить, что многие исследователи считают, что увеличение ежедневной дозы или ежедневное использование β-адреномимети- ков является сигналом неадекватной терапии и ухудшения состояния больного.
Достаточно эффективны при легком приступе БА у детей эуфиллин и эфедрин. Назначение эуфиллина в разовой дозе 6 мг на 1 кг массы тела и эфедрина из расчета 0,5 мг на 1 кг массы тела изолированно или в сочетании внутрь либо в виде ингаляции позволяет купировать приступ затрудненного дыхания. Эффективными могут быть и комбинированное применение бронхоспазмолитических препаратов (солутана, антастмана, теофедрина), однако их назначение следует проводить с учетом переносимости каждого входящего в состав аппарата лекарственного соединения. В случаях легкого приступа БА обратное развитие обструкции может быть достигнуто назначением бронхолитина, в состав которого входят эфедрин и отхаркивающие средства.
При средней тяжести приступа БА у детей лечение начинают с назначения симпатомиметических препаратов либо препаратов метилксантинового ряда или комбинированных бронхоспазмолитиков, используя ингаляционный или энтеральный путь введения. В случае неэффективности указанных средств бронхиальная проходимость может быть восстановлена подкожным введением адреналина изолированно или в сочетании с эфедрином. Адреналин назначают в дозе 0,01 м на 1 кг массы тела в виде 0,1%-го раствора, эфедрин вводят по 0,5—0,75 мг на I кг массы тела в виде 1%-го раствора. При средней тяжести приступа эффективен орципреналина сульфат (алупент, астмопент). Введение этих препаратов обычно позволяет купировать острые проявления бронхоспазма через 10—15 мин; после купирования приступа БА таким больным целесообразно проводить лечение бронхоспазмолитиками внутрь в течение 5—7 дней для достижения ремиссии болезни; можно применять эуфиллин, эфедрин, комбинированные бронхоспазмолитические препараты.
Лечение тяжелого приступа БА начинают с назначения аэрозолей 32-адреномиметиков (сальбутамола, беротека). Если это лечение неэффективно, то следует ввести 0,5%-й раствор сальбутамола в дозе 0,03 мл на
1кг массы тела в 4 мл изотонического раствора натрия хлорида.
Вслучаях нарастания дыхательной недостаточности вводят внутривенно струйно преднизолон из расчета 2 мг на 1 кг массы тела (либо гидрокортизон из расчета.5 мг на 1 кг массы тела или солумедрол по 2 мг на 1 кг). Вместо преднизолона и гидрокортизона с успехом можно использовать метилпреднизолон или дексазон. Одновременно про-
1077
водят оксигенотерапию (увлажненный кислород интраназально в объеме 3 л/мин).
При отсутствии эффекта от применения указанных средств больному внутривенно капельно вводят 2,4%-й раствор эуфиллина в дозе 4— 6,5 мг на 1 кг массы тела в 200—300 мл изотонического раствора хлорида натрия. Количество вводимого эуфиллина зависит от состояния больного, сопутствующей патологии, а также от того, получал ли больной лечение препаратами метилксантинового ряда до назначения инфузионной терапии. Детям с обострением БА, протекающей на фоне ОРВИ, воспалительных заболеваний печени и почек и в случаях, когда больным до начала инфузионной терапии уже проводилось лечение препаратами теофиллинового ряда, следует осторожно назначать высокие дозы эуфиллина из-за возможности развития интоксикации теофиллином.
При недостаточной эффективности от проводимой терапии рекомендуется применять 0,1%-й раствор адреналина подкожно по 0,01 мг на 1 кг массы тела. Препарат можно вводить 3 раза с интервалом 20— 30 мин.
Улучшение дренажной функции бронхов достигается назначением муколитических препаратов. С этой целью рекомендуется применятьацетилцистеин.
После устранения острых проявлений тяжелого приступа БА следует продолжить терапию бронхоспазмолитиками, муколитическими препаратами, назначая их внутрь, до полного купирования обструктивного синдрома.
Примерный алгоритм применения лекарственных средств в приступном периоде бронхиальной астмы у детей представлен на рисунке 122.
Более сложной задачей является выведение детей из астматического статуса. Возникновение астматического статуса чаще всего является следствием наслоения острых воспалительных заболеваний респираторного тракта или экспозиции к аллергену, к которому у больного ранее отмечался высокий уровень сенсибилизации. Врачебная тактика при купировании астматического состояния зависит от его стадии.
При 1 стадии астматического статуса, характеризующегося клинической картиной некупирующегося затянувшегося приступа БА, необ,- ходимо:
1) отменить временно адреналин и эфедрин, поскольку у больных резко снижена чувствительность бронхов к адреналину и некоторым другим адренергическим препаратам;
2)обязательно применить увлажненный кислород. При этом используют «усы», воронку, но не кислородную палатку с водным туманом;
3)провести регидратацию, можно энтерально (общий объем жидкости примерно в 1,5 раза выше, чем суточные возрастные потребности);
4)назначить селективные Р2-адреномиметики в виде ингаляций: сальбутамол, орципреналина сульфат (алупент, астмопент) и др. При неэффективности ингаляций перечисленные препараты следует ввести внутривенно. Для этого используют изадрин (изопротерснол, новодрин). Первоначальная доза для внутривенного капельного введения составляет 0,05—0,1 мкг на 1кг в 1 мин. В дальнейшем каждые 15—20 мин дозу изадрина увеличивают в 2 раза до 0,8 мкг на I кг в 1 мин. После этого
1078
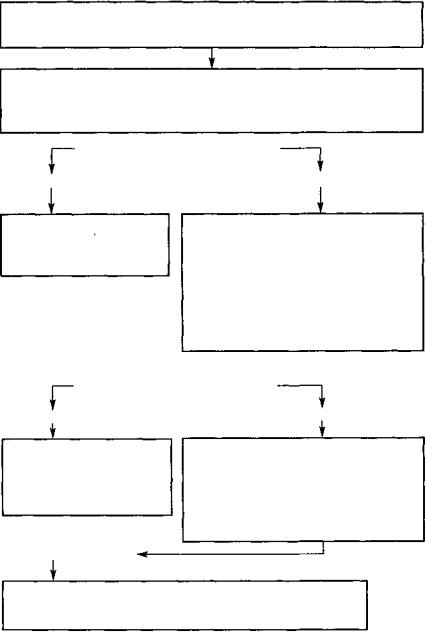
Госпитальный этап
ОЦЕНКА ТЯЖЕСТИ СОСТОЯНИЯ Сбор краткого анамнеза, физикальное обследование, спирометрия,
определение общего анализа и газового состава крови, гематокрита
НАЧАЛЬНАЯ ТЕРАПИЯ
—Оксигенотерапия через маску.
—Ингаляция Р2-агонистов короткого действия по 1—2 дозе через спейсер или небулайзер каждые 20 минут в течение часа
ПОВТОРНАЯ ОЦЕНКА СИМПТОМОВ (PEF, SaO2)
ЕСТЬ УЛУЧШЕНИЕ |
НЕТ УЛУЧШЕНИЯ |
— Продолжать применение |
— Оксигенотерапия |
ингаляционных р"2-адрено- |
— 32-агонисты парентерально (п/к, в/м) |
миметиков 3—4 раза в сутки |
или через спейсер/ небулайзер |
в течение 1—2 дней |
— Добавить ипротропиум бромид через |
|
спейсер/небулайзер |
|
— Введение эуфиллина в/в капельно, |
|
1 мг/кг/ч |
|
— Адреналин п/к, в/м |
|
— Кортикостероиды парентерально |
|
каждые 6 ч |
ПОВТОРНАЯ ОЦЕНКА СИМПТОМОВ
ЕСТЬ УЛУЧШЕНИЕ |
НЕТ УЛУЧШЕНИЯ |
— Продолжить прием |
Направить больного в отделение |
β2-агонистов, пролонгирован- |
интенсивной терапии |
ных метилксантинов |
— Оксигенотерапия |
— После ликвидации острых |
— Кортикостероиды внутрь |
явлений — базисная терапия |
— В/венное введение эуфиллина, 1 мг/кг/ч |
|
— Симптоматическое лечение |
|
— Возможна ИВЛ, лечебная бронхоскопия |
ЕСТЬ УЛУЧШЕНИЕ |
|
—Продолжить парентеральное введение кортикостероидов
втечение нескольких дней с постепенной отменой и переходом на ИКС, добавить пролонгированные метилксантины
Рис. 122. Примерный алгоритм применения лекарственных средств в приступном периоде бронхиальной астмы у детей
1079
дозу увеличивают до 0,2—0,4 мкг на 1 кг в 1 мин. Повышение дозы прекращают, если появляется аритмия, частота сердечных сокращений превышает 200 в 1 мин и Рас о снижается до 55 мм рт. ст.;
5) начинать или продолжать эуфиллинотерапию. Доза насыщения составляет 5—6 мг на I кг массы тела. Если дозу насыщения ребенок получил, то эуфиллин назначают внутривенно капельно в дозе 0,6—1 мг на I кг в час. Необходимо помнить, что токсический эффект эуфиллина возникает при его концентрации в крови более 20 мг/л, поэтому целесообразно при постоянном его вливании определять концентрацию препарата в крови каждые 12 ч.
Внастоящее время подчеркивают, что на фоне терапии эуфиллином
может увеличиться чувствительность Р2-адренорецепторов к симпатомиметикам (особенно селективным). Это происходит за счет того, что одним из эффектов теофиллина является ингибирование фосфодиэстеразы, а значит, увеличение в клетке уровня цАМФ. В то же время теофиллин блокирует аденозиновые рецепторы, снижая чувствительность
канафилактогенным метаболитам — аденозину и ШТ-альфа, уменьшает его концентрацию в крови, улучшает контрактильную способность мышц диафрагмы и альвеолярную вентиляцию. Поэтому подкожное введение тербуталина в дозе 0,01 мг на I кг массы тела (максимальная разовая доза — 0,25 мг) или применение в аэрозоле на фоне эуфиллинотсрапии может оказаться эффективным.
Вслучае технических трудностей при налаживании трансфузии эуфиллина в периферические вены производится катетеризация подключичной вены. Суточная доза эуфиллина не должна превышать 24 мг на 1 кг;
6) при быстром нарастании проявлений дыхательной недостаточности ввести в сочетании с эуфиллином внутривенно струйно гидрокортизон или преднизолон. Преднизолон вводят в дозе 2 мг на 1 кг, а затем 3 мг на 1 кг в сутки, разделяя его на 3 дозы;
7) в случае невосприимчивости к другим препаратам показано применение антихолинергических средств. Рекомендуется использовать аэрозоль М-холинолитиков (например атровент).
При наличии признаков сердечно-сосудистой недостаточности внутривенно вводят коргликон. Детям с проявлением астматического статуса проводится также лечение муколитиками (ацетилцистеином и др.).
Применение комплекса указанных терапевтических мероприятий у многих детей дает возможность восстановить дренажную функцию бронхов, чувствительность Р2-адренорецепторов к бронхоспазмолитикам симпатомиметического ряда и вывести больных из астматического состояния. В случае отсутствия эффекта от внутривенного введения эуфиллина
иглюкокортикостероидов детям назначают преднизолон внутрь в дозе
1мг на 1 кг массы тела в сутки в 4 приема. После купирования приступа астмы суточную дозу глюкокортикостероидов можно уменьшить наполовину, и в течение последующих 7—10 дней их постепенно отменяют на фоне активной терапии бронхоспазмолитиками.
Интенсивную терапию во II стадии астматического статуса, характеризующегося наличием выраженной дыхательной недостаточности с развитием синдрома «молчания в легких», следует проводить, по воз-
1080
можности, в реанимационном отделении. Она включает инфузионную терапию эуфиллином, преднизолон до 3—5 мг на 1 кг в сутки, при этом до 2 мг на 1 кг массы тела в сутки назначают внутрь, а остальную часть — внутривенно. Одновременно осуществляют посиндромную терапию, направленную на коррекцию нарушений функций жизненно важных органов и систем.
Для выведения из астматического статуса III стадии, характеризующейся развитием асфиксического синдрома, больных переводят на искусственную вентиляцию легких. На фоне этого проводят инфузионную терапию, направленную на поддержание центральной гемодинамики и восстановление бронхиальной проходимости. Она включает преднизолон в дозе 6—10 мг на 1 кг массы тела в сутки, эуфиллин, изотонический раствор хлорида натрия, 5%-й раствор глюкозы, гемодез. Одновременно корригируют показатели нарушенного соотношения кислот и оснований, а также патологические сдвиги в функционировании других органов и систем.
После выведения из астматического состояния 11 и 111 стадии больным в течение 1,5—2 недель проводят параллельно лечение глюкокортикостероидами. Во избежание развития синдрома отмены глюкокортикостероидов детям, больным БА, помогает назначение интала, стимуляторов синтеза глюкокортикостероидов (кальция пантотенат, витамина В6, глицирама), индуктотерапия на область надпочечников.
При недостаточной эффективности медикаментозной терапии у некоторых детей с астматическим статусом удается достичь улучшения проведением гемосорбции или плазмафереза.
После устранения обострения детям, больным БА, проводят противорецидивное лечение, направленное на достижение устойчивой ремиссии. Терапевтический алгоритм длительного противорецидивного лечения определяется степенью тяжести заболевания (рис. 123).
Более детально этапы длительного лечения детей, больных БА, в зависимости от степени тяжести, представлены в таблице 169.
Наиболее эффективными с этой целью являются мембраностабилизирующие препараты (интал, задитен, димефосфон, ксидифон), предупреждающие высвобождение тучными клетками и базофилами медиаторов аллергического воспаления. Показанием для их назначения считают частые приступы БА.
Кромолин-натрий (интал, ломудал, динатрий хромогликат) применяют с помощью специального турбоингалятора (спинхалера), прилагаемого к препарату, каждые 4—6 ч (1 капсула содержит 20 мг). При наличии неустойчивого состояния по БА интал назначают в виде ингаляций от 2 до 4 капсул в день в течение 3—9 и более месяцев. Лечение инталом позволяет достичь ремиссии болезни у 75% больных.
Клинический эффект можно оценивать не ранее чем через 4 недели, но наиболее отчетливо он проявляется через 6 недель. Длительность лечения может составлять 4—6 месяцев. Интал неэффективен для купирования приступа БА. Наиболее эффективен препарат при атопической БА с аэрозольным поступлением аллергена. В случаях заболевания БА,
1081
