
0250 / Педиатрия_Майданник
.pdfа также сепсис смешанной этиологии при острых гематогенных остеомиелитах, гемолитической стрептококковой инфекции, деструктивных процессах легких, кожи, поражениях поджелудочной железы, почек и других органов, включая и кишечные инфекции. ДВС-синдром может быть следствием пневмококковой септицемии (чаще у детей с удаленной селезенкой), а также при вирусных инфекциях (грипп А1, ветряная оспа и др.). Развитию ДВС-синдрома могут способствовать обширные повреждения тканей (травматический шок, ожоговый шок, геморрагический шок), большие хирургические вмешательства на легких и при костно-мышечной пластике, экстракорпоральное кровообращение, реакция изоиммунной несовместимости, переливания несовместимой крови, массивные гемотрансфузии и т.д. ДВС-синдром может сопровождать течение тромботической тромбоцитопенической пурпуры (болезнь Мошковича), геморрагического васкулита (болезнь Шенлейна—Геноха), ревматизма, системной красной волчанки, врожденных пороков сердца. Нередко причиной развития ДВС-синдрома могут быть врожденные и приобретенные заболевания крови, в частности гемолитические анемии с внутрисосудистым гемолизом, гемоглобинопатия (чаще гемоглобиноз), острый лейкоз (чаще промиелоцитарный), гемофилия. ДВС-синдром может развиваться при заболеваниях почек (гломерулонефрит, гемоли- тико-уремический синдром и др.) и печени (острая прогрессирующая дистрофия печени (синдром Рейе), агрессивный хронический гепатит, цирроз).
ПАТОГЕНЕЗ. В основе развития ДВС-синдрома лежат гипоксия, ацидоз, повреждение эндотелия, активация свертывающей системы крови как эндогенными, так и экзогенными факторами (тканевый тромбопластин, эндотоксины). В организме этот процесс может быть вызван факторами, способными активировать как внешнюю, так и внутреннюю систему тромбопластинообразования или одновременную активацию этих систем.
Активация с преимущественным включением внешнего пути тромбопластинообразования происходит обычно при массивном поступлении в кровяное русло тканевого тромбопластина (травматический, ожоговый и гемолитический шок, у новорожденных, родившихся при патологическом течении родов).
Активация с преимущественным включением внутреннего механизма тромбопластинообразования наблюдается у детей при состояниях, сопровождающихся генерализованным повреждением эндотелия сосудов с активацией фактора контакта и последующим лавинообразным каскадом свертывания крови (острые инфекции, образование комплексов антиген—антитело).
Активация с одновременным включением внутреннего и внешнего механизмов наблюдается при терминальных состояниях у детей с прогрессирующей гипоксией и метаболическим ацидозом.
Указанное деление в определенной степени условно, так как начальные пути активации редко остаются изолированными и в последующем ходе патологического процесса взаимно дополняют друг друга.
882
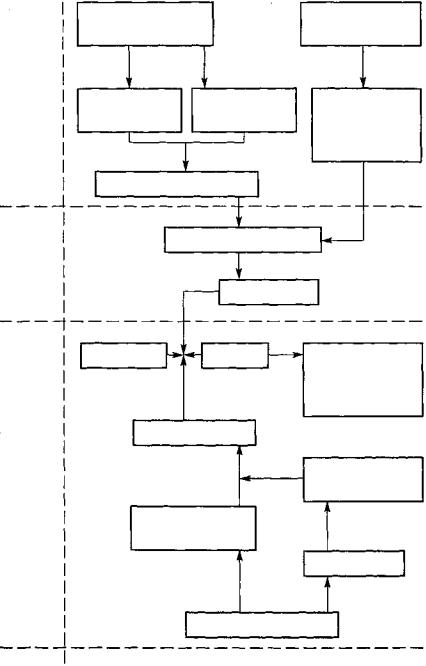
Проникновение во внутреннюю среду макроорганизма бактериальных агентов, продуктов жизнедеятельности грамположительных бактерий (экзотоксины), а также фрагментов белковой и фосфолипидной природы наружного слоя цитоплазматических мембран, появляющихся при разрушении патологических клеток самого организма (эндотоксины), приводит к развитию сложнейших изменений в организме больного, включая активацию ряда энзиматических систем, в том числе свертывания крови (рис. 106).
Одним из основных клеточных объектов первичного патогенетического действия микроорганизмов и их токсинов, вероятнее всего, являются тромбоциты. Активирующее влияние бактериального воздействия на тромбоциты осуществляется через мобилизацию вне- и внутриклеточного кальция, включение арахидонового каскада с преимущественным образованием тромбоксана А2 и изменение динамического равновесия между внутриклеточным уровнем цГМФ и цАМФ, повышение адгезивно-агрегационных свойств клеток.
Агрегация и адгезия тромбоцитов сопровождаются реакцией высвобождения высокоактивных биологических субстанций — факторов, повышающих проницаемость сосудов, АДФ, катехоламинов, гистамина, серотонина, простагландинов, антигепаринового кофактора IV.
Следствием высокой агрегационно-адгезивной активности кровяных пластинок является тромбоцитопения. Снижению количества циркулирующих тромбоцитов также способствует их связывание с иммуноглобулинами. По-видимому, аналогичные изменения претерпевают лейкоциты и эритроциты.
Ряд клинических и экспериментальных работ свидетельствуют об обязательном вовлечении сосудистого эндотелия в реакцию организма на воздействие бактериальных токсинов. Морфологические изменения происходят очень быстро и заключаются в набухании и последующем разобщении клеточных элементов, обнажении базальной мембраны, в ряде случаев повреждение клеток эндотелиоцитов доходит до некротизации и десквамации эндотелия.
Описанные изменения сопровождаются формированием тромбоцитарных, эритроцитарных, лейкоцитарных и смешанных клеточных агрегатов, выходом фибриногена в интерстициальное пространство, а эритроцитов — из сосудистого русла.
К основным гуморальным объектам воздействия бактериальных токсинов на организм относят систему комплемента, активируемую по классическому и альтернативному пути, а также фактор Хагемана.
Активация фактора Хагемана (ХИа) при эндотоксикозе происходит при контакте XII фактора с обнаженной субэндотелиальной подложкой сосудистой стенки под влиянием избыточных концентраций катехоламинов, а также кислых мукополисахаридов, выделяющихся в результате действия эндотоксинов на лейкоциты и тромбоциты, вследствие прямого взаимодействия ХПа фактора с липополисахаридным компонентом эндотоксинов. Благодаря активации XII фактора реализуется вовлечение внутренней системы гемостаза в патогенез заболевания.
Участие внешней подсистемы гемостаза в патогенезе эндотоксикоза также не вызывает сомнения. Она запускается тканевым тромбопласти-
883
Фаза свертывания
I фаза
II фаза
III фаза
Активация внутренней |
Активация внешней |
||
системы гемостаза |
системы гемостаза |
||
Факторы плазмы |
Факторы клеток |
Тканевой |
|
тромбопластин, |
|||
XII, XI, X, VIII, V |
крови — фактор 3 |
||
тромбопластин |
|||
|
|
||
|
|
сосудистых |
|
|
|
стенок — X, VII |
|
Кровяной тромбопластин |
|
||
|
Протромбопластин |
|
|
|
Тромбин |
|
|
Фибриноген |
Фибрин |
Расстройство |
|
|
|
микроциркуляции, |
|
тромбообразование,
геморрагический
синдром
Блок, фибринолиз
Плазмин
(фибринолизин)
Истощение системы гемостаза
Плазминоген
Повреждающий фактор
Рис. 106. Схема патогенеза ДВС-синдрома
884
ном, образование которого во много раз возрастает в активированных моноцитах, макрофагах и эндотелиоцитах селезенки, печени и других органов и тканей. Многообразие изменений, обусловленных действием бактериальных агентов и их токсинов на клеточные структуры макроорганизма, систему комплемента и Хагеман-зависимые факторы свертывания, сопровождается выраженным изменением активности ряда взаимозависимых систем организма, ответственных за поддержание гомеостаза.
В первую очередь это касается калликреин-кининовой и сопряженной с ней ренин-ангиотензин-альдостероновой систем, активности ферментов, регулирующих углеводный обмен, перекисное окисление липидов, состояние симпатоадреналовой и ряда других энзиматических систем.
Весь комплекс перечисленных факторов прямо или косвенно, в различной степени способствует реологическим расстройствам, нарушению тканевой перфузии и микроциркуляции. Совокупность реологических и микроциркуляторных нарушений, объединенная понятием «сладж-синд- ром», является профазой ДВС-синдрома и, в свою очередь, усугубляет клинические проявления полиорганной недостаточности. В результате активации комплементарной, внешней и внутренней систем свертывания крови (гуморальное звено), наряду с клеточным, в частности тромбоцитарным, лейкоцитарным и эритроцитарным компонентами, происходит генерализованное включение механизмов первичного (сосудисто-тром- боцитарного) и вторичного (коагуляционного) гемостаза в патогенез, в данном случае гнойно-воспалительного заболевания.
Генерализованное включение системы гемостаза в патогенез ГВЗ сопряжено с высокой активацией тромбиновой и плазминовой систем.
Чрезмерное появление в крови активированных ключевых ферментов системы гемокоагуляции (тромбина, расщепляющего фибриноген, и плазмина, лизируюшего фибрин) рассматривается многочисленными авторами как проявление диссеминированного внутрисосудистого свертывания крови. Присутствие тромбина способствует формированию продуктов паракоагуляции или РФМК-растворимых комплексов фиб- рин-мономеров с фибрином, ранними ПДФ и фибронектином.
В связи со значительно большей, чем в норме, скоростью активации системы гемостаза прогрессивно и невосполнимо расходуются (потребляются) факторы коагуляции и тромбоциты. После незначительного повышения активности, начиная с гиперкоагуляционной стадии ДВС, неуклонно прогрессирует снижение уровня основных антикоагулянтов. Антитромбин III расходуется на инактивацию ферментных факторов свертывания. Протеин С и его кофактор протеин S, а также тромбомодулин инактивируют неферментные факторы — VIII и V.
Аналогичным образом расходуются компоненты фибринолитической системы — плазминоген и его активаторы (прекалликреин, высокомолекулярный кининоген), а также ингибиторы плазминовой системы (быстродействующий ингибитор плазмина-альфа-2-антиплазмин, альфа-2-макроглобулин, С1-эстеразный ингибитор, опосредованно тормозящий активацию плазминогена).
В результате активации механизмов гемостаза в циркулирующей крови появляются избыточные количества активированных тромбоцитов, «растворимого» фибрина и его комплексов — продуктов расслоения фиб-
885
риногенового пула плазмы, а также образуются тромбоцитарные, фибриновые, эритроцитарные, лейкоцитарные, смешанные тромбы и/или активные факторы коагуляции — Ха, тромбин и фибрин.
Клеточные и фибриновые агрегаты, «растворимый» фибрин резко повышают вязкость в сосудах микроциркуляции, способствуя возникновению острых тромбозов, развитию инфарктов, микронекрозов и тканевых геморрагии в почках, легких, надпочечниках, миокарде, печени, головном мозге и кишечнике.
Этот процесс завершается дисфункцией перечисленных органов, а в ряде случаев тяжелым профузным геморрагическим синдромом. Коагулопатия потребления ведет прежде всего к снижению уровня фибриногена, коагулируемого тромбином, вплоть до «афибриногенемии» и тяжелой тромбоцитопении. Накопившиеся в циркулирующей крови продукты протеолиза фибрина, фибриногена, факторов V, VIII и комплемента, обладающие антикоагулянтным и антиагрегационным действием, активные кинины, простагландины обусловливают парез сосудов, их повышенную проницаемость и необратимость морфологических изменений эндотелия.
Таким образом, прогрессирующее развитие диссеминированного внутрисосудистого свертывания приводит к блокаде системы микроциркуляции паренхиматозных органов с глубокой дисфункцией последних, что во многом определяет клиническую картину заболевания, ее течение и исход. Совокупность гемостазиологических изменений, регистрируемых лабораторно, в динамике заболевания в сочетании с клиническими проявлениями полиорганной недостаточности и клиническими проявлениями тромбозов и/или геморрагии (при их наличии) рассматривается как проявление ДВС-синдрома.
КЛАССИФИКАЦИЯ. Единого взгляда на классификацию и периодизацию ДВС-синдрома до настоящего времени, к сожалению, нет. Все исследователи отмечают стадийность ДВС, используя для этого различные классификации. Наиболее часто используется классификация синдрома диссеминированного внутрисосудистого свертывания крови, предложенная М. С. Мачабели (1985) и дополненная А.В. Папаяном (табл. 139).
Согласно этой классификации различают 4 стадии патологического процесса:
1. Стадия гиперкоагуляции — компенсированная, с отчетливым изменением лабораторных показателей, централизация кровообращения.
2.Стадия коагулопатии потребления — на фоне ускоренной реакции тромбопластинообразования уменьшается число тромбоцитов, снижается концентрация фибриногена (реже — протромбина, факторов V, VIII, XIII) с одновременным компенсаторным увеличением антикоагулянтной и фибринолитической активности, переходные изменения периферической гемодинамики, субкомпенсация ДВС.
3.Стадия афибриногеномии с патологическим фибринолизом — истощение коагуляционного потенциала крови и фибринолитической системы при сохраняющейся за счет ПДФ фибринолитической активности в целом, децентрализация кровообращения, декомпенсация ДВС.
886
Таблица 139
Классификация ДВС-синдрома
(по М.С. Мачабели (1985) с доп. А.В. Папаяна)
Стадия |
Степень компенсации |
1. Гиперкоагуляции Компенсированная
2.Стадия Субкомпенсированная коагулопатии
потребления
Характеристика
Отчетливое изменение лабораторных показателей централизация кровообращения
На фоне ускоренной реакции тромбоплатинообразования уменьшается число тромбоцитов, снижается концентрация фибриногена (реже — протромбина, факторов V, VIII, XIII) с одновременным компенсаторным увеличением антикоагулянтной и фибринолитической активности, переходные изменения периферической гемодинамики
3. Афибриногеномии Декомпенсированная |
Истощение коагуляционного |
с патологическим |
потенциала крови и фибриноли- |
фибринолизом |
тической системы при сохраня- |
|
ющейся за счет ПДФ фибрино- |
|
литической активности β целом, |
|
децентрализация кровообраще- |
|
ния |
4. Восстанови- |
Возвращение к физиологиче- |
тельная |
ским нормам коагуляционного |
|
потенциала |
4. Восстановительная стадия — возвращение к физиологическим нормам коагуляционного потенциала.
По характеру течения ДВС-синдрома различают: острое (от нескольких часов до нескольких недель), подострое (несколько недель), хроническое (от нескольких недель до нескольких месяцев).
По локализации процесса различают: диссеминированное внутри сосудистое свертывание и локализованное внутрисосудистое свертывание.
КЛИНИКА И ДИАГНОСТИКА. В стадии компенсации клинические симптомы ДВС трудно отличить от общих проявлений инфекционной интоксикации; признаками, позволяющими заподозрить внутрисосудистую коагуляцию, являются централизация кровообращения и гипертермия с кратковременным эффектом от жаропонижающих и сосудорасширяющих средств (гиперемия кожных покровов или бледность с цианотичным оттенком ногтевых лож и слизистых оболочек, тахикардия до 180 в 1 мин, артериальная гипертензия, лихорадка до 39—39,5° С при обычном соотношении ректальной и кожной температуры, олигурия до 5—10 мл/ч, компенсированный метаболический ацидоз).
887
Встадии субкомпенсации имеются четкие признаки централизации кровообращения: бледность кожных покровов, мраморность кожи конечностей и отлогих мест туловища, кожный геморрагический синдром
ввиде петехий, тахикардия до 180—220 в 1 мин, артериальная гипертензия с высоким диастолическим давлением, гипертермия до 40° С с умеренной разницей между кожной и ректальной температурой; неврологическая симптоматика — сомнолентность, гиперкинезы, двигательный автоматизм. Развиваются внутрисосудистая агрегация эритроцитов, некомпенсированный ацидоз (рН крови до 7, 25, BE до 11 ммоль/л), периферический гематокрит превышает венозный более чем на 0,05.
Встадии декомпенсации ДВС спазм периферических сосудов сменяется их парезом, что в сочетании с прогрессирующим повышением сосудистой проницаемости, тромбообразованием приводит к декомпенсации системы микроциркуляции. Наблюдаются мраморность кожи, симптом «белого пятна», пастозность стоп и кистей, «гипостазы» на коже спины, локализация которых меняется при перемене положения тела больного. Тахикардия до 220 в 1 мин, может быть брадикардия, у трети больных артериальное давление повышено, чаще определяются гипотония, гипертермия (у детей первых месяцев — гипотермия), стойкая анурия. Прогрессирует поражение ЦНС вплоть до комы. Геморрагический синдром разнообразен по форме и локализации: экхимозы появляются вначале на конечностях, затем распространяются на туловище, поражая всю кожу, имеют темно-вишневую окраску, на некоторых из них появляются пузыри с геморрагическим содержимым, другие некротические изменения. Могут быть кровоизлияния на слизистых оболочках. Иногда возникают тромбозы с гангреной пальцев или всей конечности. Нередко к кожному геморрагическому синдрому присоединяются макрогематурия, желудочно-кишечные кровотечения, кровотечения из мест инъекций. На фоне нарастающей неврологической симптоматики, геморрагического синдрома и гипертермии больные погибают.
При адекватности лечебных мероприятий возможен переход из любой стадии ДВС в восстановительную. При этом по мере снижения неврологической симптоматики и клинических проявлений геморрагического диатеза начинают преобладать признаки поражения наиболее пострадавшего органа: дыхательная и сердечная недостаточность на фоне токсической пневмонии, острая печеночная недостаточность (синдром Рея), острая почечная недостаточность (синдром Гассера) и т.д. Описанные выше клинические проявления ДВС-синдрома типичны не только для инфекционного процесса, но и для всех состояний, осложняющихся этим синдромом.
Безусловно, что скорость развития, смена фаз, степень их клиниколабораторных проявлений различны в каждой из представленных групп заболевания, связаны с преморбидным фоном ребенка, его реактивностью, возрастом.
Своевременная и результативная диагностика ДВС-синдрома позволяет целенаправленно вмешаться в этот процесс и предотвратить переход его в тяжелые стадии. Показания к экстренному обследованию — состояния, позволяющие заподозрить возможность массивной актива-
888
ции тромбопластинообразования: травмы, ожоги, гемотрансфузионный шок, тяжелые инфекционные токсикозы, клинические признаки субкомпенсированной и декомпенсированной стадий расстройства периферического кровообращения, острый геморрагический синдром.
Методика и объем лабораторного обследования зависят от условий, где проводится лечение больного: 1) стационары, не имеющие коагулологической лаборатории: 2) стационары, имеющие возможность исследовать основные коагулологические параметры; 3) стационары, имеющие специализированную коагулологическую службу.
Встационарах, не имеющих коагулологической лаборатории, врач должен ориентироваться на: 1) клинические критерии — периферический кровоток, кожный геморрагический синдром, кровотечения из со судов слизистых оболочек; 2) появление фрагментированных эритроцитов и снижение числа тромбоцитов в мазке периферической крови;
3)«.однопробирочный тест» — время свертывания крови и скорость лизиса образовавшегося сгустка.
Встационарах, имеющих возможность исследовать основные коагулологические параметры, врач должен ориентироваться на критерии, указанные в первой группе, определяя при этом число тромбоцитов, концентрацию фибриногена, фибринолитическую активность (табл. 140).
Встационарах, имеющих специализированную коагулологическую службу, критерии первой и второй групп дополняются тестами, отражающими всю систему гемостаза.
Большим диагностическим подспорьем могут быть и методы автоматической регистрации процесса свертывания крови на тромбоэластографе или на коагулографе. Так, на гиперкоагуляцию будут указывать укорочение времени реакции (R), времени образования сгустка (К), расширение максимальной амплитуды (МА) и увеличение максимальной эластичности сгустка (Е). В фазе потребления факторов свертывания отмечается удлинение R, К, укорочение максимальной амплитуды. В фазе повышенного фибринолиза сгусток быстро подвергается лизису, оставляя силуэт тромбоэластограммы (ТЭГ) в виде «луковицы».
Указанные лабораторные критерии будут необходимы для контроля за эффективностью проводимой терапии в динамике наблюдения.
Признаком I (гиперкоагуляционной) стадии ДВС является ускоренное протромбиназо- и тромбинообразование. По общим тестам выявляют нормальное число тромбоцитов и неизменную длительность кровотечения, укорочение времени свертывания крови, рекальцификации и генерации тромбопластина, увеличение степени тромботеста, повышение потребления протромбина. Специфические тесты — повышена адгезивная и агрегационная способность тромбоцитов, повышена (или нормальная) активность протромбина, факторов V, VIII, IX, X и I.
Для II стадии (коагулопатии потребления) ДВС характерны признаки продолжающейся активации протромбиназо- и тромбинообразования, наблюдается диссоциация ускорения тромбопластинообразования, гиперкоагуляция по общим коагуляционным тестам (см. стадию компенсации) с начинающимся уменьшением содержания факторов свертывания крови и числа тромбоцитов (их потребление) с активацией
889
Таблица 140
Показатели свертывающей системы крови при ДВС-синдроме
Показатель |
Норма |
Стадия |
|
гиперкоагуляции |
|||
|
|
||
|
|
|
|
Время свертывания по Ли—Уайту |
5—7 мин |
Укорочено |
|
Время кровотечения по Дьюку |
2—4 мин |
— |
|
Степень тромботеста |
5—6 |
4—5 |
|
Протромбиновый индекс |
80—100% |
80-100% |
|
Фибриноген, г/л |
2-Л |
4 - 6 |
|
Фибринолитическая активность, мин |
Отрицательный |
Резко |
|
|
|
положительный |
|
Количество тромбоцитов, 109/л |
200—250 |
В пределах нормы |
|
|
|
|
|
Показатель |
Стадия коагуляции |
Вторичный |
|
потребления |
фибринолиз |
||
|
|||
|
|
|
|
Время свертывания по Ли—Уайту |
Укорочено |
Удлинено |
|
Время кровотечения по Дьюку |
— |
— |
|
Степень тромботеста |
3 - 4 |
3—1 |
|
Протромбиновый индекс |
Менее 80% |
Менее 30% |
|
Фибриноген, г/л |
Менее 2 |
Менее 1 |
|
Фибриноген В |
Положительный |
Отрицательный |
|
Фибринолитическая активность, мин |
240—180 |
Менее 180 |
|
Количество тромбоцитов, 109/л |
Уменьшено |
Уменьшено |
|
|
|
|
фибринолиза. Протромбиновое время Квика, тромбиновое время, каолиновое время, в отличие от I стадии ДВС, могут быть удлинены или также не отличаться от контроля. Характерна тенденция к снижению уровня фибриногена и антитромбина III. Уровень суммарной фибринолитической активности снижен, преимущественно за счет плазминогена, а плазминовая активность в ряде случаев не отличается от контроля. Концентрация ПДФ, регистрируемая по клампинг-тесту или латекс-те- сту, в крови больных резко повышена.
В III (гипокоагуляционной) стадии ДВС-синдрома наблюдается выраженная гипокоагуляция с патологической активацией фибринолиза, удлинение времени свертывания крови, удлинение времени рекальцификации плазмы, удлинение парциального тромбопластинового времени, снижение потребления протромбина, снижение всех факторов, значительная тромбоцитопения, увеличение фибринолиза.
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА. ДВС-синдром необходимо дифференцировать с другими патологическими состояниями и заболеваниями, относящимися к группе геморрагических болезней (болезни
890
кровоточивости), которые составляют четыре группы в зависимости от того, в каком звене гемостаза произошли главные нарушения: в свертываемости крови и фибринолизе — коагулопатии; в тромбоцитарном звене, включающем количественные и качественные нарушения тромбоцитов, — тромбоцитопатии; в сосудистом звене с системным поражением микроциркуляции — вазопатии; с одновременным нарушением в разных звеньях системы гемостаза — геморрагические болезни, характеризующиеся коагуляционной, тромбоцитарной и сосудистой кровоточивостью.
Каждой группе геморрагических болезней соответствуют свои анамнестические ориентиры, определенная клиническая характеристика, тип кровоточивости. При коагулопатиях больной имеет в анамнезе хроническую рецидивирующую кровоточивость гематомного типа, передаваемую женщинами, и это свидетельствует о том, что врач имеет дело с гемофилией.
Гемофилия — наследственное заболевание, однако не всегда удается установить наследственность, и тогда говорят о спорадической (спонтанной) ее форме, являющейся следствием вновь возникших мутаций. Проявляется гемофилия гематомным типом кровоточивости с преимущественным поражением суставов и в отличие от всех геморрагических болезней имеет увеличенное время свертывания крови.
Оценка гемостазиограммы обнаруживает гипокоагуляцию вследствие снижения в крови больного VIII (редко IX) фактора свертывания и резкого нарушения протромбиназообразования с увеличением времени свертывания крови по Ли—Уайту и времени аутокоагуляционного теста (АКТ).
В периоде новорожденное™ ДВС-синдром дифференцируют с геморрагической болезнью новорожденных, для которой характерно снижение в крови ребенка уровня К-витаминзависимых факторов свертывания крови: II, VII, X, IX до 30—70% нормы. При этом отсутствует семейный геморрагический анамнез. В отличие от гемофилии, это приобретенный дефицит факторов протромбинового комплекса на коротком промежутке времени, до восстановления синтеза витамина К в кишечнике новорожденного на 5—7 днях жизни. Кровоточивость устраняется инфузией нативной донорской плазмы (до 50 мл) с одновременным внутримышечным введением 3—5 мг викасола (0,5 мл 1%-го раствора).
Тромбоцитопатии чаще всего бывают представлены тромбоцитопенической пурпурой (ТПП) — геморрагическим заболеванием с нарушением тромбоцитарного компонента гемостаза, обусловленным уменьшением количества тромбоцитов крови (ниже 150 · 109/л), которое может быть вызвано усиленным разрушением, повышенным потреблением, недостаточным образованием тромбоцитов. Нарушение тромбоцитарного гемостаза характеризуется петехиально-пятнистым типом кровоточивости и триадой: уменьшением числа тромбоцитов в периферической крови, увеличением времени кровотечения по Дьюку, снижением ретракции кровяного сгустка. Собственно тромбоцитопатии отличаются от тромбоцитопенической пурпуры нормальным количеством тромбоцитов в периферической крови, со своими особенностями нарушения качества тромбоцитов. Наиболее часто встречающаяся болезнь Виллебранда характеризуется смешанным типом кровоточивости (наиболее часто
891
