
0250 / Педиатрия_Майданник
.pdf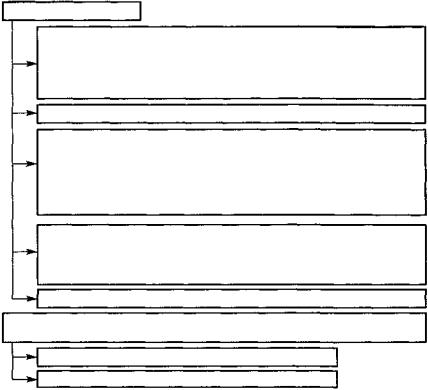
А. Клинические классы
Сахарный диабет Инсулинозависимый сахарный диабет
Инсулинонезависимый сахарный диабет: а) у лиц, не страдающих ожирением; б) у лиц, страдающих ожирением
Сахарный диабет, связанный с нарушением питания
Другие типы диабета, связанные с некоторыми состояниями или синдромами: 1) заболеваниями поджелудочной железы;
2) болезнями гормональной этиологии; 3) состояниями, вызванными лекарственными средствами или химическими соединениями; 4) изменениями инсулина или его рецепторов; 5) некоторыми генетическими синдромами; 6) прочими состояниями
Нарушенная толерантность к· глюкозе:
а) у лиц, не страдающих ожирением; б) у лиц, страдающих ожирением;
в) связанная с определенными состояниями и синдромами
Диабет беременных
Б.Классы статистического риска (лица с нормальной толерантностью
кглюкозе, но со значительно увеличенным риском развития диабета)
Предшествующее нарушение глюкозотолерантности
Потенциальное нарушение глюкозотолерантности
Рис. 107. Классификация сахарного диабета и близких категорий нарушения толерантности к глюкозе (ВОЗ, 1985)
ненная форма диабета среди детей и молодых лиц в популяциях европейского происхождения.
Понятие «инсулинозависимый сахарный диабет» объединяет заболевания, которые раньше называли ювенильным диабетом, диабетом со склонностью к кетозу, а позднее — диабетом I типа. Однако термин «1 тип» применяется также для обозначения конкретного патологического процесса. Поэтому использование этого термина в качестве синонима инсулинозависимого сахарного диабета больше не рекомендуется.
Инсулинонезависимый сахарный диабет часто остается бессимптомным в течение многих лет, и больные обращаются к врачу уже по поводу осложнений диабета, или после случайного обнаружения сахара в моче либо повышенного уровня глюкозы в крови. У больных инсулинонезависимым сахарным диабетом диабетический кетоацидоз спонтанно не развивается, но иногда кома может быть обусловлена крайне высокой гипергликемией и гиперосмолярностью. Однако при тяжелых инфекционных и других заболеваниях или при голодании возможность развития ацидоза и кетоза у больных ИНЗСД сохраняется.
902
На долю ИНЗСД приходится около 85% всех случаев диабета в развитых странах, а также множество его случаев в развивающихся странах, особенно тех, в которых распространенность этого заболевания высока. ИНЗСД чаще возникает в определенных семьях и с исключительно высокой частотой (до 35% среди всего взрослого населения) встречается в популяциях, изменивших традиционный образ жизни на современный, т.е. среди некоторых групп американских индейцев, жителей островов Тихого океана, австралийских аборигенов и выходцев из Индии. Эта форма диабета у лиц европейского происхождения диагностируется обычно в возрасте старше 40 лет. Однако в популяциях высокого риска, упомянутых выше, ИНЗСД наблюдается и у лиц более молодого возраста.
Частота ИНЗСД в детском возрасте неизвестна. В основе патогенеза ИНЗСД выделяются три главных звена: 1) периферическая инсулинорезистентность; 2)нарушение функции бета-клеток; 3) повышенная выработка глюкозы печенью. Исходя из этого причины ИНЗСД — генетически обусловленные дефекты синтеза инсулина, рецепторов к инсулину, пострецепторных механизмов. В результате синтезируется аномальный инсулин или снижается чувствительность тканей к нему. Бета-клетки поджелудочной железы гиперплазированы, имеется относительная инсулиновая недостаточность. Течение ИНЗСД — длительное, латентное; при манифестации — более легкое, без склонности к кетоацидозу. У детей в связи с более высокой потребностью в инсулине может протекать как ИЗСД, иногда дает длительные ремиссии.
Категория нарушенной толерантности к глюкозе (НТГ) включает тех лиц, у которых результаты глюкозотолерантного теста выходят за рамки нормы, определенной Исследовательской группой ВОЗ в 1985 году. В целом по группе у таких лиц вероятность прогрессирования нарушений повышена, и у многих из них эти нарушения достигают степени, удовлетворяющей критериям сахарного диабета.
ИНСУЛИНОЗАВИСИМЫЙ САХАРНЫЙ ДИАБЕТ. Возникает у генетически предрасположенных лиц в результате разрушения бета-кле- ток поджелудочной железы на фоне определенных иммунологических явлений. Это — исподволь развивающийся процесс, способный длиться несколько лет. На «преддиабетической» стадии развития болезни таких лиц часто, но не всегда, можно выявить по присутствию иммунологических маркеров и по снижению функции бета-клеток поджелудочной железы.
ЭТИОЛОГИЯ. До настоящего времени полностью не выяснена. Большинство авторов указывают, что в развитии ИЗСД ведущее значение имеет сочетание генетических и внешних факторов. Это подтверждается, прежде всего, значительными этническими и географическими различиями в распространенности и частоте ИЗСД. Самые высокие показатели обнаруживаются в северных странах, особенно в Финляндии, в возрастной группе 0—14 лет (35 случаев в год на 100 000 населения), а самые низкие — в Азии (0,5—1,3 случая в год на 100 000 населения); низкие показатели регистрируют обычно и в странах Африки, Северной и Латинской Америки. Следовательно, у негров, индейцев, эскимосов
903
инсулинозависимый сахарный диабет практически не встречается, что подтверждает его генетическую природу. Считают, что различия средовых и генетических детерминант могут определять разницу в частоте ИЗСД в 20-60 раз.
Наследование возможно как по доминантному, так и по рецессивному типу. В последние годы выдвинута гипотеза о полигенном наследовании инсулинозависимого сахарного диабета.
Данные о существовании генетической предрасположенности были получены в исследованиях на близнецах: обнаружен более высокий показатель конкордантности инсулинозависимого сахарного диабета среди монозиготных близнецов (25—30%), чем среди дизиготных (5—10%).
Кроме того, реальный риск инсулинозависимого сахарного диабета повышен у ближайших родственников больных. Среди белого населения Соединенных Штатов Америки общий показатель риска составляет 0,2—0,4%, тогда как у сибсов пробандов с инсулинозависимым сахарным диабетом он равен 5%.
Известно, что инсулинозависимый сахарный диабет довольно часто бывает у членов одной семьи. На основании обобщенных данных установлено, что инсулинозависимый сахарный диабет развивается как наследственное заболевание у 10—47% больных. Число диагностированных случаев сахарного диабета в семьях, где есть больной диабетом, зависит от длительности наблюдения. За 40 лет от начала наблюдения число выявленных больных диабетом возрастает с 20 до 75%. Если сахарным диабетом больны оба родителя, то риск заболевания у ребенка нередко доходит до 20%. Американские исследователи рассчитали вероятность развития сахарного диабета при наличии больного в семье (табл. 141).
Генетическая предрасположенность к инсулинозависимому сахарному диабету определяется в основном генами, локализованными на коротком плече 6-й хромосомы — в тесной близости к главному комплексу гистосовместимости или в его составе, т.е. области расположения генов HLA. Среди лиц европейского происхождения, больных инсулинозависимым сахарным диабетом, легко выявляемые DR3 и DR4 аллели локуса HLA встречаются с повышенной частотой, причем непропорционально
Таблица 141
Эмпирический риск развития инсулинозависимого сахарного диабета
Родственники с ИЗСД |
Риск развития ИЗСД, % |
|
|
Отец |
2,5 |
Мать |
1,5 |
Оба родителя |
15—20 |
Мать и сестра (брат) |
3 |
Родной брат или сестра |
3 |
Монозиготный близнец |
40 |
|
|
904
чаще наблюдается гетерозиготное носительство DR3/DR4 (у 30% больных инсулинозависимым сахарным диабетом по сравнению всего лишь с 3% в общей популяции). Приблизительно у 95% лиц европейского происхождения, больных инсулинозависимым сахарным диабетом, обнаруживаются DR3, DR4 или DR3/DR4, тогда как в популяции они встречаются у 40% наблюдавшихся.
Предрасположенность к данному заболеванию связана также с аллелями HLA-DQ, причем такая связь прослеживается среди всех этнических групп. Таким образом, у лиц европейского происхождения специфическая предрасположенность к инсулинозависимому сахарному диабету ассоциируется с HLA-DR3, DQW2 и с HLA-DR4, DQWS.
Имеются данные, что ИЗСД развивается в 3 раза чаще у лиц, имеющих лейкоцитарные антигены В8, В15, В18, DR3, DR4, DRw3, DRw4. Наследование HLA-DR3 увеличивает возможность заболевания ИЗСД в 7 раз, HLA-DR4 — в 9 раз, а при сочетани HLA-DR3 и DR4 риск возникновения сахарного диабета повышается в 14 раз (табл. 142).
Таблица 142
Относительный риск развития инсулинозависимого сахарного диабета вследствие действия
HLA-DR антигенов
HLA-DR |
Относительный риск |
|
|
DR2 |
0,12 |
DR3 |
7,39 |
DR4 |
9,25 |
DR7 |
0,12 |
DR3, DR4 |
14,26 |
|
|
Антиген DR3 более часто встречается у мальчиков, a DR4 — у девочек. У HLA-позитивных больных клиническая картина более выражена, у DR3-no3HTHBHbix пациентов наблюдаются более частые и длительные ремиссии, они менее склонны к кетоацидозу.
Однако необходимо подчеркнуть, что с некоторыми аллелями главного комплекса гистосовместимости ассоциируется защита от развития инсулинозависимого сахарного диабета. К таким аллелям относятся HLA-DR2 и HLA-DQB1. Эффект защитных аллелей, по-видимому, преобладает над эффектом аллелей предрасположенности.
Предполагают, что наследственный компонент ИЗСД обусловливает либо дефект определенных локусов на коротком плече 6-й хромосомы, приводящий к изменению белков мембран бета-клеток поджелудочной железы, которые становятся менее устойчивыми к повреждающим факторам, либо в происхождении ИЗСД имеет также значение наследственно обусловленный дефект генов, контролирующих иммунный ответ, что обусловливает склонность к аутоиммунным реакциям.
905
Генетическая предрасположенность реализуется при наличии пускового механизма. Роль провоцирующего фактора могут играть вирусы. Показано, что бета-клетки поджелудочной железы могут избирательно поражаться бета-тропными вирусами. Например, к таковым относятся вирус Коксаки В4, цитомегаловирус, вирус кори, вирус Эпштейна—Барра, вирусы эпидемического паротита, ветряной оспы, гриппа, гепатита. Но in vitro проникновение в бета-клетки поджелудочной железы показано только для вируса эпидемического паротита.
Развитие инсулинозависимого сахарного диабета возможно при внутриутробном заражении различными вирусами. В частности, заболевание развивается почти у 20% детей с врожденной краснухой. В данном случае вирусная инфекция, возникающая in utero, отделена во времени от первых клинических проявлений диабета.
Способностью инициировать повреждение бета-клеток поджелудочной железы обладают некоторые химические яды. Уже много десятилетий для моделирования деструкции панкреатических бета-клеток используется ряд химических агентов. При этом в опытах с экспериментальными животными наиболее широко применяются аллоксан и стрептозотоцин. Патология, которую они вызывают, очень похожа на инсулинозависимый диабет у детей.
Известная роль в развитии сахарного диабета принадлежит психическим и физическим травмам. По-видимому, психическая травма лишь способствует манифестации скрытого сахарного диабета, т.е. неполноценность инсулярного аппарата проявляется в период повышенных требований к нему, особенно при повторных травмах или стрессовых состояниях.
Сравнительно редкой причиной ИЗСД у детей раннего возраста является врожденная гипоплазия поджелудочной железы со снижением не только инкреторной, но и внешнесекреторной функции.
Возможно, среди факторов окружающей среды играет роль также питание в грудном возрасте и раннем детстве. Потребление белков коровьего молока, особенно в раннем периоде жизни, может повышать предрасположенность к инсулинозависимому сахарному диабету.
Несомненно, отражается на состоянии инсулярного аппарата избыточное питание. Пробы с нагрузкой у лиц, систематически переедающих, как правило, выявляют гиперинсулинемическую гликемическую кривую. Мнение, что сахарный диабет чаще встречается у питающихся преимущественно жирами, подтверждают и статистические, и экспериментальные данные: не углеводы, а жиры в избыточном количестве способствуют истощению бета-клеток. Однако избыточное употребление детьми сладостей не может не вести к усилению функции инсулярного аппарата. Для повышенной секреции инсулина при избыточном питании имеет значение и объем принимаемой пищи.
У больных сахарным диабетом матерей нередко рождаются вполне здоровые дети, часто более крупные, чем в норме. Такие дети нормально прибавляют массу тела на 1—2-м году жизни, но затем у них развивается сахарный диабет. Некоторые из таких матерей на 5—6-м месяцах беременности чувствовали себя хорошо и не только сокращали дозу ин-
906
сулина, но часто совсем отказывались от него. Это создавало большую нагрузку на развивающийся инсулярный аппарат плода и обусловливало его раннее истощение. Следовательно, в особом внимании педиатров нуждаются новорожденные, матери которых страдают сахарным диабетом. Как правило, эти новорожденные отличаются от здоровых детей: масса тела увеличена, щеки круглые, шея короткая, ткани пастозны, на голове — густые волосы. Вместе с тем физическое развитие недостаточно. Масса тела увеличивается главным образом за счет нарастания массы жировой ткани.
Провоцирующими факторами в развитии ИЗСД являются ожирение, гиподинамия, прием препаратов с контринсулярным эффектом, заболевания, сопровождающиеся повышением уровня контринсулярных гормонов: гормона роста (при акромегалии), кортизола (при болезни или синдроме Иценко—Кушинга), тироксина и трийодтиронина (при тиротоксикозе), адреналина и норадреналина (при феохромоцитоме).
ПАТОГЕНЕЗ. В настоящее время общепризнано, что патогенез инсулинозависимого сахарного диабета складывается из генетической предрасположенности к заболеванию и действия нескольких триггерных факторов окружающей среды, способных активировать механизмы, обусловливающих прогрессирующую убыль бета-клеток поджелудочной железы.
Большинство исследователей считают, что ИЗСД развивается в результате аутоиммунного инсулита, приводящего к деструкции бета-кле- ток и хронической гипергликемии.
Внастоящее время в патогенезе инсулинозависимого сахарного диабета можно выделить шесть стадий.
I стадия — воздействие пусковых факторов (бета-цитотропные вирусы, химические агенты и др.) на детей с генетической предрасположенностью, ассоциированной с HLA-потенциальным ИЗСД. В этой стадии под влиянием пусковых факторов происходит интенсивный синтез HLAантигенов на бета-клетках и на сосудистом эндотелии, клеточная инфильтрация ткани поджелудочной железы активированными макрофагами, Т-лимфоцитами и В-лимфоцитами.
Вэтой стадии нет ни аутоиммунных, ни биохимических нарушений, характерных для сахарного диабета.
II стадия — избирательное повреждение бета-клеток поджелудочной железы. Это происходит частично в результате непосредственного воздействия пусковых факторов. Возникает неспецифическая воспалительная реакция в результате продукции активированными макрофагами цитокинов, индуцирующих высвобождение свободных радикалов кислорода и окиси азота, которые особенно сильно повреждают бета-клетки.
ВIII стадии — в результате нарушенного иммунного ответа возникает активный аутоиммунный инсулит, увеличивается количество активированных Т-лимфоцитов и повышается активность В-лимфоцитов, которые активно синтезируют антитела. При этом у 80—90% больных определяются антитела к поверхностному антигену бета-клеток, цитоплазматическим компонентам бета-клеток, белку 64К; наблюдаются также антиинсулиновые антитела.
907
Исследования антител к цитоплазматическим антигенам островковых клеток, аутоантител к инсулину позволили обнаружить ряд аутоантигенов, против которых направлена реакция. Такие антигены часто, но не всегда, выявляются на ранних этапах развития болезни, еще до постановки клинического диагноза.
Специфическими маркерами разрушения инсулярного аппарата является гетерогенная группа аутоантител к островкам поджелудочной железы. В настоящее время известны цитоплазматические антитела к островкам, неспецифические для бета-клеток; антитела, фиксирующие антитела, которые реагируют с антигеном поверхности островковых клеток; антитела, реагирующие с белком 64К, присутствующим в островках.
Обнаруживается также Т-клеточная реактивность по отношению к глютаматдекарбоксилазе и антитела — к глютаматдекарбоксилазе.
Определенную роль может играть и белок поверхности бета-клеток поджелудочной железы — р69, антитела к которому можно найти в момент диагноза инсулинозависимого сахарного диабета. Вначале эти антитела были обнаружены по их способности взаимодействовать с 17-аминокислотной последовательностью бычьего сывороточного альбумина, что позволило предположить роль белков коровьего молока в качестве средового триггера, инициирующего иммунную атаку на бетаклетки.
Вэтой стадии первоначально секреция инсулина не нарушена, сохраняется нормогликемия.
ВIV стадии в результате деструкции части бета-клеток отмечается снижение секреции инсулина в ответ на введение глюкозы при сохранении нормогликемии натощак (латентный сахарный диабет, нарушенная толерантность к углеводам); диагностируется редко.
V стадия — явный ИЗСД. Клиническая манифестация заболевания развивается остро после гибели 90% бета-клеток; при этом еще сохраняется секреция инсулина.
VI стадия характеризуется полной деструкцией бета-клеток и абсолютной инсулиновой недостаточностью.
В дальнейшем патогенетические механизмы инсулинозависимого сахарного диабета обусловлены дефицитом инсулина. В результате снижаются анаболические и повышаются катаболические процессы, а также увеличивается секреция контринсулярных гормонов (глюкагона, кортизола, гормона роста, катехоламинов).
Дефицит инсулина затрагивает не только углеводный, но и жировой, белковый, электролитный и водный обмены. Дефицит инсулина сказывается на функционировании дыхательной системы, ЦНС, сердечнососудистой системы, почек и желудочно-кишечного тракта.
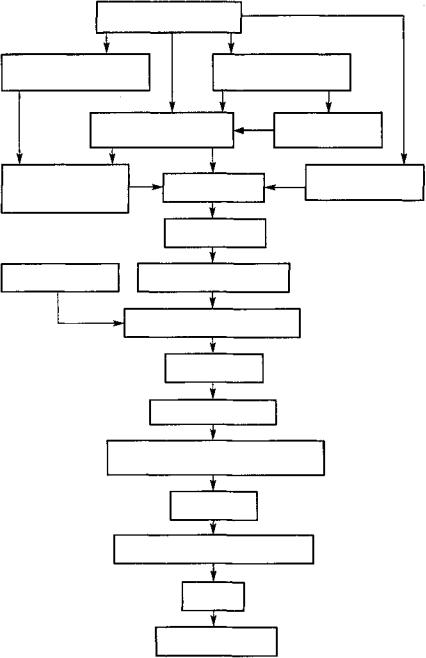
Недостаток инсулина приводит прежде всего к нарушению обмена глюкозы. Уменьшается активность гексокиназы, и снижается транспорт глюкозы в клетки печени, жировой, мышечной ткани, т.е. снижается утилизация глюкозы периферическими тканями — в основном мышечной и жировой. Это в какой-то степени обусловливает развитие гипергликемии, которая дополнительно возрастает также в результате увеличения активности глюкозо-6-фосфатазы и повышения гликогенолиза в
. «
908
печени и мышцах. В повышении концентрации сахара в крови играет роль и глюконеогенез.
Когда концентрация глюкозы в крови превысит почечный порог, который составляет более 10,2 ммоль/л, начинается глюкозурия и возникает осмотический диурез. Это лежит в основе полиурии — первого симптома диабета. Часто присоединяется тошнота и рвота, которые усугубляют дегидратацию и препятствуют приему пищи и воды.
Потеря воды и электролитов с мочой, не компенсируемая их поступлением в организм, приводит к дегидратации и гемоконцентрации. Это, в свою очередь, вызывает недостаточность периферического кровообращения из-за резкого падения объема циркулирующей крови. Развивается гипотензия, приводящая к снижению почечного кровотока (иногда вплоть до полной анурии). Генерализованная аноксия тканей, способствующая смещению метаболизма в сторону анаэробного гликолиза, обуславливает повышение концентрации молочной кислоты в крови. Спустя некоторое время после возникновения недостаточности периферического кровообращения развивается кома. В отсутствие лечения неизбежно наступает смерть. Описанная последовательность процессов представлена на рисунке 108.
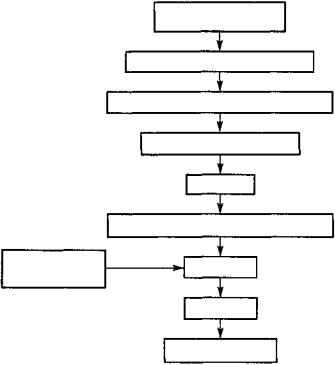
Относительная недостаточность инсулина и снижение уровня утилизации глюкозы жировой тканью организма приводят к значительному «опустошению» жировых депо. В результате может возникать вторичная гипертриглицеридемия, так как в печени из свободных жирных кислот синтезируются липопротеины очень низкой плотности. В печени увеличивается содержание жиров, большую часть которых она, по описанным выше причинам, способна окислять только до стадии ацетил-КоА.
В результате усиленного липолиза (рис. 109) накапливаются органические умеренно сильные кислоты (бета-оксимасляная, ацетоуксусная) и ацетон (так называемые кетоновые тела). Развивающаяся кетонемия имеет два основных следствия: 1) она усугубляет метаболический ацидоз — сначала компенсированный, затем декомпенсированный, приводя тем самым к характерному глубокому и быстрому дыханию Куссмауля, которое служит одним из диагностических признаков диабетического ацидоза; 2) когда кетонемия превысит почечный порог реабсорбции кетоновых тел, последние появляются в моче. Их экскреция почками уменьшает содержание в организме связанных оснований, что дополнительно ведет к потере натрия. Это означает ослабление ионного «скелета» внеклеточной жидкости и тем самым — прогрессирующее уменьшение способности организма «удерживать» воду.
Декомпенсированный метаболический ацидоз, дегидратация, потеря электролитов являются причинами расстройства функции ЦНС, сер- дечно-сосудистой системы и летального исхода при отсутствии лечения.
Дефицит инсулина и нарушение утилизации глюкозы приводит к снижению синтеза белка (рис. ПО) и поэтому — к преобладанию его распада, прежде всего — в инсулиночувствительных тканях, особенно мышцах. Этот процесс сопровождается потерей организмом азота, а также выходом К+ и других внутриклеточных ионов в кровь с последующей экскрецией К+ с мочой.
909
ДЕФИЦИТ ИНСУЛИНА |
|
||
Повышение активности |
|
Снижение активности |
|
глюкозо-6-фосфатазы |
|
гексокиназы |
|
Снижение |
утилизации |
|
Уменьшение |
глюкозы |
|
синтеза АТФ |
|
Повышение |
Гипергликемия |
Повышение |
|
гликогенолиза |
глюконеогенеза |
||
в печени и мышцах
|
Глюкозурия |
Тошнота, рвота |
Осмотическиий диурез |
|
Потеря воды и электролитов
Дегидратация
Гемоконцентрация
Недостаточность периферического кровообращения
Гипотензия
Снижение почечного кровотока
Анурия
КОМА И СМЕРТЬ
Рис. 108. Влияние дефицита инсулина на углеводный обмен
910
ДЕФИЦИТ ИНСУЛИНА
Снижение утилизации глюкозы
Снижение липогенеза в жировых депо
Мобилизация жира из депо
Липемия
Повышение кетогенеза в печени
Метаболический |
Кетонемия |
|
ацидоз |
||
|
Кетонурия
Потеря натрия
Рис. 109. Влияние дефицита инсулина на жировой обмен
Дефицит инсулина сказывается на функциях клеток не только из-за нарушения обмена белков, но и из-за других эффектов. Например, прогрессирующая потеря воды приводит, в конце концов, к внутриклеточной дегидратации, которая способствует катаболическим процессам и диффузии электролитов во внеклеточную жидкость. Пока продолжается выделение мочи, существует опасность потери организмом К+ во все более угрожающих количествах.
При сочетании ацидоза и дегидратации содержание 2,3-бисфосфо- глицероловой кислоты (2,3-БФГ), которая является аллостерическим модулятором гемоглобина, в эритроцитах падает. Это приводит к повышению сродства гемоглобина к кислороду и уменьшению поступления его в ткани через капиллярные стенки. Таким образом, кислородное снабжение тканей, нарушенное из-за недостаточности периферического кровообращения, еще больше ухудшается. К факторам, регулирующим образование 2,3-БФГ в эритроцитах, относится доступность фосфата. При его дефиците уровень 2,3-БФГ снижается, при избытке — может возрастать.
При объединении всех перечисленных изменений на одной схеме выясняются некоторые существенные моменты (рис. 111). Прежде всего,
911
