
0250 / Педиатрия_Майданник
.pdfпервичный гипотироз. При вторичном и третичном гипотирозе снижены уровни тироидных гормонов, а показатели ТТГ могут оставаться нормальными или незначительно сниженными (табл. 154).
Уровень СБЙ при гипотирозе снижен. Однако, если он обусловлен нарушением биосинтеза и секреции тироидных гормонов и сопровождается попаданием в кровь аномальных йодпротеинов, уровень СБЙ в сыворотке может быть повышен. Необходимо помнить, что у детей первых месяцев жизни уровень СБЙ может оставаться в пределах нормы даже при выраженной клинике заболевания.
Использование радиоактивного йода с диагностической целью у детей не нашло широкого распространения, так как его поглощение может указывать лишь на присутствие ткани щитовидной железы и ее способность задерживать йод. Этот метод применяют только для выявления апластических форм гипотироза.
При подозрении на дистопию, эктопию щитовидной железы и узлы в ней большую помощь оказывает сканирование с 99п1Тс-пертехнетатом.
Общедоступным диагностическим тестом служит определение содержания холестерина в сыворотке крови: характерно его повышение вследствие снижения метаболизма выделения холестерина с желчью. Гиперхолестеринемия может предшествовать манифестной клинике гипотироза. Однако у детей первых месяцев жизни уровень холестерина может оставаться нормальным.
|
|
|
|
Таблица 154 |
Дифференциально -диагностические критерии |
||||
|
различных форм гипотироза |
|
||
|
|
|
|
|
Показатели |
|
|
Гипотироз |
|
|
|
|
|
|
|
|
первичный |
вторичный |
третичный |
|
|
|
|
|
Уровень гормонов: |
|
|
|
|
Т4, нмоль/л |
|
Снижен < 60 |
Снижен < 60 |
Снижен < 60 |
Т3, нмоль/л |
|
Снижен < 0,5 |
Снижен < 0,5 |
Снижен < 0,5 |
ТТГ, мМЕ/л |
|
Повышен > 10 |
Снижен < 0,1 |
Снижен или |
|
|
|
|
норма |
Поглощение ЩЖ 13Ч |
|
Снижено |
Снижено |
Снижено |
Проба с ТТГ: |
|
|
|
|
т«. т3 |
|
Снижение |
Повышение |
|
Поглощение 1311 |
|
Снижено |
Повышено |
|
|
|
|
(> в 2 раза) |
|
Проба с тиролиберином: |
|
|
||
т3 . т4 |
|
Незначительное Практически |
Умеренное |
|
|
|
повышение |
не изменяется |
повышение |
ТТГ |
|
Резкое |
Остается |
Умеренное |
|
|
повышение |
сниженным |
повышение |
|
|
|
|
|
9 5 2
В диагностике гипотироза у детей помогает рентгенологическое исследование, выявляющее характерный эпифизарный дисгенез. Отсутствие этого симптома ставит диагноз врожденного гипотироза под сомнение.
Гипотироз влечет за собой соответствующий электрокардиографический синдром. На ЭКГ снижен вольтаж зубцов, замедлена проводимость, синусовая брадикардия. На ЭЭГ определяются патологические медленные волны, недостаточная выраженность α-ритма. В крови нередко отмечают анемию (нормоили гипохромная), часто повышена
соэ.
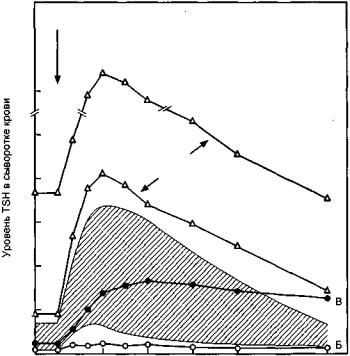
В диагностике первичного и вторичного гипотироза решающее значение принадлежит изучению секреции ТТГ и исследованию поглощения радиоактивного йода щитовидной железой до и после введения гормона (табл. 154). Проба с ТТГ основана на его способности повышать функцию щитовидной железы. Эти же тесты применяют для диагностики третичного гипотироза, но вместо ТТГ внутривенно вводят тиролиберин (рис. 115). Для первичного гипотироза характерно сниженное
TRH
100
50
А
40
30
20
10
0 |
30 |
60 |
Время (мин) 120 |
180 |
Рис. 115. Изменение уровня тиротропного гормона (TSH) на введение тиролиберина (TRH) у больных
при первичном (А), вторичном (Б) и третичном (В) гипотирозе
953
содержание свободного Т4 при повышенном уровне ТТГ в сыворотке крови. Низкое содержание Т4 и Т, в сыворотке крови и сниженное поглощение йода щитовидной железой остаются и после стимуляции ТТГ, если у больного имеется первичный гипотироз. При вторичном гилотирозе при базальных условиях выявляется сниженное содержание как свободного Т4, так и ТТГ в сыворотке крови. После стимуляции ТТГ уровень тироидных гормонов в сыворотке крови повышается. При третичном гипотирозе концентрация ТТГ в сыворотке крови снижена и увеличивается в ответ на введение тиролиберина.
В раннем детском возрасте дифференциальную диагностику следует проводить с рахитом, болезнью Дауна, родовой травмой, желтухой различного генеза, анемиями. У более старших детей необходимо исключить заболевания, сопровождающиеся задержкой роста (хондродистрофия, гипофизарный нанизм и т.д.). Иногда деформирующий остеохондрит (болезнь Пертеса) может стимулировать эпифизарный дисгенез при гипотирозе. Следует помнить, что деформирующий остеохондрит представляет собой деструктивный процесс в эпифизах, до того нормально сформированных. Кроме того, болезнью Пертеса поражается один эпифиз и часто имеет место болевой синдром.
Изменения сердечно-сосудистой системы у детей с гипотирозом нередко стимулируют заболевания сердца — ревматизм, врожденные пороки. При выраженных отеках кожи и подкожной клетчатки необходимо исключить заболевания почек.
При дифференциальной диагностике гипотироза необходимо помнить и о фенилкетонурии, при которой возможны явления выраженного гипотироза.
ЛЕЧЕНИЕ. Основным методом лечения гипотироза у детей является заместительная терапия тироидными препаратами. При гипофизарном и гипоталамическом гипотирозе патогенетическим методом лечения служит применение ТТГ и ТРГ. Однако и при этих формах гипотироза в настоящее время проводят также в основном заместительную терапию тироидными препаратами, дающими хороший и стойкий эффект. Основная цель лечения — компенсация недостаточности щитовидной железы и устранение обменных нарушений.
Необходимо установить индивидуальную, адекватную дозу тироидных препаратов. Она зависит от степени недостаточности щитовидной железы и чувствительности больного к препарату, но не определяется ни возрастом, ни массой тела. Условно все лечение можно разделить на два этапа: на первом необходимо ликвидировать дефицит тироидных гормонов в организме ребенка, добиться эутироидного состояния, а на втором — сохранить состояние эутироза. Гипотироз лечат максимально переносимыми дозами тироидных препаратов, что обеспечивает оптимальное психическое и физическое развитие ребенка.
Начальные дозы тироидных гормонов назначают в зависимости от степени тяжести тироидной недостаточности, возраста больного, наличия сопутствующих заболеваний. Повышать дозу тироидных гормонов следует с осторожностью. Для появления полного эффекта применяе-
954

мой дозы гормонов необходимо выждать опреленное время. Так, для проявления полного действия Т3 требуется 2—2,5 нед, Т4 — 4—6 нед.
Препаратом выбора для лечения гипотироза у детей является L-ти- роксин. Начальная суточная доза для детей составляет до 3—4 мкг/кг. В течение 2—4 недель дозу постепенно повышают, доводя до оптимальной под контролем клинического и лабораторного обследования. Рекомендуемые дозы L-тироксина для лечения детей, больных гипотирозом, представлены в таблице 155. Указанные количества L-тироксина, как правило, достаточны для восстановления уровня как общего, так и свободного Т4 в сыворотке крови и его содержания в печени, а постоянная конверсия (по мере необходимости) в Т3 создает минимальные колебания этого биологически более активного гормона в крови. С увеличением возраста больного необходимая терапевтическая доза L-тироксина обычно снижается.
Следует отметить, что всасываемость L-тироксина выше при приеме натощак. После однократного приема максимальный уровень в крови с переходом в плато достигается через 4—6 ч, и постоянный уровень Т3 в крови сохраняется в течение суток. В связи с этим индивидуально подобранную суточную дозу Т4 принимают однократно (утром натощак). Максимум действия Т4 — на 10—12-й день, а длительность — 1—3 нед. В настоящее время доказано, что большая часть Т4 превращается в периферических тканях в более активный Т3, обладая свойством депонирования.
Необходимо подчеркнуть, что некоторые лекарственные вещества, содержащие гидроксид алюминия (альмагель и др.) или сульфат железа, взаимодействуют с L-тироксином и изменяют абсорбцию последнего из кишечника. В этой связи применение тироксина следует рекомендовать не ранее чем через 4 ч после приема указанных препаратов. Кроме того, такие вещества, как рифампицин, фенитоин, карбамазепин ускоряют обмен L-тироксина, и при их одновременном приеме дозы тироксина должны быть увеличены.
Таблица 155
Рекомендуемые дозы L-тироксина при лечении детей, больных гипотирозом
(по Letarte, Garagorri, 1989)
Возраст |
|
Доза |
|
|
|
|
|
|
мкг/кг/сут |
|
мкг/сут |
|
|
|
|
0—6 мес |
8 |
25 |
—50 |
6—12 мес |
6 |
50—75 |
|
1—5 лет |
5 |
75—100 |
|
6—12 лет |
4 |
100 |
—150 |
> 12 лет |
3 |
150 |
—200 |
955
В некоторых случаях гипотироза тиротом является препаратом выбора и имеет преимущества перед L-тироксином. Это относится к наблюдениям, при которых умеренные клинические проявления гипотироза сопровождаются высоким (иногда 30—40 мЕД/мл) уровнем ТТГ в сыворотке крови. Сравнительно редко встречается недостаточность 5-дейода- зы III типа, под влиянием которой происходит конверсия Т4 в Т3 в гипофизе, что необходимо для нормальной регуляции ТТГ. В случае указанной патологии только применение тиротома, а не L-тироксина приводит к снижению повышенного содержания ТТГ в сыворотке крови, который, как известно, является показателем компенсации гипотироза. Тиротом является комбинированным препаратом, одна таблетка которого содержит 40 мкг L-тироксина (Т4) и 10 мкг лиотиронина (Т3).
Кроме того, для лечения гипотироза могут применяться другие препараты тироидных гормонов: а) тироидин (высушенная щитовидная железа животных), стандартизация которого проводится по содержанию органически связанного йода. Содержание йода в тироидине должно составлять от 0,1 до 0,23%. В зависимости от вида животного, из щитовидной железы которого приготовляется препарат, тироидин содержит Т4 и Т3 в соотношении 2—4,5:1 (2—3:1 в препарате щитовидной железы свиньи, 3:1 — крупного рогатого скота, 4,5:1 — овец). В большинстве стран мира тироидин уже не применяется из-за невозможности точно стандартизовать содержание тироидных гормонов в препарате; б) трийодтиронин; в) тирокомб, одна таблетка которого содержит 70 мкг тироксина, 10 мкг трийодтиронина и 150 мкг йодида калия.
При постепенном подборе адекватной дозы тироидина лечение ребенка раннего возраста начинают с 10—15 мг/сут, увеличивая ее еженедельно на 10—15 мг. Для детей старшего возраста начальная доза составляет 30—40 мг. Сторонники больших доз в начале лечения рекомендуют сразу назначать высшую суточную дозу тироидина (0,05 г для детей раннего возраста, 0,2—0,3 г для старших) до появления легких признаков тиротоксикоза, а затем постепенно снижают ее до адекватной. Действие тироидина связано с присутствием в нем тироидных гормонов (Т4 и Т3). Начальное действие тироидина проявляется на 2-е—3-й сутки, а обменные процессы нормализуются только через месяц. Максимальное действие однократной дозы препарата проявляется не раньше чем через 10 дней. Следовательно, назначая тироидин, необходимо учитывать его медленное действие и кумуляцию. Недостаток тироидина в том, что кроме L-тироксина и трийодтиронина в его состав входят ТТГ, йодтирозины, йод. Возможны образование антител к чужеродному белку, аллергические реакции, а кроме того, затруднена стандартизация препарата.
Из комбинированных препаратов также используют тирокомб, в одной таблетке которого содержится 70 мкг тироксина, 10 мкг трийодтиронина и 150 мкг калия йодида.
Эффективность терапии оценивают по клиническим симптомам и лабораторным показателям, в частности — по общему состоянию ребенка, его активности, частоте пульса и др. Кроме того, важными критериями адекватности лечения являются нормальный рост, масса тела и развитие ребенка. Поэтому динамика роста и «костного созревания» служит
956
ценным тестом. Рентгенологическое исследование (рентгенограмму кисти с лучезапястным суставом) для контроля за дифференцировкой костного скелета в начале лечения рекомендуется проводить с 6-месячным интервалом, а в дальнейшем — 1 раз в год.
В случае передозировки препарата появляются тахикардия, потливость, зуд кожи, диспептические явления, беспокойство, бессонница. Все симптомы исчезают при уменьшении дозы препарата или перерыве в лечении. Ряд симптомов гипотироза могут исчезать на субадекватной дозе тироидных препаратов, поэтому их исчезновение не может свидетельствовать о достаточности дозы. Адекватность терапии проверяют по лабораторным данным (определение уровня ТТГ, Т3 и Т4, холестерина, щелочной фосфатазы, креатинкиназы), времени ахиллова рефлекса, ЭКГ-показателям.
Наиболее точный показатель правильности лечения — уровень ТТГ. При оптимальной заместительной терапии он нормальный, а проба с нагрузкой тиролиберином отрицательная. Нормальное содержание ТТГ в сыворотке крови 0,4—5 мкгЕД/мл, а уровень ТТГ в пределах 0,1 — 0,4 мкгЕД/мл свидетельствуют о передозировке тироксина. Умеренный тиротоксикоз появляется при содержании ТТГ в сыворотке крови ниже 0,1 мкгЕД/мл и еще нормальном уровне свободного Т4, тогда как эти же показатели ТТГ и при повышенном содержании свободного Т4 указывают на явный тиротоксикоз, требующий немедленной коррекции дозы.
Ввиду того, что клиническое улучшение наступает раньше, чем нормализация биохимических показателей, повышенный уровень ТТГ в сыворотке крови указывает на недостаточность заместительной терапии. Поддерживающая терапия должна обеспечивать эутироидное состояние. Заместительная терапия больным, страдающим гипотирозом, проводится пожизненно. Даже кратковременное прекращение лечения ведет к возврату всех симптомов заболевания.
Лечение гипотироза не ограничивается только заместительной терапией тироидными препаратами. В комплекс лечебных мероприятий включают ряд дополнительных факторов — богатое витаминами питание, физкультуру и массаж, пребывание на свежем воздухе.
У детей раннего возраста необходимо проводить профилактику рахита. Витамин D назначают только после исследования содержания кальция в крови в связи с возможностью гиперчувствительности к витамину.
Анемия — один из наиболее упорных симптомов гипотироза. Для борьбы с ней по показаниям применяют препараты железа (гемофер, ферроплекс и др.), витамин В12, в тяжелых случаях — гемотрансфузии.
Если лечение врожденного гипотироза начато поздно, даже на фоне эутироидного состояния возможны стойкие органические изменения ЦНС. Таким больным назначают психофармакологические препараты, в связи со снижением интеллекта — стимулирующие препараты — глютаминовую кислоту, витамины группы В (В6, В12), церебролизин, аминалон, ноотропил, энцефабол, липоцеребрин в возрастных дозах. Для улучшения психического развития ребенка необходимо специальное педагогическое воздействие. <\
957
ДИФФУЗНЫЙ ТОКСИЧЕСКИЙ ЗОБ (болезнь Грейвса, Базедова болезнь, болезнь Перри)
Диффузный токсический зоб, или аутоиммунный гипертироз, — заболевание, обусловленное избыточной секрецией тироидных гормонов диффузно увеличенной щитовидной железой. Это наиболее частое заболевание, которое проявляется синдромом тиротоксикоза и на долю которого приходится до 80% всех его случаев.
В литературе довольно часто используют как синонимы термины «диффузный токсический зоб» и «тиротоксикоз» или «гипертироз». Однако эти понятия неоднозначны. Термин «тиротоксикоз» применим к патологическому состоянию, клинические и биохимические проявления которого связаны с избытком содержания тироидных гормонов в крови. К тиротоксикозу относятся также состояния, при которых имеются клинические и биохимические проявления избыточного содержания тироидных гормонов в крови без учета генеза повышения их уровня. Термин «гипертироз» правомерен в тех случаях, когда высокое содержание тироидных гормонов в крови является следствием повышенной их секреции.
Тиротоксикоз (гипертироз) — синдром, наличие которого связано с повышенным содержанием тироидных гормонов в крови, что встречается при различных заболеваниях или экзогенном избыточном поступлении тироидных гормонов. Тиротоксикоз наблюдается при диффузном токсическом зобе, многоузловом токсическом зобе, тиротоксической аденоме, подостром тироидите (первые 1—2 недели), послеродовом (немом) тироидите, аутоиммунном тироидите (гипертироидная его фаза —
«хаситоксикоз»), тироидите, развившемся после экспозиции ионизирующей радиации, тиротропиноме, синдроме нерегулируемой секреции ТТГ, фолликулярном раке щитовидной железы и его метастазах, экто-
пированном зобе (струма яичника), избыточном приеме йода (йод-базе- дова болезнь), трофобластических опухолях, секретирующих хорионический гонадотропин, ятрогенном и «искусственном» или «условном» тиротоксикозе.
Применение чувствительных методов определения ТТГ в сыворотке крови (третье поколение методов определения) позволило предложить термин «субклинический гипертироз». Это состояние определяется как субнормальное (ниже нижней границы нормы) или «угнетенное» содержание ТТГ при нормальном уровне Т3 и Т4 в сыворотке крови. Однако следует иметь в виду, что снижение содержания ТТГ в сыворотке крови может быть вызвано другими причинами (применение глюкокортикоидов, различные хронические заболевания, нарушение функции гипофиза и др.). Основанием для диагноза субклинического гипертироза служит, как указано выше, выявление низкого содержания ТТГ при определении его уровня с помощью высокочувствительных методов. Многочисленные публикации отмечают, что субклинический гипертироз может встречаться при многоузловом токсическом зобе, тиротоксической аденоме. При выявлении такого состояния рекомендуется та же терапия, что и при лечении диффузного токсического зоба. По нашему
958
мнению, необходима большая осторожность для установления такого диагноза и особенно назначения соответствующей терапии. Необходимо, во-первых, полностью исключить возможность угнетения секреции ТТГ под влиянием экзогенных и других причин. Во-вторых, перед окончательным решением о соответствующем диагнозе следует повторить лабораторное исследование уровня перечисленных гормонов. В-треть- их, следует иметь в виду, что снижение ТТГ при нормальном значении тироидных гормонов в крови может быть при таких заболевания щитовидной железы, при которых сохраняется интактной система обратной связи регуляции синтеза и секреции гормонов щитовидной железы.
Диффузный токсический зоб чаще встречается у женщин, однако у мужчин это заболевание чаще сочетается с офтальмопатией или претибиальной микседемой. Офтальмопатия и претибиальная микседема встречаются не более чем у 5% лиц с диффузным токсическим зобом.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ. Диффузный токсический зоб — аутоиммунное заболевание и развивается у лиц с наследственной предрасположенностью. По мнению одних авторов, он наследуется аутосомнорецессивным, по мнению других — аутосомно-доминантным путем. Вероятнее всего, имеет место многофакторный (полигенный) тип наследования.
Длительное время к ведущим этиологическим факторам, вызывающим развитие этого заболевания, относили инфекцию и психическую травму. Предполагалось, что влияние ЦНС на повышение функции щитовидной железы опосредуется через гипоталамус и усиление секреции ТТГ. Однако нормальный или сниженный уровень этого гормона в сыворотке крови таких больных и нормальная гистологическая структура передней доли гипофиза (отсутствие гиперплазии тиротрофов) сви-
детельствуют, что повышенная функция щитовидной железы при этом
заболевании обусловлена другим механизмом.
За последние 20—25 лет были получены экспериментальные и клинические данные, показывающие, что диффузный токсический зоб имеет аутоиммунные механизмы развития и относится к болезням, при которых выявляется иммунологическая недостаточность (диффузный токсический зоб, аутоиммунный тироидит и идиопатическая тромбоцитопеническая пурпура, миастения /myasthenia gravis/, ревматические заболевания, хронический гепатит, аутоиммунный орхит, неспецифический язвенный колит и др.). У родственников лиц, страдающих заболеваниями щитовидной железы (диффузный токсический зоб, идиопатическая микседема, аутоиммунный тироидит), при обследовании выявляется повышение титра антител к различным компонентам щитовидной железы, а также антител к другим органоспецифическим антигенам (желудка, надпочечников, яичника и др.) по сравнению с лицами, не страдающими заболеваниями щитовидной железы. Генетические исследования показывают, что если один из монозиготных близнецов болен диффузным токсическим зобом, то для другого риск заболевания составляет 60%; в случае дизиготных пар этот риск равен лишь 9%.
Изучение антигенов гистосовместимости (HLA-антигенов) показало, что чаще всего диффузный токсический зоб сочетается с носитель-
959
ством HLA-B8. F.C. Grumet и соавт. (1974) впервые показали, что у больных с диффузным токсическим зобом ген HLA-B8 встречался почти в 2 раза чаще по сравнению с практически здоровыми лицами. В последующем эти данные были подтверждены и другими исследователями. Изучение локуса D в системе гистосовместимости у больных диффузным токсическим зобом показало, что наличие HLA-Dw3 и HLA-DR3 увеличивает риск заболевания в 3,86 и 5,9 раза соответственно по сравнению с наличием HLA-B8. Исследования последних лет позволили установить наиболее частое сочетание диффузного токсического зоба с генами HLADQA1 0501 (Т. Yanagawa и соавт., 1993).
При диффузном токсическом зобе в сочетании с офтальмопатией выявлено увеличение частоты генов HLA-B8, HLA-Cw3 и HLA-DR3. Носительство последнего сопряжено с увеличением относительного риска развития офтальмопатии в 3,8 раза.
Первой работой, показавшей иммунный генез диффузного токсического зоба, было сообщение Адамса и Пурвеса (1956), которые установили, что у больных с диффузным токсическим зобом в сыворотке крови содержится вещество, способное стимулировать функцию щитовидной железы белых мышей в течение более длительного времени, чем это наблюдается под влиянием ТТГ. За это его действие оно было названо ЛАТС (LATS — long-acting thyroid stimulator). Однако прошло более 5 лет, прежде чем этот факт привлек внимание клиницистов и физиологов и явился толчком к проведению многочисленных исследований по выяснению структуры ЛАТС, механизма его действия и наличия в сыворотке крови при различной патологии щитовидной железы.
Было установлено, что ЛАТС является иммуноглобулином с мол. м. 150 кД. Изучение уровня ЛАТС в сыворотке крови больных с диффузным токсическим зобом показало, что повышенный уровень ЛАТС наблюдается лишь у 45—50%, а при сочетании диффузного токсического зоба с экзофтальмом и претибиальной микседемой — у 80—90% наблюдавшихся. Оказалось, что уровень ЛАТС в сыворотке крови не коррелировал ни с тяжестью тиротоксикоза, ни с выраженностью офтальмопатии. Эти данные позволили усомниться в том, что только один ЛАТС ответствен за развитие диффузного токсического зоба, и стимулировали исследования, результатом которых, в свою очередь, явились новые методы определения тироидстимулирующих антител (см. «Диагностика заболеваний щитовидной железы»).
В основе всех существующих методов определения тироидстимулирующих антител лежит их способность комплексироваться с рецептором к ТТГ. Ген рецептора к ТТГ локализуется на 14-й хромосоме (14q31) и кодирует полипептид, состоящий из 764 аминокислот. Апопротеиновый код рецептора ТТГ имеет мол. м. 84,5 кДа. Рецептор ТТГ имеет 7 трансмембранных фрагментов. Внеклеточный фрагмент рецептора способен комплексироваться с ТТГ и тироидстимулирующими антителами. Рецептор ТТГ является гликопротеидом, содержащим 30% углеводов и 10% нейраминовой кислоты, наличие которой необходимо для комплексирования ТТГ с рецептором. Взаимодействие ТТГ с олигосахаридным компонентом рецептора вызывает конформационные изменения гормона, ведущие к транслокации (α-субьединицы ТТГ внутрь мембра-
960
ны с активацией G-белка, активации аденилатциклазы и последующих серий реакций, характерных для действия ТТГ. Кроме того, у человека ТТГ активирует фосфолипазу С рецептора, результатом чего является повышение образования диацилглицерина и инозитолтрифосфита, являющихся также вторичными мессенджерами и принимающими участие в механизмах биологического действия ТТГ.
Механизм действия различных тироидстимулирующих антител и ТТГ на рецептор ТТГ в некоторых аспектах одинаков. Стимулирующее действие ЛАТС, ЛАТС-протектора — стимулятора щитовидной железы человека — опосредуется через повышение образования количества цАМФ и далее путем увеличения биосинтеза и высвобождения тироидных гормонов, т.е. через тот же механизм, который известен для действия ТТГ. Как показали исследования Е. Laurent и соавт. (1991), тироидстимулирующие антитела не влияют на активирование фосфолипазы С, а только стимулируют аденилатциклазу и образование цАМФ. Тем не менее исследования на клетках яичника китайского хомячка с рекомбинантным рецептором ТТГ продемонстрировали, что в этих условиях тироидстимулирующие антитела активировали как аденилатциклазу, так и фосфолипазу С (J. Van Sande и соавт., 1992), вызывая такие же конформационные изменения рецептора, как и при действии ТТГ.
Иммуноглобулины, угнетающие связывание ТТГ с рецептором, выявляются у некоторых больных с аутоиммунной (отечной) офтальмопатией при эутироидном и гипотироидном состоянии. Как указывалось выше, в отдельных случаях отсутствует взаимосвязь между уровнем антител к рецептору ТТГ и функциональной активностью щитовидной железы. Это несоответствие между уровнем тироидстимулирующих иммуноглобулинов в крови и функциональным состоянием щитовидной железы, вероятно, можно объяснить наличием иммуноглобулинов, оказывающих как стимулирующее действие на функцию щитовидной железы, так и не обладающих такими свойствами. По этим свойствам антитела к рецептору ТТГ можно разделить на два типа: стимулирующие аденилатциклазу и не стимулирующие, которые, взаимодействуя со щитовидной железой, блокируют рецептор, и такая щитовидная железа становится рефракторной к действию ТТГ. Такой тип антител (ТТГингибирующий или ТТГ-антагонистический тип) приводит к снижению биосинтеза тироидных гормонов и развитию гипотироза.
При диффузном токсическом зобе и особенно при аутоиммунном тироидите в щитовидной железе выявляется лимфоидная инфильтрация. Лимфоциты и плазматические клетки продуцируют антитела, часть которых взаимодействует с рецептором ТТГ, а возможно, и с другими структурами мембраны и лишь после этого — с рецепторами к ТТГ. Только часть образовавшихся антител попадает в лимфатическое и кровяное русло. Выявляются они различными методами исследования (см. выше).
Тироидстимулирующие иммуноглобулины принадлежат к классу G. При обработке этих антител протеолитическими ферментами удалось установить, какая часть молекулы отвечает за связывание ТТГ с рецепторами и какая — за стимулирующее действие на щитовидную железу.
К настоящему времени антиген, к которому при диффузном токсическом зобе образуются тироидстимулирующие антитела, не установ-
961
