
- •Активний центр – це ділянка фермента, що взаємодіє з S. Активних центрів може бути 2, 4, 6, 8. До кожного входять 7-15 амінокислот, що мають такі функціональні групи:
- •Коферменти
- •Нікотинамідні коферменти
- •Піридоксальфосфат (ПАЛФ)
- •Біоцитин
- •Біоцитин - кофермент карбоксилювання (приєднання молекули СО2 до іншої молекули з подовженням ланцюга на 1 атом вуглецю)
- •Тетрагідрофолієва кислота ( ТГФК )
- •ТГФК бере участь в обміні амінокислот (синтез метіоніну, гомоцистеїну), в синтезі нуклеотидів (тиміділату для ДНК та пуринових ядер аденіну і гуаніну), синтезі інших сполук (холіну, креатину, адреналіну).
- •Метилкобаламін
- •Вітаміни групи К
- •Біологічна роль і механізм дії вітаміну Е
- •Трансмембранний перенос речовин
- •Перетравлення ліпідів та всмоктування продуктів гідролізу
- •Хіломікрони утворюються в слизовій тонкого кишечника, транспортують екзогенні тригліцериди з кишечника в кров через систему лімфатичних судин.
- •Катаболізм триацилгліцеролів
- •Регуляція ліполізу
- •Окислення жирних кислот
- •Окислення гліцеролу (гліцерину)
- •Ліпогенез
- •Біосинтез жирних кислот
- •Послідовність ферментативних реакцій біосинтезу
- •Утворення ненасичених жирних кислот
- •Біосинтез фосфогліцеридів
- •Біосинтез та катаболізм кетонових тіл
- •Патологія ліпідного обміну
- •Ожиріння – це стан, що характеризується надмірним накопиченням триацилгліцеролів в жировій тканині. Розрізняють аліментарне (надмірне споживання їжи) та гормональне (гіпофункція щитовидної залози, кастрація, гіпофізарне, гіпоталамічне).
- •Всмоктування тетрапіролів в кишечнику
- •Патологія пігментного обміну – жовтяниці
- •Хімія та метаболізм нуклеопротеїнів. Молекулярна біологія
- •Номенклатура
- •Будова та функції ДНК (дезоксирибонуклеїнової кислоти)
- •Правила Чаргафа
- •Перетравлення нуклеопротеїнів та всмоктування продуктів гідролізу
- •Особливості синтезу пуринових нуклеотидів
- •Катаболізм пуринових нуклеотидів
- •Поняття про гіперурикемію та її характеристика
- •Причини
- •Лікування подагри
- •Біосинтез піримідинових нуклеотидів
- •Особливості синтезу піримідинових нуклеотидів
- •Джерела атомів карбону та нітрогену піримідинового кільця
- •Утворення цитидилових нуклеотидів
- •Синтез дезоксирибонуклеотидів
- •Утворення тимідилових нуклеотидів
- •Інгібітори синтезу дезоксирибонуклеотидів
- •Катаболізм піримідинових нуклеотидів
- •В основному відбуваються в печінці. Кінцевими продуктами обміну піримідинових нуклеотидів є:
- •Генетичний код. Реплікація ДНК
- •Властивості біологічного коду
- •Поняття про реплікацію
- •Значення реплікаціїї: забазпечує рівномірну, серед дочірніх клітин, передачу спадкової інфлрмації при поділі клітин.
- •Механізм реплікації
- •Ферменти і фактори реплікації ДНК в еукаріот
- •Етапи реплікації ДНК у еукаріот
- •Фактори транскрипції еукаріот
- •Механізм транскрипції у еукаріот
- •Інгібітори транскрипції (пригнічують або повністю блокують транскрипцію)
- •Здійснюється на рівні транскрипціі. Виділяють регуляцію двох типів:
- •Регуляція експресії генів у еукаріот
- •І. На рівні структурної організації геному регуляція експресії генів забезпечується особливістю будови хроматину, процесами рекомбінації та ампліфікації генів.
- •Класифікація мутацій
- •Класифікація мутагенів
- •Характеристика мутацій
- •Поняття про репарацію ДНК її механізми та патологію
- •Клітинні комунікаціи. Гормони та інші сигнальні молекули
- •Приклади гормоноподібних речовин
- •Механізми передачі гормонального сигналу
- •Група тропних гормонів аденогіпофіза.
- •Стимулюють функції периферійних ендокринних залоз.
- •Гормони підшлункової залози
- •Гормони як лікарські препарати.
- •1.Замісна гормонотерапія: інсулін при цукровому діабеті. 2. Стимулююча гормонотерапія – гормон росту. 3. Блокуюча або гальмівна гормонотерапія – інгібітори синтезу статевих гормонів при деяких онкозахворюваннях.
- •Препарати крові
- •Функції крові
- •Хімічний склад крові
- •Фізико-хімічні константи крові
- •Види алкалозу
- •Біохімія еритроцитів
- •Дихальна функція еритроцитів
- •Білки плазми (сироватки) крові
- •Функції білків плазми крові.
- •Структурно-функціональні особливості нирок
- •Кліренс визначають за формулою
- •Ниркова регуляція артеріального тиску
- •Індуктори ферментів метаболізму ксенобіотиків
- •Метаболічна активація ксенобіотиків
- •І фаза метаболізму ксенобіотиків
- •ІІ фаза метаболізму ксенобіотиків
- •Основні реакції кон’югації
Вступ в біохімію
Біохімія – це наука, що досліджує процеси життєдіяльності на молекулярному рівні. Є термін “молекулярна біологія” - це розділ біохімії, що вивчає структури й функції білків та нуклеїнових кислот.
Серед біологічних наук біохімія є найбільш фундаментальною дисципліною. Вона функціонує на межі між біологією та хімією.
В структурі біохімії виділяють статичну біохімію, яка вивчає хімічний склад організму, будову біоорганічних речови, динамічну, що досліджує процеси обміну речовин та функціональну, яка вивчає молекулярні основи фізіологічних процесів.
Об’єктом дослідження біохімії є вся жива природа, людина включно. Методологією біохімії є діалектичний матеріалізм.
Методи біохімії. Біохімія використовує хімічні, фізичні, фізико – хімічні, статистичні та інші методи досліджень. Як і кожна самостійна наука біохімія має власні методи досліджень, таким є ферментативний аналіз.
Біохімія є однією з провідних дисциплін медичного вузу, що формує світогляд майбутнього медика та його професійні знання, а саме:
∙обмін речовин та його регуляція у здорової людини;
∙зміни метаболізму в умовах патології;
∙біохімічні методи діагностики та лікування захворювань;
∙контроль за перебігом захворювань та ефективністю лікування;
∙створення нових лікарських засобів та методів лікування.
Історія біохімії
Біохімія як наука виникла у другій половині ХIX сторіччя в складі фізіології. Перші кафедри біохімії (у Казанському та Харківському університетах) та перший підручник з біохімії (в Німеччині) були створені наприкінці XIX ст. В цей період було доведено, що білки побудовані з амінокислот, які з’єднані між собою пептидним зв’язком (А Данілевський). Перший хімічний синтез олігопептидів здійснено німецьким вченим Емілем Фішером.
Розвиток біохімії в Україні.
Перший на теренах Радянського Союзу інститут біохімії був організований у 20-х роках ХХ ст. в Харкові, там же засновано перше біохімічне видання – “Український біохімічний журнал” (1925 р). В Києві є інститут молекулярної біології.
Досягнення українських біохіміків.
Львівський біхімік Парнас Я.О. разом з Ембденом та Майергофом відкрили основний шлях розпаду вуглеводів – гліколіз. Київський вчений Беліцер В.О. встановив, що тканинне диханя пов’язане з транспортом електронів. У Київському інституті молекулярної біології був відкритий фермент – зворотня ревертаза. Академік Палладін О.В., ім’ям якого названо український інститут біохімії, є автором підручника з біохімії. Вернадський В.І. є засновником біогеохімії, що досліджує ланцюг: грунт-рослина-людина (тварина). Бах А. вивчав тканинне дихання, заснував в Москві “Інститут біохімії” (тепер ім. А.Баха). Горбачевський І.Я. – найвидатніший біохімік української діаспори, засновник біохімії в Чехії, певний час був президентом чешської академії наук. Грабар Петро, бувший киянин, видатний французький імунохімік.
Ключові відкриття в галузі біохімії.
1904р. – німецький біохімік Кнооп відкрив механізм окислення жирних кислот. 1926р. – англійський вчений Самнер довів білкову природу ферментів.
В 30-х роках XIX сторіччя радянський біохімік Енгельгард відкрив окисне фосфорилювання, англійський вчений німецького походження Кребс - основний енергетичний цикл - цикл трикарбонових кислот (ЦТК), американець Полінг – вторинну структуру білкової молекули.
1953р. – Уотсон і Крік встановили структуру молекули ДНК та запропонували схему її подвоєння, тобто можливий механізм передачі спадкової інформації.
Основні терміни та поняття біохімії:
∙метаболізм – обмін речовин;
∙анаболізм (катаболізм) – синтез (розпад) речовин в організмі;
∙проміжний обмін – обмін (синтез, розпад, перетворення) речовин в тканинах,
∙тканинне дихання – процес поглинання тканинами кисню та виділення вуглекислоти;
∙окисне фосфорилювання – синтез АТФ, пов’язаний з тканинним диханням;
∙субстратне фосфорилювання – синтез АТФ, не пов’язаний з тканинним диханням, тобто у цьому випадку синтез АТФ відбувається за рахунок інших макроергічних сполук;
Принципи організації та функціонування живої матерії.
1.Організація
∙Клітинна. Всі живі організми складаються з клітин.
∙Принцип простої складності. До складу організмів входить обмежена кількість низькомолекулярних речовин, але з них можливе утворення величезної кількості варіантів складних речовин. Наприклад, з 20 “стандартних” амінокислот можливе утворення безлічі варіантів білкових молекул; з 4 мононуклеотидів – нуклеїнових кислот
іт.і..
∙Основу всіх клітин складають біополімери трьох видів: НК, білки, полісахариди, які несуть структурну, інформаційну та інші функції.
∙Життя клітин неможливе без мембран, які виконують бар’єрні та інші функції.
2.Функціонування
∙Вся жива природа підкоряється II принципу термодинаміки (кожна система прагне до мінімуму вільної енергії).
∙Принцип молекулярної економії. Організм складається не лише з обмеженої кількості
простих речовин, але й використовує всі фізико – хімічні властивості цих речовин. Приклади – багатовекторне використання амінокислот, моносахаридів, жирних кислот, нуклеотидів, мінералів, каталізаторів.
∙Життя неможливе без здатності клітин накопичувати, зберігати, використовувати інформацію та передавати її дочірнім клітинам.
∙Інші принципи (здатність до каталізу, регуляції та саморегуляції, пристосуванню,
продукуванню та використанню макроергів, захисту і т. п.).
Хімічний склад тіла людини.
Вода – 70% у дорослих, 75 – 80% у дітей, 50 –65% у осіб похилого віку. Як правило, чим більше води міститься в організмі, тим інтенсивніше протікають процеси обміну. Вміст (на суху масу тіла): білків – 45%, ліпідів – 40 – 45%, вуглеводів – 2%, мінеральних речовин – 4 – 4,5%.
Ферменти
Ферменти (ензими) – це біокаталізатори білкової природи (за винятком мя-РНК, яка володіє ферментативною активністю), що приймають участь майже у всіх хімічних реакціях в організмі. Слово фермент походить від слова fermentatio, що означає бродіння, а ензім – від en zyme, що означає закваска в дріжджах.
Наука, що вивчає структуру, властивості та механізм дії ферментів, називається ензимологією, або ферментологією.
Прийняті позначення в ензимології:
Е – фермент, ензим (“еnzyme”) –біокаталізатор;
S – субстрат – хімічна сполука, що перетворюється ферментом;

Р– продукт реакції, що утворився в результаті ферментативної реакції Значення ферментів: приймають участь в реакціях синтезу, розпаду речовин,
всмоктування, перетравлювання, вивільнення енергії, забезпечують координацію біохімічних реакцій, та метаболізму в цілому. Порушення синтезу, або активності ферментів приводить до порушення метаболізму та виникнення хвороб .
Історія розвитку ферментології
У1814 р. Кіргоф виявив, що солод ячменя викликає бродіння крохмалю. Подальший розвиток ферментології зв’язаний з іменами Лібіха, Пастера, Манасеіної, Лєбєдєва.
У1913 році Мендель і Міхаеліс висунули теорію механізму дії ферментів.
У1926 році Самнер виділив кристалічну уреазу і довів її білкову природу. Цей рік названо роком народження ферментології як науки.
У1969 р. в лабораторії Мерріфільда (Нью-Йорк) здійснено синтез рибонуклеази. Номенклатура ферментів була прийнята на 5 Міжнародному конгресі біохіміків у
1961 році у Москві. |
|
|
1 Систематична номенклатура. Назва ферменту складається: |
|
|
Приклади: |
|
|
|
|
|
- до назви субстрату, на який діє фермент |
додається |
амілаза, ліпаза |
- до назви реакції, що відбувається під дією |
дегідрогенази |
|
фермента |
суфікс |
декарбоксилази |
- до назви S та реакції, що відбувається |
“аза” |
лактатдегідрогеназа |
- до назв зв’язків, що перетворюються |
|
пептидази, естерази |
під дією ферменту |
|
|
|
|
|
2.Збереглись тривіальні назви: пепсин, трипсин, хімотрипсин, тромбін, тощо.
3.Сучасна, шифрова номенклатура: код ферменту складається з 4-х цифр.
Цифри означають: 1-клас, 2-підклас, 3-підпідклас, 4-порядковий номер фермента в підпідкласі. Наприклад: 1.1.1.27-лектатдегідрогеназа
Класифікація ферментів (побудована за типом хімічних реакцій).
1клас – оксидоредуктази: каталізують окисно-відновні процеси-(дегідрогенази, оксидази, цитохроми та ін.).
2.клас – трансферази: переносять групи атомів, від яких і беруть назву (метил-, сульфо-, аміно-, фосфо-, ацилтрансферази та ін.).
3.клас – гідролази: розщеплюють зв’язки за участю води (пептидази, естерази, фосфатази, глікозидази та ін.).
4.клас – ліази: руйнують зв’зки без участі води. Відщеплюють від S яку-небудь хімічну групу негідролітичним шляхом (декарбоксилази, альдолази, та ін.).
5.клас – ізомерази: каталізують реакції ізомеризації (епімерази, рацемази, ізомерази та ін.).
6.клас – лігази: (синтетази) каталізують реакції синтезу (АТФ-синтаза, піруваткарбоксилази та ін.).
У1978 році в списку ферментів було біля 2 тисяч назв.
У1995 році в списку ферментів було вже біля 3 тисяч назв ферментів.
Клітинна організація ферментативної активності
Ферменти розподіляються по субклітинних структурах відповідно їх функціям. А саме:
∙в ядрі містяться ферменти метаболізму нуклеїнових кислот;
∙у внутрішній мембрані мітохондрій – ферменти дихального ланцюга;
∙в матриксі мітохондрій – ферменти ЦТК, окислювального декарбоксилювання α - кетокислот, β – окислення жирних кислот;
∙у зовнішньоклітинній біомембрані - мембранозалежні ферменти транслокази, що переносять через мембрану іони Nа+,К+, глюкозу, амінокислоти та ін.;
∙в цитоплазмі – ферменти гліколізу, синтезу жирних кислот;
∙в лізосомах – гідролази.
Принципи визначення активності ферментів
1.по швидкості зникнення субстрату;
2.по швидкості накопичення продуктів реакції.
Одиниці активності ферментів
1.Одиницею фермента (U-unit,англ.) є така кількість фермента, яка каталізує перетворення 1 мк моля S за 1 хв. за оптимальних умов (1U= 1 мк моль/хв).
2.В системи СІ (SІ) активність виражають в каталах: це така кількість ферменту, яка каталізує перетворення 1 моля S за 1 с. (1кат. = 1 моль/с).
3.Питома активність визначається кількістю одиниць ферментативної активності на 1 мг білка в біологічному об’єкті (U/мг білка).
4.У медичній ензимології активність ферменту виражають в одиницях (U) на 1 л біологічної рідини (сироватки крові, сечі тощо): U/л.
Властивості ферментів як біокаталізаторів
1.Специфічність (вибірковість) дії. Виділяють:
∙абсолютну специфічність – фермент каталізує перетворення єдиного S (уреаза, аргіназа).
∙відносну – фермент каталізує перетворення речовин, які мають однакові зв’язки (пептидази, естерази тощо).
∙стереоструктурну – фермент каталізує перетворення певного стереоізомеру
(L – лактатдегідрогеназа → L – лактат).
2.Термолабільність – відповідно до своєї білкової природи ферменти є термочутливими, тобто термолабільними утвореннями. Оптимум to =37-38 оС. При зростанні to вище оптимального значення швидкість ферментативної реакції різко зменшується за рахунок конформаційних (денатураційних) змін у структурі ферментного білка, та практично повністю зникає після 56о С (денатурація білка). При зниженні температури (холодова денатурація) швидкість ферментативної реакції значно сповільнюється, але необоротнє руйнування білка не відбувається, що використовується в медичній практиці .
3.Залежність ферментативної активності від рН середовища. Кожен фермент має свій рН– оптимум - значення рН, при якому його активність максимальна. При зміні рН відбувається дисоціація іоногенних груп активного центру та конформаційні зміни молекул. Більшість ферментів найактивніші в діапазоні рН 6-8. Екстремальні значення мають пепсин (рН=1,5-2), аргіназа (рНопт=10-11).
4.Ферменти прискорюють швидкість як прямої, так і зворотньої реакції.
5.Активність ферментів суттєво змінюється під впливом певних хімічних сполук, що збільшують (активатори) або зменшують (ільгібітори) швидкість реакції, яка каталізується.
6.Ферманти значно підвищують швидкість біохімічних реакцій (один моль карбангідрази розщеплює 36 млн. молекул Н2СO3)
Центри ферментів
Молекула фермента взаємодіє з субстратом певними ділянками. Виділяють:
Активний центр – це ділянка фермента, що взаємодіє з S. Активних центрів може бути 2, 4, 6, 8. До кожного входять 7-15 амінокислот, що мають такі функціональні групи:
-ОН – групи серину, треоніну, тирозину;
-SН – групи цистеїну;
-NНгістидину;
-СООН - група глутамату та аспартату; -NН2 - групи аргініну та лізину.
Ускладних ферментах до активного центру входять кофактори (небілкові компоненти): простетичні групи, коферменти, іони металів. Активний центр є комплементарним до будови S, спостерігається відповідність Е і S як “ключа і замка”.
Уструктурі активного центру розрізняють:
∙ділянку, що зв’язує субстрат, або контактну (“якірну”) ділянку;
∙каталітичну ділянку, до складу якої входять хімічні групи, що беруть безпосереднью участь у перетворенні субстрату
Алостеричні ферменти – це різновид регулярних ферментів, що, крім активного центру, мають додатковий регуляторний (алостеричний: allos – інший, steros – просторовий) центр, з яким взаємодіють алостеричні регулятори (ефектори, модулятори).
Алостеричні ефектори можуть бути позитивними (активаторами), що збільшують каталітичну активність ферменту, або негативними (інгібіторами), що її гальмують.
Активний та алостеричний центри локалізуються на різних білкових субодиницях четвертинної структури ферменту. При взаємодії алостеричного центру з лігандамиефекторами відбуваються конформаційні зміни в активному центрі, що приводить до певної модифікації активності фермента.
Активатори та інгібітори ферментів
1. Активатори – хімічні речовини, які підвищують швидкість ферментативних реакцій.Вони бувають органічної та неорганічної природи.
Органічної природи:
∙жовчні кислоти (активують підшлункову ліпазу в кишечнику);
∙ентерокіназа (активує трипсиноген).
Глутатіон, цистеїн, вітамін С підвищують активність оскидоредуктаз. Неорганічної природи:
∙HCl активує пепсиноген;
∙іони металів 1 та 2-х валентні (Na, Cl, K, Mg, Mn, Zn);
Роль металів:
∙сприяють утворенню фермент-субстратного комплексу;
∙є донорами та акцепторами електронів;
∙беруть участь в утворенні активного центру ферментів (Zn → в карбоангідразі, Fe → у цитохромах);
∙виступають в ролі алостеричних регуляторів.
2.Інгібітори – хімічні речовини, що зменшують активність ферментів, сповільнюють хімічні реакції.
Розрізняють: а) зворотнє інгібірування: Б) незворотнє інгібірування:
Роль інгібіторів:
1.викликають денатурацію ферментів (концентровані кислоти та луги, органічні кислоти, ультрафіолетове опромінення, солі важких металів)
2.тканинні отрути (ціаніди, алкілюючі агенти);
3.ФОС – фосфоорганічні сполуки виявляють ацетилхолінестеразну активність. Зворотнє інгібірування поділяється на конкурентне та неконкурентне. Конкурентне
інгібірування викликається лігандами, які по структурі близькі до S і взаємодіють з тим самим активним центром ферменту. Класичним прикладом конкурентного інгібітора сукцинатдегідрогенази (СДГ) є малонова кислота.
Малонову кислоту з’єднується з активним центром СДГ, реакція припиниться. Конкурентні інгібітори використовуються у ролі лікарських препаратів:
1.сульфаніламіди (гальмують утворення вітаміну В9 – фактора росту),
2.антибіотики,
3.протипухлинні препарати (метатрексат, антивітамін вітаміну В9).
Неконкурентне інгібірування.
Ці інгібітори не подібні до S, приєднуються не до активного центру, а до інших ділянок, в тому числі і до алостеричного центру. Руйнуються або незворотно хімічної модифікуються функціональні групи ферментів. Приклади:
а) алкілуючі агенти незворотно реагують з SН – групами
б) препарати ФОС (фосфороорганічних сполук) є токсичними отрутами відносно комах та теплокровних тварин (пестициди). Вони взаємодіють з ОН – групою серину в активному центрі фермента ацетилхолінастерази; в) тетурам – інгібітор алкогольдегідрогінази. Використовують при лікуванні алкоголізму.
Хімічна природа та структура ферментів.
В основному ферменти мають білкову природу, за винятком мя-РНК, яка теж володіє ферментативною активністю (доведено роботами Томаса Чека).
Докази білкової природи:
∙ втрата активності при кип’ятінні, дії У/Ф та Rо– променів, УЗ, кислот, лугів, важких металів;
∙виділення у формі кришталів;
∙гідроліз до амінокислот;
∙осадження висалюванням без втрати каталітичних властивостей;
∙висока молекулярна маса, амфотерність, здатність до електрофорезу;
∙штучний синтез рибонуклеази у 1969 році
Структура ферментів
Ферменти є прості і складні. Прості ферменти складаються тільки з амінокислот (наприклад, гідролази). Складні ферменти - з білкового компонента (апофермента) та небілкового (кофактора). Кофактор може бути неорганічної (метали) та органічної природи. Останній в залежності від ступеня зв’язку з апоферментом називається простетичною групою (міцно зв’язаний з апоферментом) або коферментом (слабо зв’язаний з апоферментом).
Ізоферменти.
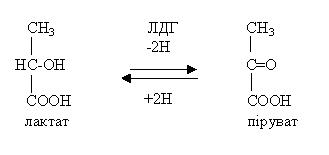
Майже всі ферменти існують в декількох формах. Ізоферменти – це сімейство ферментів, які відрізняються за будовою та фізико-хімічними властивостями, але каталізують одну реакцію. Наприклад, лактатдегідрогеназа (ЛДГ) каталізує взаємоперетворення лактату та пірувату.
Фермент ЛДГ містить 4 субодиниці 2х-типів: субодиниця Н виділена із серцевого м’яза (від Heart – серце), субодиниця М - із склетних м’язів (Musculus – м’яз). Субодиниці мають свій генетичний локус в різних органах. З’єднання субодиниць відбувається в різних відношеннях, тому виділяють такі фракції ЛДГ:
ЛДГ1: ЛДГ2: ЛДГ3: ЛДГ4: ЛДГ5: (Н4) (Н3М) (Н2М2) (НМ3) (М4)
ЛДГ1 синтезується в серцевому м’язі та мозку, ЛДГ5 – в склетних м’язах та печінці. Інші фракції - в інших органах. Гіперферментемія свідчить про ураженні клітин, тому підвищення активності ЛДГ1 в крові спостерігається при ураженні серцевого м’яза (інфаркт міокарда), а активності ЛДГ5 - при гепатитах та ураження склетних м’язів. Тобто визначення активності ізоферментів дає можливість виявити локалізацію патологічного процесу.
Мультиферменти
Це надмолекулярні комплекси з різних ферментів та коферментів, що каталізують послідовні етапи перетворення субстрата. Прикладами дії мультиферментів є реакції окислювального декарбоксилювання α-кетокислот (пірувату та α-кетоглутарату) під впливом
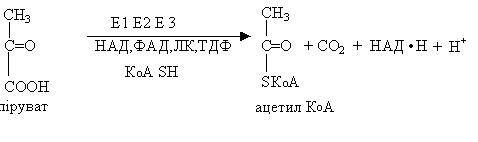
піруватдегідрогенази та α-кетоглутаратдегідрогенази (складаються з трьох ензимів та 5 коферментів). Продуктами реакцїй відповідно являються ацетил-КоА та сукциніл-КоА.
Біологічне значення мультиферментів: скорочується відстань між реагуючими речовинами і зменшується (час) тривалість реакції.
Механізм дії ферментів
Взаємодія фермента та субстрата відбувається за законом комплементарності конфігурації активних центрів, конформації та зарядів.
Впроцесі взаємодії виділяють 5 етапів:
∙Приєднання ферменту до S з утворенням ферментсубстратного комплексу;
∙Квантово – механічні зрушення, що приводять до послаблення зв’язків;
∙Розрив, або утворення зв’язків;
∙Зміна конфігурації субстрату, він не відповідає активному центру фермента;
∙Висвободження продуктів реакції від фермента.
Поняття про “енергію активації” та “енергетичний бар’єр”
Ферменти прискорюють хімічну реакцію за рахунок зниження енергії активації. Енергія активації – це енергія для для переведення всіх молекул моля речовин в
активований стан. Фермент знижує енергію активації за рахунок збільшення числа активованих молекул. Ферментативна реакція йде в обхід енергетичному бар’єру. Енергетичний бар’єр – енергія, яку треба подолати молекулам, щоб вступити в хімічну взаємодію. Фермент знижує енергетичний бар’єр. Величина енергії активації дорівнює величині енергетичного бар’єру.
Ферментативна реакція має більш низьку енергію активації та низький енергетичний бар’єр.
Регуляція ферментативної активності
1.На генетичному рівні: виділяють конститутивні ферменти, що синтезуються завжди згідно генетичному коду; та адаптивні (індуцибельні), що синтезуються при умовах надходженняя субстрату та розблокування відповідних генів.
2.За законом діючих мас: напрямок реакції зміщується у бік речовин з меншою кількістю.
3.Перетворення профермента в активний фермент. Наприклад, синтезується неактивний пепсиноген, який під дією НСl перетворюється в активний пепсин.
4.За принципом зворотного зв’язку (ретрогальмування): продукт послідовних стадій перетворення певного субстрату гальмує перший фермент.
5.Ативація попередником. Наприклад: S (глю-6-ф) активує фермент його перетворення – (глю-6-до-дегідрогеназу) у пентозо-фосфатному шляху.
6.Хімічною модифікацією фермента: найчастіше фосфорилуванням.
7.Швидкістю синтеза та розпаду речовин.
8.Впливом активаторів та інгібіторів.
9.Конкуренцією за загальний субстрат.
