
Полезные материалы за все 6 курсов / Учебники, методички, pdf / методичка онкология лекции
.pdfI стадия рака яичников
ПрипограничныхопухоляхяичниковIстадиязаболеваниявстречаетсяв90% наблюдений. Во время лапаротомии выполняется резекция или односторонняя овариоэктомия(аднексэктомия),обязательнабиопсияконтрлатеральногояичника и удаление большого сальника. При подтвержденной пограничной опухоли яичников послеоперационная химиотерапия, как правило, малоэффективна.
При высокодифференцированных опухолях IA-B стадий обычно выполняется экстирпация матки с придатками, удаление большого сальника, биопсия брюшины малого таза и поддиафрагмальной поверхности (не менее 10 образцов), смывы из брюшной полости.
Женщинам, желающим сохранить детородную функцию, может быть выполнена одностороння аднексэктомия, биопсия контрлатерального яич- ника, резекция большого сальника, ревизия забрюшинных лимфатических узлов. Щадящий объем операции накладывает на хирурга большую ответственность, т.к. достаточно велико число диагностических ошибок на всех этапах наблюдений за больной. В связи с этим, такие пациентки постоянно должны находиться под строгим контролем (УЗД, СА125).
Адъювантная химиотерапия при высокодифференцированных опухолях IA-B стадий в большинстве клиник мира обычно не проводится, хотя по нашим данным, послеоперационная лекарственная терапия, даже в монорежиме повышает пятилетнюю выживаемость на 7-9%.
При остальных гистологических формах РЯ IA – B стадий предпочтительнее проведение радикальных операций.
По сводным данным, 5-летняя выживаемость при высокодифференцированном мезонефроидном раке I стадии, составляет 69%, серозном – 85%, муцинозном – 83%, эндометриоидном –78%, а при недифференцированной форме – 55%. Поэтому при недифференцированной форме РЯ, после радикальной операции рекомендуется адъювантная моно – или полихимиотерапия.
Всем больным с умеренноили низкодифференцированными опухолями IA-B-C стадиями показана операция – экстирпация матки с придатками, удаление большого сальника с последующими курсами полихимиотерапии, не менее 6 курсов.
Значительно больше проблем перед клиницистами возникает при лечении пациентов с распространенными стадиями заболевания. В настоящее время ни у кого не вызывает сомнений необходимость применения неоадъювантныхкомбинированныхиликомплексныхлечебныхмероприятийдляэтихбольных. В то же время отдельные моменты и детали этого лечения противоречи-
569
вы в связи с большим количеством мнений различных исследователей, касающихся тактики, схем химиотерапии, этапности, длительности лечения.
II стадия рака яичников
При II стадии РЯ всем пациенткам показано удаление всей опухоли или ее большей части (экстирпация матки с придатками, резекция большого сальника, удаление всех опухолевых очагов). Даже в случае клинического отсутствия «остаточной опухоли» необходимо проводить ревизию органов брюшной полости, биопсию с поверхности диафрагмы, тазовой области, брюшины вне области таза, необходимо также гистологическое исследование тазовых и парааортальных лимфатических узлов. В последующем планируется лучевая терапия на остаточную опухоль и проведение 6-7 курсов полихимиотерапии с интервалами в 3 недели.
В послеоперационном периоде проводятся курсы лечения по следущим схемам:
1.При остаточной опухоли менее 2 см. Системная химиотерапия:
ТР (паклитаксел (таксол) + цисплатин или карбоплатин) СР (циклофосфан + цисплатин)
СС (циклофосфан + карбоплатин)
Тотальное облучение брюшной полости и таза (при остаточной опухоли малого таза не менее чем 0,5 см).
Интраперитонеальное введение 32Р (при опухолевых остатках менее чем 1 мм) используется редко, ввиду частого развития кишечной непроходимости в качестве осложнения.
2. При остаточной опухоли более 2 см. Комбинированная химиотерапия.
ТР (паклитаксел (таксол) + цисплатин или карбоплатин) СР (циклофосфан + цисплатин)
СС (циклофосфан + карбоплатин)
III стадия рака яичников
При III стадии первичная циторедуктивная операция является стандартом и включает экстирпацию матки с придатками, оментэктомию, удаление максимально возможного объема опухолевой ткани.
С позиции биологических характеристик опухолевого роста, первич- ная циторедуктивная операция представляется «не совсем корректной процедурой». Однако существуют доказательства того, что объем опухолевых остатков и выживаемость больных находятся в обратно пропорциональной
570
зависимости. По литературным данным, средняя выживаемость больных с оптимальнойциторедукциейсоставила39месяцев,аубольныхссубоптимальной циторедукцией – 17 месяцев. Однако данные ретроспективных исследованийобнаружили,чтоубольныхсизначальнобольшойопухолью,которымудалось провести оптимальную циторедукцию (объем остаточной опухоли менее 1 см), показатели выживаемости ниже, чем у пациенток с небольшим объемом опухолевой ткани. В ретроспективном исследовании выживаемость больных с остаточной опухолью менее 2 см была выше выживаемости больных с остаточной опухолью более чем 2 см. Рандомизированное исследование обнаружило увеличение средней выживаемости на 8 месяцев у больных с остаточной опухолью до 2 см при интраперитонеальном введении цисплатина и циклофосфана, по сравнению с больными, которым эта схема химиотерапии не была проведена системно. Однако интраперитонеальная химиотерапия не показана больным, у которых при первичной лапаротомии был обнаружен выраженный спаечный процесс, поскольку сращения брюшины затрудняют доставку химиопрепаратов к опухолевой ткани. В настоящее время изучается роль первичной интраперитонеальной химиотерапии, содержащей паклитаксел. Пока не получено данных, подтверждающих улучшение показателей выживаемости при радикальных операциях, при которых для достижения полной циторедукции производится удаление участков брюшины и резекция кишечника.
Установлено что при III-IV стадиях рака яичников вариант «операция + химиотерапия» значительно улучшает выживаемость пациенток по сравнению с таковыми при проведении на первом этапе лечения лекарственной терапии. Это можно объяснить следующтм образом:
–эффективность применения фармакологических препаратов повышается с удалением максимальной опухолевой массы со слабым кровотоком;
–эффективность химиопрепаратов коррелирует с высокой метастати- ческой активностью малых опухолей;
–меньшие остаточные опухоли требуют меньшего количества курсов химиотерапии;
–удаление основной массы опухоли приводит к улучшению состояния иммунной системы пациенток;
–вместе с удаляемой опухолевой массой удаляются и фенотипически резистентные клетки.
Для солидных новообразований характерен достаточно бедный кровоток, что снижает концентрацию химиопрепарата в опухолевой ткани и соответственно эффективность проводимого лечения. Особенно это проявляется в центральных частях опухоли, где часто бывают обширные некрозы, связанные с нарушением трофики тканей.
571
Для максимального эффекта большинства фармакологических агентов необходима фракция клеток с быстрым ростом. Поэтому, при удалении основной массы малочувствительных к химиотерапии клеток остаются более чувствительные небольшие очаги (диссеминаты), обладающие высокой способностью митотического пула.
При III стадии 32Р используют редко (при остатках опухоли не более 1мм), причем во многих работах зарубежных авторов отмечается большое число лучевых повреждений при использовании этого метода.
IV cтадия рака яичников
При IV стадии по FIGO больные с плевральным выпотом, метастазами в надключичные лимфатические узлы или единичными кожными метастазами могут лечиться как при III стадии заболевания, им показана надвлагалищная ампутация или экстирпация матки с придатками, оментэктомия.
При невозможности выполнить данный объем операции, необходимо циторедуктивное удаление опухоли или ее части с оментэктомией, или симптоматические операции по поводу кишечной непроходимости, задержки мочи и других осложнений. Больным с метастазами в печень и легкие надвлагалищная ампутация или экстирпация матки с придатками не показаны.
Альтернативой лечения больных с IV стадией РЯ является неоадъювантная химиотерапия. Лучевая терапия в лечении этой группы больных практически не используется, хотя в последнее время появились литературные данные о необходимости изучения возможностей системной лучевой терапии, с учетом обнадеживающих результатов, полученных при использовании данного вида лечения у больных с распространенными злокаче- ственными новообразованиями других локализаций.
На эффективность химиотерапевтического лечения РЯ влияет целый ряд факторов. Ведущими из них являются стадия заболевания, гистологическая форма опухоли, степень дифференцировки опухолевых клеток, масса опухоли и т.д. В то же время выбор способа лечения безусловно зависит от поставленной цели, которая может быть направлена либо на полное излечение, либо на облегчение симптомов заболевания и уменьшение страдания больной.
В том случае, когда речь идет о паллиативной терапии используется щадящий подход, при котором токсичность лечения не должна превышать эффективность. Диаметрально противоположной выглядит тактика лечения, когда речь идет о полном излечении или длительной ремиссии. Здесь допустимо агрессивное, токсичное лечение.
Многочисленные сравнительные исследования показали, что полихимиотерапия при РЯ более эффективна и вызывает больший процент полных рег-
572
рессий, чем монохимиотерапия. На сегодняшний день эффективность различ- ных режимов комбинированной химиотерапии составляет порядка 50-80%.
Лучевая терапия рака яичников
Показания к лучевой терапии при РЯ противоречивы. Как правило, лу- чевая терапия применяется в качестве дополнительного метода воздействия с целью ликвидации одиночных метастазов, рецидивов в области малого таза и параметральной клетчатки. Ряд исследователей склоняются в пользу послеоперационной лучевой терапии при II – III стадиях с облучением таза и брюшной полости, другие cчитают, что облучение показано больным с ранними стадиями, даже в случае выполнения радикальной операции. Кроме того, предпринимаются попытки комбинированного лечения первично неоперабельных больных с применением лучевой и химиотерапии. По данным большинства исследователей, применение лучевой терапии в комплексном лечении РЯ считается целесообразным, поскольку значительно увеличивает безрецидивный период и повышает качество жизни.
Профилактика рака яичников
Профилактические мероприятия при раке яичников включают массовые профилактические осмотры женщин для выявления различной патологии придатков матки с использованием УЗИ, компьютерной томографии, лапароскопии, тщательное обследование больных с хроническими воспалительными заболеваниями матки и яичников, детальное обследование больных, относящихся к группе повышенного риска возникновения рака яичников, своевременное лечение женщин с доброкачественными опухолями яичников.
К группе повышенного риска большинство исследователей относят женщин с нарушением половой дифференцировки, с опухолевидными образованиями в малом тазу, имеющих профессиональные вредности, женщин в анамнезе у которых: позднее наступление менархе, аменорея в фертильном возрасте, бесплодие, ранний климакс и менопауза, гипоменструальный синдром.
Âоснове профилактики РЯ лежат достижения онкологии в изучении причин возникновения и закономерностей развития опухолей яичников. Выделяют первичную и вторичную профилактику рака яичников.
Комплекс мероприятий, направленных на предупреждение возникновения заболевания, называется первичной профилактикой.
Âнастоящее время нет эффективных скрининговых программ по активному выявлению злокачественных опухолей яичников, в связи с этим, у женщин с «обычным» риском развития этой нозологической формы заболевания достаточно бимануального осмотра гинеколога с обязательной оцен-
573
кой состояния ректовагинальной перегородки, УЗИ малого таза и определение уровня СА 125. Пациенткам с наличием в анамнезе семейного рака яичников необходимо проводить генетическое тестирование для определения мутаций BRSA-1 и BRSA-2. В связи с этим важно также отметить значение нормализации основных физиологических функций организма женщин – сохранение гормонального равновесия. Риск возникновения наиболее распространенных среди них опухолей повышается при любых нарушениях, связанных с их детородной функцией. Это слишком раннее или позднее начало половой жизни, ее нерегулярность, аборты, ранние или поздние роды, прием гормональных противозачаточных средств, отказ от кормления грудью или деторождения, наследственность.
Первичная профилактика рака яичников заключается в коррекции ановуляции, и гиперстимуляции овуляции (например, при мощи стероидной контрацепции у женщин старше 40 лет). Беременность и роды снижают риск возникновения рака яичников, отказ от гормональных препаратов, стимулирующих овуляцию, также снижает риск возникновения рака яич- ников. Активное выявление факторов риска заболевания рака яичников, а также выявление и активное наблюдение групп риска по заболеванию опухолями яичников.
Основой профилактики рака всегда была и остается вторичная профилактика – ранее выявление и своевременное лечение больных с предопухолевыми заболеваниями и лечение больных раком в ранней стадии.
К одному из наиболее активных методов ранней диагностики и профилактики РЯ следует отнести, прежде всего, профилактические медицинские осмотрынаселения.Опытпоказал,чтодиспансерныйметодявляетсянаиболееэффективным. Он позволяет активно бороться с заболеваниями такими путями:
1) активно выявлять больных, особенно с доброкачественными и пограничными опухолями яичников и их хирургическое лечение;
2)взятие на учет отдельных групп здоровых и больных с отягощенной наследственностью, предполагаемыми и возможными факторами риска возникновения опухолей яичников и активного наблюдения за ними;
3)своевременное и планомерное применение лечебных и профилакти- ческих мероприятий для предупреждения рецидивов заболевания, скорейшего восстановления здоровья и трудоспособности;
4)выяснение факторов внешней среды, влияющих на состояние здоровья человека, проведения мероприятий по улучшению условий труда и быта, трудоустройства в соответствии с состоянием здоровья.
574
ГЛАВА XXIV
ЛИМФОГРАНУЛЕМАТОЗ
Профессор Попович А.Ю.
Лимфогранулематоз (ЛГМ), лимфома Ходжкина – это злокачественная опухоль лимфатических узлов и лимфатической системы, поражающая в поздних стадиях другие ткани и органы. При ЛГМ в лимфоидной ткани находят, характерные для этого заболевания, крупные многоядерные клетки Бере- зовского-Штернберга-Рида, получившие название в память об ученых, принимавших участие в их открытии и изучении. Впервые заболевание описал английский врач Томас Ходжкин в 1832 году. В 1890 году С.Я.Березовский, а в 1898 году Карл Штернберг – описали крупные многоядерные клетки, которые обнаруживались в пораженных опухолью лимфатических узлах и тканях. Позднее, в 1902 году, Дороти Рид детально описала и зарисовала эти клетки. Термин «лимфогранулематоз» был введен в 1904 году на VII Съезде немецких патологов в Вене. В самой последней классификации опухолей кроветворной и лимфоидной тканей Всемирной Организацией Здравоохранения (ВОЗ) в 2001 году для обозначения этой болезни предложен термин «лимфома Ходжкина».
ЛГМ является частым заболеванием, заболеваемость в США – 2,8, в России – 2,3, в Украине – 2,4 на 100000 (1200 больных ежегодно) населения. Болезнь может возникнуть в любом возрасте, часто встречается у детей позднего подросткового возраста и имеет два возрастных пика. Пик заболеваемости у молодых лиц наблюдают в возрасте 15-35 лет; характерны одинаковая частота среди мужчин и женщин, преобладает относительно доброкачественное клиническое течение. Второй пик – у взрослых старше 50 лет характеризуется более высокой заболеваемостью мужчин. Семейные случаи заболевания ЛГМ крайне редки.
Вероятность возникновения заболевания возрастает в 3 раза при инфицировании вирусом Эпштейна-Барр, при развитии иммунодефицита (приобретенного и врожденного) аутоиммунных заболеваниях. Однако научного подтверждения роли определенных вирусов в возникновении ЛГМ на сегодняшний день нет.
Установлено, что в 5% случаев ЛГМ сочетается с туберкулезом, в подобных ситуациях зачастую отмечается отрицательная реакция Манту. Больные ЛГМ подвержены различным вирусным инфекциям, у них часто отме- чается тяжелое течение опоясывающего лишая (Herpes zoster).
В настоящее время наиболее обоснованной считается модель возникновенияЛГМ,предложеннаяV.Diehl(1997г.),согласнокоторойклеткиБерезовско-
575
го-Штернберга-Рида являются следствием неконтролируемой моноклональной пролиферации зрелых В-клеток зародышевого центра фолликула лимфатического узла, которые в силу различных причин, избежали апоптоза.
С целью дифференциальной диагностики ЛГМ в качестве маркеров могут применяться антигены CD15 и CD30.
ЛГМ характеризуется злокачественной гиперплазией лимфоидной ткани с образованием лимфогранулем в лимфатических узлах и внутренних органах. Как правило, изменения начинаются в одной группе лимфати- ческих узлов (надключичной или подмышечной области, шеи, паха, средостения), в дальнейшем распространяясь на другие группы, часто с одновременным поражением внутренних органов, содержащих лимфоидную ткань (селезенка, желудочно-кишечный тракт, печень).
Диагноз ЛГМ устанавливается исключительно гистологически на основе выявления клеток Березовского-Штернберга-Рида. Адекватная диагностика возможна только при исследовании структуры всего лимфатического узла, так как нередки случаи частичного поражения его ткани. В неясных случаях показано иммуногистологическое исследование.
Различают периферическую форму ЛГМ (поражение поверхностных лимфатических узлов), а также – медиастинальную, абдоминальную, легоч- но-плевральную, желудочно-кишечную и более редкие варианты костной, кожной и нервной форм заболевания.
Морфологическая классификация лимфогранулематоза
Современная морфологическая классификация ВОЗ выделяет 4 основные формы лимфомы Ходжкина:
1.Вариант с нодулярным склерозом (30-45%): I тип – смешанно-клеточный;
II тип – с лимфоидным истощением.
2.Смешанно-клеточный вариант (30-45%).
3.Вариант с большим количеством лимфоцитов, классическая лимфома Ходжкина (10%).
4.Вариант с лимфоидным истощением (10%)
Клиника лимфогранулематоза
Клиника ЛГМ складывается из местных и общих проявлений. Основным симптомом заболевания является увеличение лимфатических узлов, которые имеют плотно-эластичную консистенцию, безболезненны, не спаяны между собой и с кожей.
Вначале чаще всего поражаются надключичные (50-55%), шейные (50-55%) и подмышечные (10%) лимфоузлы. В отличие от инфекционных заболеваний, увеличенные лимфатические узлы безболезненны, их размеры не уменьшаются со временем и при лечении антибиотиками.
576
Боли при ЛГМ, как правило, отсутствуют, но приблизительно 25% больных отмечают появление болевых ощущений в увеличенных узлах после приема алкоголя.
При локализованном поражении шейных лимфатических узлов увеличенные узлы нередко принимают за туберкулезный лимфаденит и, не проводя никаких диагностических мероприятий, лечат больного противотуберкулезными средствами, в то время как болезнь продолжает прогрессировать и распространяться, захватывая другие группы лимфатических узлов и внутренние органы. Изьязвление лимфатических узлов и появление свищей при ЛГМ бывает крайне редко и требует тщательного морфологического исследования на предмет наличия туберкулеза, актиномикоза или других инфекционных заболеваний.
При увеличении медиастинальных лимфоузлов могут быть боли в груди, кашель, умеренная дисфагия, синдром сдавления верхней полой вены, гидроторакс, перикардит. Опухоль может прорастать в легкое, перикард, трахею, пищевод, грудину, грудную стенку. При гидротораксе и перикардите практически всегда обнаруживается транссудат в котором клетки Березовского-Штернберга-Рида, как правило, не выявляются.
Легкие поражаются при ЛГМ наиболее часто из нелимфоидных органов(в 20-30% случаев), изменения могут быть очаговыми или инфильтративными, нередко с распадом и образованием полостей, что всегда требует тщательной дифференциальной диагностики с туберкулезом и другими, в том числе грибковыми, инфекциями. Легочные изменения, как правило, развиваются на фоне увеличения медиастинальных лимфоузлов из которых опухоль в ряде случаев может врастать непосредственно в легкое.
При увеличении забрюшинных лимфоузлов отмечаются ночные боли в пояснице, менее выраженные в согнутом положении, на корточках. Увели- чение селезенки отмечается у 25% больных ЛГМ, явления гиперспленизма крайне редки. Описаны случаи проращения желудка увеличенными забрюшинными лимфоузлами.
Поражение печени встречается у 10-12% больных, протекает бессимптомно и не сопровождается узловыми изменениями и увеличением органа. Диагноз устанавливаетсянаоснованиигистологическогоизучениябиоптатапечени.При прогрессировании заболевания печень поражается у половины больных.
Костные метастазы находят у 15-20% больных ЛГМ, чаще поражаются позвонки, грудина, кости таза. Жалобы на боли в костях могут на несколько месяцев опережать появление рентгенологически выявляемых очагов деструкции.
Поражение костного мозга встречается у 15-20% больных, протекает бессимптомно, проявляется анемией, лейко- и тромбоцитопенией, диагностируется на основании гистологического исследования биоптата, полученного при трепанбиопсии подвздошной кости.
Остальные органы и центральная нервная система поражаются при ЛГМ редко, с частотой не более 1-3%.
577
Различают два варианта течения ЛГМ:
–бессимптомное,проявляющеесятолькоувеличениемлимфатическихузлов;
– с симптомами общей интоксикации.
Симптомы интоксикации встречаются у 1/3 больных ЛГМ: наиболее типичны для заболевания периодические волнообразные повышения температуры, кожный зуд, проливной пот, нарастающая слабость, а также специфические изменения со стороны крови (лейкоцитоз или лейкопения, моноцитоз, анемия и др.).
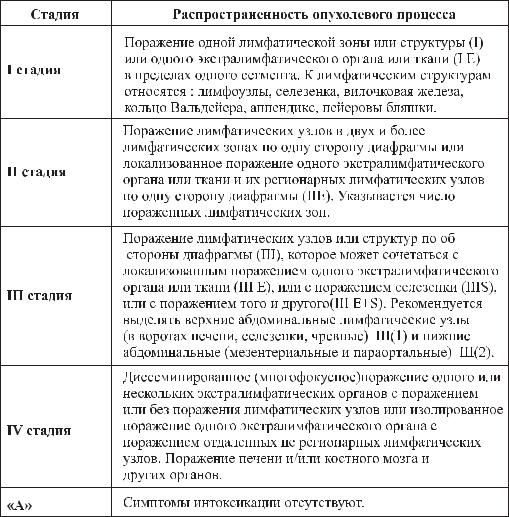
Международная клиническая классификация лимфогранулематоза (лимфомы Ходжкина)
578
