
Полезные материалы за все 6 курсов / Учебники, методички, pdf / методичка онкология лекции
.pdfчества жизни 105 пациенток в сроки от 6 месяцев до 5 лет после операции. Установлено, что 90 % женщин до операции были сексуально активны, из этой группы у 15 % сексуальное общение было прервано после оперативного вмешательства. После лучевой терапии отсутствие полового влечения было самой обычной проблемой – 82 % женщин в возрасте моложе 50 лет страдали половой дисфункцией. Считается, что половая дисфункция продолжает оставаться хронической проблемой у женщин после радикальной экстирпации матки по поводу РШМ. Так же как и органические причины, очень сильным является психогенный фактор, обусловленный утратой гормональной и репродуктивной функции, что сопровождается депрессией и беспокойством относительно продолжения своих отношений с половым партнером.
Вместе с тем, в литературе отмечено, что качество жизни пациенток после гистерэктомии изучено недостаточно, хотя, по мнению авторов, полученные в этом отношении данные могут способствовать ограничению неоправданного радикализма или излишнего консерватизма при определенных вмешательствах на половых органах женщины.
Проблема психологической реабилитации больных раком шейки матки (РШМ) приобрела в последнее время заметное социальное значение в связи с важными тенденциями:
–во-первых,всвязисувеличениемобщегочислабольных,РШМотмечен- ное за последнее десятилетие в большинстве стран мира, включая и Украину, гдеРШМ, занимавший по частоте четвертое место, переместился на второе;
–во-вторых, из-за прогрессирующего увеличения частоты заболеваемости раком шейки матки у женщин фертильного возраста, особенно в возрастных группах до 35 лет;
–в третьих, на фоне успехов комбинированного лечения и совершенствования методов лучевой терапии цервикального рака, позволивших заметно улучшить показатели пятилетней выживаемости;
–в четвертых, в связи с тем, что адекватно выполненные хирургические операции, сохраняющие функцию яичников, не только избавляют от страданий, но и улучшают качество жизни пациенток.
Увеличение продолжительности жизни основной массы больных раком шейки матки сегодня ставит вопрос не только о том, сколько прожила пациентка, но и как она их прожила. В связи с эти повышается роль организационных мероприятий по реабилитации этого контингента онкологических больных.
Важно подчеркнуть, что на сегодняшний день в Украине применяемые методы лечения не всегда соответствуют международным требованиям, а методология определения качества жизни как одна из основных целей ле- чения онкологических больных зачастую отсутствуют.
539
ГЛАВА XXII
РАК ТЕЛА МАТКИ
Профессор Куприенко Н.В.
Заболеваемость раком тела матки
Рак эндометрия встречается реже, чем рак молочной железы. В Украине число заболевших раком тела матки (РТМ) во всех возрастных группах в пересчете на 100000 населения равнялось в 2000 г., соответственно, 12,5 и 38,2, а среднегодовой прирост заболеваемости в интервале 1991–2000 гг. находился на уровне 3,13% и 2,63%. То есть, относительное увеличение числа впервые выявленных случаев РТМ идет, по крайней мере, параллельно росту заболеваемости раком молочной железы. В то же время, по данным программы SEER, среди женского населения США никакого прироста заболеваемости раком эндометрия за указанный период времени не произошло (24,5 в 1991 г. и 24,4 в 2000 г.), в то время как число заболевших раком молочной железы (прежде всего, за счет женщин постменопаузального возраста) продолжало расти. Подобные различия между заболеваемостью в разных странах могут бытьобъясненысоциальноэкономическимииэтническимифакторами,атакже определенными отличиями в природе самих этих опухолей и ассоциированных с ними гормональнометаболических нарушений.
В 2000 г. на долю РТМ приходилось 6,5% всех случаев злокачественных новообразований, выявленных среди женского населения (для сравнения: рак молочной железы – 19,3%, рак шейки матки – 5,3%, рак яичников – 5,0%). Заболеваемость раком эндометрия в возрастном интервале от 40–44 лет до 50–54 лет делает резкий скачок, увеличиваясь примерно в 4 раза, постепенно достигает пика к периоду 60–64 лет, после чего заметно снижается. Таким образом, частота распространения рака эндометрия и ее динамика в разных странах под влиянием миграционных процессов и возраста указывают на несомненные специфические особенности заболевания и на зависимость его возникновения от комплекса причин эндогенной и экзогенной природы.
Этиология и факторы риска возникновения РТМ
К причинам, увеличивающим риск развития рака тела матки (РТМ) можно отнести следующие факторы:
–бесплодие и нарушения менструального цикла, связанные с ановуляцией и гиперэстрогенией;
–отсутствие родов (увеличивает риск РТМ в 2-3ðàçà);
–поздняя менопауза (менопауза после 52 лет увеличивает риск РТМ в
2,4 ðàçà);
540
–ожирение (при массе тела на 10 – 22,5 кг выше нормы риск РТМ увеличивается в 3 раза, более 22,5 кг – в 10 раз);
–синдром Штейна – Левенталя (увеличивает риск РТМ в 14 раз);
–заместительная гормонотерапия в постменопаузе (увеличивает риск РТМ в 4-8 раз), одновременная прогестагенная терапия полностью снижает риск;
–прием тамоксифена при раке молочной железы увеличивает риск РТМ
â2-3 ðàçà;
–сахарный диабет увеличивает риск РТМ в 1,3 – 2,8 раза;
–гиперпластические процессы в эндометрии.
Многие исследователи отводят основную роль в патогенезе заболевания избыточной эстрогенной стимуляции эндометрия, сочетающейся с недостаточностью прогестерона и потому получившей название «unopposed» (т.е. не испытывающей противодействия). С позиций этой концепции могут быть объяснены, например, связь возникновения болезни с бесплодием (через ча- стые ановуляторные циклы), ожирением (через усиленную экстрагонадную продукцию эстрогенов), поликистозом яичников (через свойственное ему избыточное образование предшественника эстрогеновандростендиона). Как полагают, избыточное влияние эстрогенов в условиях дефицита прогестерона может приводить к гиперплазии эндометрия, которая, несмотря на свою обратимость, способна прогрессировать в атипический вариант, в 20–25% случаев предрасположенный к превращению в аденокарциному.
Роль эстрогенов и гиперэстрогенизации в патогенезе рака эндометрия подтверждают данные о повышении частоты обнаружения РТМ у женщин постменопаузального возраста, в течение длительного времени получавших заместительную терапию (ЗГТ) эстрогенсодержащими препаратами. Такое осложнение ЗГТ проявляется, преимущественно, у некурящих женщин, что может быть связано и с «антиэстрогенным» эффектом табачного дыма и с его влиянием на метаболизм эстрогенов. В период, когда эстрогены принимались в «чистом виде» (т.е. без прогестинов), риск возникновения РТМ, по имеющимся данным, возрастал в 4–8 раз и сохранялся на этом уровне на протяжении 3–5 лет после прекращения приема с последующим снижением.
Существенно, что роль ожирения как фактора риска возникновения РТМ в репродуктивном возрасте более значима, чем в менопаузе. Клинические проявления ожирения варьируют, верхний тип жироотложения, с присущей ему инсулинорезистентностью и другими эндокринно-обменными нарушениями (включая гиперлептинемию), свойственными канкрофилии, чаще встречается у женщин, предрасположенных к развитию рака эндометрия. Повышение уровня лептина в крови, как правило, коррелирует с массой тела,
541
способность этого гормона, продуцируемого жировой тканью, препятствовать овуляции и выработке прогестерона в яичниках, несомненно, должна приниматься во внимание при оценке риска развития РТМ.
Рассматриваются два патогенетических варианта РТМ:
–первый, наиболее частый, возникает у молодых, на фоне гиперэстрогении, сахарного диабета, гипертонической болезни, ожирения (в подобных случаях высокодифференцированный рак развивается на фоне гиперплазии эндометрия, отличается благоприятным прогнозом);
–второй, возникает в старшем возрасте в глубокой постменопаузе, на фоне атрофии эндометрия, без гиперэстрогенэмии (в подобных случаях рак, как правило, низкодифференцированный, отличается неблагоприятным прогнозом).
Предраковые заболеваниятела матки
К фоновым процессам рака тела матки относят железистую гиперплазию и эндометриальные полипы. Железистая гиперплазия эндометрия (ЖГЭ) часто определяется у больных с ановуляторными маточными кровотечениями. Клиницисты не усматривают существенных различий между железистой и железисто-кистозной гиперплазией эндометрия, так как кистозное расширение желез свидетельствует не о степени гиперпластического процесса, а скорее об атрофических изменениях эндометрия. Полипы эндометрия развиваются вследствие пролиферации желез базального слоя эндометрия. Непременное анатомическое свойство полипа – наличие ножки, состоящей из фиброзной и гладкомышечной ткани. Признак «органоидности» отличает полип от полиповидной формы ЖГЭ, которую иногда обозначают как полипоз эндометрия.
Атипическая гиперплазия эндометрия (АГЭ) является предраковым заболеванием тела матки. Микроскопически АГЭ характеризуется значительным преобладанием железистых элементов над стромальными, чего не бывает при ЖГЭ. Но при АГЭ цитогенная строма между атипическими железами всегда сохранена, что отличает ее от высокодифференцированной аденокарциномы эндометрия. Дискуссионным остается вопрос о правомерности дианоза «Са in situ» эндометрия, так как с точки зрения биологи- ческого поведения тяжелая АГЭ эквивалентна современным представлениям о преинвазивном раке и гистологически ее трудно отличить от высокодифференцированной аденокарциномы эндометрия. По сводным литературным данным прогрессия АГЭ в инвазивный рак отмечается в 20-50% наблюдений (в среднем 40%) на протяжении от одного года до 13 лет, что определяет необходимость ее выявления и безотлагательного лечения.
542
Морфологическая классификация РТМ
Международная классификация рака эндометрия, которая используется в настоящее время, выделяет две группы эндометриальных карцином: эндометриоидные и неэндометриоидные (редкие), включающие серозно-па- пиллярный, светлоклеточный, муцинозный, плоскоклеточный, смешанный и недифференцированный рак.
Морфологическаяклассификацияэндометриальныхкарцином(ВОЗ,1994).
1.Эндометриоидные
1.1.Аденокарцинома:
1.1.1.Секреторная;
1.1.2.Цилиарно-клеточная (реснитчато-клеточная).
1.2.Аденокарцинома со сквамозной дифференциацией:
1.2.1.Аденокарцинома со сквамозной метаплазией (аденоакантома);
1.2.2.Аденосквамозная карцинома.
2.Серозно-папиллярный ðàê
3.Светлоклеточная аденокарцинома.
4.Муцинозная аденокарцинома.
5.Плоскоклеточная карцинома.
6.Смешанная карцинома.
7.Недифференцированная карцинома.
8.Редкие формы.
Метастазирование рака эндометрия
Преобладающим типом метастазирования рака эндометрия является лимфогенный, обычно в сочетании с гематогенным или имплантационным. Вначале образуются метастазы в лимфатических узлах таза, затем поражаются поясничные, реже – паховые лимфатические узлы и отдаленные органы. Клинически выделяют три этапа развития рака эндометрия.
Первый этап развития РТМ охватывает период от возникновения инвазивного рака до момента его глубокого прорастания в миометрий. Этот этап характеризуется развитием самой первичной опухоли, которое происходит в направлении постепенной потери снижения ее дифференцировки. Обнаружение высокодифференцированногожелезистогоракаявляетсяотражениеммедленных темпов прогрессии опухоли. И наоборот, снижение дифференцировки опухоли свидетельствует о быстрых темпах ее роста и нарастании автономности.
Второй этап характеризуется местно-регионарным распространением. Он начинается с глубокого прорастания опухоли в миометрий, после чего темпы роста могут ускориться. Это обусловлено разрушением мышечно-
543
го и субсерозного лимфатических сплетений, приводящим к значительному увеличению частоты образования метастазов в лимфоузлах таза. Основными путями метастазирования являются подвздошные и парааортальные лимфоузлы. Поражение подвздлшных лимфатических узлов наблюдается при раке, локализующимся в нижнем сегменте матки и цервикальном канале. При I стадии метастазы выявляются в 10%, при II стадии в 35% случаев.
Третий этап развития РТМ, измеряется промежутком времени от прорастания опухоли за серозную оболочку матки и образования регионарных метастазов до широкой лимфогематогенной и имплантационной диссеминации. При прорастании серозной оболочки матки или поражении яичников возможен «овариальный» тип метастазирования – метастазы по париетальной брюшине, в большом сальнике, асцит.
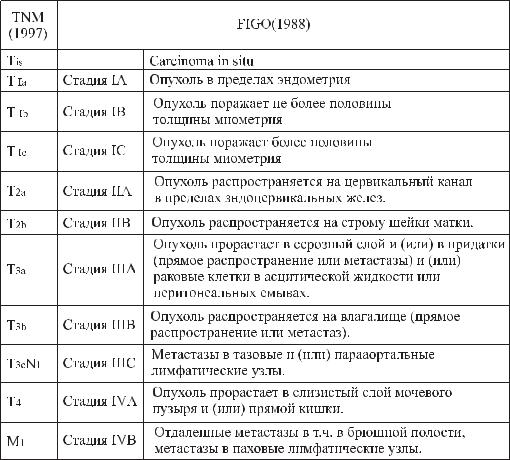
Международная классификация РТМ
544
Клинические проявления рака тела матки
Основные симптомы рака тела матки – гиперменорея или ациклические маточные кровотечения, которые отмечаются в 95-98% случаев. При стенозе цервикального канала возможно накопление содержимого в полости матки с развитием гематометры или пиометры, которые значительно ухудшают прогноз заболевания и могут сопровождаться лейкореей и болями.
Болевой синдром при РТМ обусловлен сдавлением и воспалением запирательного или седалищного нервов лимфогенными метастазами или инфильтратами, как правило, в далеко зашедших случаях.
Методы диагностики рака тела матки
Большое значение в диагностике РТМ придается изучению анамнеза, следует уточнить состояние менструальной функции (время наступления первой менструации, длительность репродуктивого периода, наличие ацикли- ческих маточных кровотечений, особенности течения климакса и время наступления менопаузы) и генеративной функции. Особоое значение имеет выявление обменных нарушений, гипертонической болезни, ожирения и сахарного диабета, онкологических и предраковых заболеваний эндометрия.
Обследование больных раком эндометрия начинается с бимануального ректовагинального исследования. При этом ректальное исследование является обязательным, поскольку позволяет определить через эластичную стенку прямой кишки состояние параметриев и дугласова пространства, что является принципиальным моментом для определения стадии опухолевого процесса и операбельности самой опухоли.
Среди инструментальных методов исследования, в связи с высокой информативностью и простотой, на первом этапе применяется цитологическое исследование аспирата из полости матки.
Чувствительность цитологического метода выявления рака эндометрия 92,1%, специфичность 99%. При подозрении и наличии атипической гиперплазии эндометрия или рака эндометрия следующим диагностическим приемом становится гистероцервикография или гистероскопия для уточ- нения особенностей опухолевого роста – локализации и протяженности поражения. При отсутствии возможности выполнения гистероскопии выполняют раздельное диагностическое выскабливание слизистой оболочки матки и цервикального канала. Однако, следует заметить, что при использовании этого доступного но, в то же время «слепого», метода, примерно в 10% случаев морфологическое заключение может быть ошибочным, в 3% случаев биопсийный материал не информативен.
545
ВажнуюрольвдиагностикеРТМиграет сонография (УЗИ).Однакоинформативность ее не превышает 66,3% при точности – 87,7%, чувствительности – 86,1% и специфичности – 89,6%. Следует отметить, что информативность сонографииупациентокпостменопаузальногопериодазначительновыше(86,0%), чем в группе больных перименопаузального периода (57,9%). Основная доля ошибочных заключений при атипических кровотечениях в перименопаузе приходится на гиперпластические процессы, атрофию эндометрия и аденомиоз.
Ультразвуковая компьютерная томография (УЗКТ) с использованием трансректального, трансвагинального датчиков и доплерографии, позволяет болеедетальноизучитьсостояниеиструктуруэндометрияимиометрия,размеры опухоли, глубину инвазии и состояние регионарных лимфатических узлов.
В первичной диагностике основное значение придается морфологической верификации патологического процесса. Использование сонографии на самых начальных этапах диагностического процесса у определенной части пациенток позволяет исключить обзорную гистероскопию, например, при убедительных ультразвуковых признаках рака или атрофии эндометрия. В первом случае обследование дополняется аспирационной биопсией, во втором – предпринимается по показаниям лечение и наблюдение. С этой точ- ки зрения, предпочтительнее обзорная гистероскопия с прицельной аспирационной биопсией эндометрия.
Скрининг рака эндометрия
Скрининг рака эндометрия включает в себя три составных момента:
–*социально-культурный или этнический аспект;
–**медицинский аспект;
–***экономический аспект.
Методологической базой скрининга является сонография(УЗИ). Однако ультразвуковые критерии скрининга при патологических процессах эндометрия имеют ряд ограничений и требуют соблюдения следующих принципов:
1 – в репродуктивном и перименопаузальном периодах исследование должно выполняться в ранней I фазе менструального цикла;
2 – срединные маточные структуры (М-эхо) «нормального» эндометрия не должны превышать 6 мм;
3 – в постменопаузе основной ультразвуковой признак атрофии соответствует толщине срединных маточных структур менее 4 мм.
Обобщенные данные литературы свидетельствуют о том, что большинство исследователей в качестве порогового диагностического критерия гиперпластических процессов эндометрия в постменопаузальном периоде выбирают толщину М-эхо 4 или 5 мм.
546
Считается целесообразным рассматривать 3 варианта последующего обследования с учетом данных толщины М-эхо:
–при толщине М-эхо до 4 мм можно ограничиться динамическим (не более 1 раза в 2–3 года) ультразвуковым наблюдением;
–ïðè М-эхо до 12 мм. необходима гистероскопия, визуальная оценка характера изменений в полости матки с последующей прицельной аспирационной биопсией эндометрия;
–ïðè М-эхо более 12 мм. велика вероятность злокачественного процесса, поэтому целесообразна аспирационная биопсия эндометрия.
Следует исходить из того, что при определении характера патологического процесса в полости матки необходимо ориентироваться только на адекватную прицельную биопсию с гистологическим заключением.
Хирургическая анатомия матки
Маткарасполагаетсявмаломтазумеждумочевымпузыремипрямойкишкой. Она состоит из двух отделов : верхнего – тела матки и ее дна и нижнего – шейки матки. По бокам от матки листки бришины образуют широкие связки матки, расположенные во фронтальной плоскости. В свободном крае широких связок матки заложены придатки матки, маточные трубы. К заднему листку широкой связки матки при помощи брыжейки фиксирован яичник. Кровоснабжение матки осуществляется двумя маточными артериями (aa.uterinae), яичниковымиартериями (aa.ovaricae)иартериямикруглойсвязкиматки.Воперативной гинекологнии наибольший интерес представляют топографоанатомические взаимоотношения маточных сосудов и мочеточников, посколькупри мобилизации этих анатомических образований случается наибольшее количество ятрогенных осложнений. Начало маточной артерии (которая является ветвью внутренней подвздошной артерии) прикрыто сверху мочеточником. На расстоянии 4-5 см книзу от места отхождения маточная артерия проникает в основную связку матки, лежащую в основании широкой связки, и , не доходя 2 см до шейкиматкиперекрещиваетмочеточниксверху.Убоковогокраяматкиартерия отдает влагалищную ветвь и поднимается вверх по ребру матки.
Хирургическое лечение рака тела матки
ХирургическийметодтрадиционноявляетсяосновойлечениябольныхРТМ. Хирургические вмешательства выполняются у 90% больных, как на ранних, так и на поздних стадиях заболевания. Высокая частота РТМ I–II стадий объясняет то, что хирургическое лечение проводится подавляющему большинству больных с этой злокачественной опухолью. По мере совершенствования хирургической техники, анестезии, предоперационной подготовки
547
èпослеоперационного ведения становится все меньше больных РТМ, которым операция противопоказана из-за сопутсвующих заболеваний. Среди больных РТМ ранних стадий не подвергаются операции из-за тяжелых сопутствующих заболеваний не более 13%. Обязательно тщательное предоперационное обследование больной. Оно должно включать физикальное исследование (пальпацию живота, лимфатических узлов, гинекологическое исследование), общий анализ крови и мочи, биохимическое исследование крови,коагулограмму,ЭКГ,рентгенографиюгруднойклетки,УЗИмалоготаза, брюшной полости и забрюшинного пространства. Определение уровня CA-125 в сыворотке позволяет косвенно судить о распространенности опухоли. По показаниям проводят КТ, МРТ, экскреторную урографию, цистоскопию, ректороманоскопию, ирригоскопию.
Óнебольшой части больных РТМ при обследовании выявляется распространенный опухолевый процесс, препятствующий операции: массивный переход опухоли на шейку матки, инфильтраты в параметриях, врастание в мочевой пузырь или прямую кишку, отдаленные метастазы. Учитывая то, что РТМ обычно наблюдается у пожилых женщин, необходимо всестороннее обследование, направленное на выявление сопутствующих заболеваний, и тщательная подготовка к хирургическому лечению.
Первым этапом лечения большинства больных РТМ I и II стадией опухолевого процесса является экстрафасциальная экстирпация матки с придатками. Удаление придатков матки обязательно, поскольку в них нередко обнаруживаются метастазы. Кроме того, у больных РТМ повышен риск синхронного и метахронного рака яичников.
В последние годы появляются работы, посвященные органосохраняющему лечению больных РТМ. Редкость РТМ у женщин детородного возраста не позволяет пока дать общих рекомендаций по внедрению в клиническую практику аблации эндометрия и гормонотерапии как самостоятельных методов лечения РТМ ранних стадий. Необходимы дальнейшие клинические исследования, которые позволят оценить эффективность этих методик
èотдаленные результаты лечения.
Что касается сохранения яичников у женщин детородного возраста, не планирующих иметь детей, то такой подход считается нецелесообразным, поскольку это делает неадекватным определение морфологической стадии заболевания и может привести к серьезным ошибкам в планировании лече- ния, а кроме того – существует альтернатива сохранению яичников у больных РТМ – заместительная гормональная терапия.
РТМ долгое время необоснованно считали противопоказанием к заместительной гормональной терапии, полагая, что эстрогены могут стимули-
548
