
mikra
.pdf2. А н т и г е н - растворенные вещества белковой или липоидно-полисахаридной природы (полные антигены, гаптены, экстракты или лизаты микробов или других клеток).
3. И з о т о н и ч е с к и й р а с т в о р х л о р и д а н а т р и я.
Внимание! Все компоненты, участвующие в этой реакции, должны быть совершенно прозрачными.
Основные методы проведения реакции преципитации: реакция кольцепреципитации и реакция преципитации в агаре (геле).
Методика
В преципитационную пробирку с помощью пастеровской пипетки вносят 0,2-0,3 мл (5-6 капель) сыворотки. На сыворотку осторожно наслаивают антиген в таком же объеме, наливая его тонкой пастеровской пипеткой по стенке пробирки. Пробирку при этом держат в наклонном положении. При правильном наслаивании между сывороткой и антигеном должна получиться четкая граница. Осторожно, чтобы не перемешать жидкости, пробирку ставят в штатив. При положительном результате реакции на границе антигена и антитела образуется мутное «кольцо» - преципитат. Реакция сопровождается рядом контролей
Схема постановки РП (кольпреципитация по Асколи
Объем |
|
Номер пробирки |
|
ингредиентов, мл |
|
|
|
|
|
|
|
|
|
2 (контроль) |
3 (контроль) |
|
|
|
|
0,2 |
преципитирующая |
нормальная |
физиологический |
|
сыворотка |
сыворотка |
раствор |
|
|
|
|
0,2 |
Аг из экстракта |
Аг из экстракта |
Аг из экстракта |
|
шерсти |
шерсти |
шерсти |
|
|
|
|
Реакция преципитации в геле
Иммунодиффузия в агаровом геле растворов антигенов и антител, залитых в разные лунки, навстречу друг другу в случаях соответствия их специфичности приводит к образованию специфического преципитата в виде полосок и дуг в местах встречи реагентов.
Как правило, в центральную лунку заливают стандартный раствор антигена, а в периферические - испытуемые сыворотки. В одну из периферических лунок заливается стандартная иммунная сыворотка соответствующей специфичности, а в другую -нормальная сыворотка для контроля. Проводится инкубация во влажной камере при 37°С в течение 24 ч. Учитывают количество и ширину полос преципитации между центральной лункой с раствором антигена и лунками с исследуемыми сыворотками.
№ 53 Реакция связывания комплемента. Механизм. Компоненты. Применение.
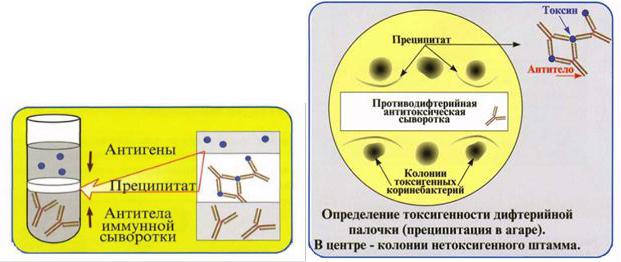
Реакция связывания комплемента (РСК)
Реакция связывания комплемента протекает в 2 фазы. В первой (специфической) взаимодействуют антиген, антитело и комплемент. Если антиген соответствует антителу, они соединяются и образуют комплекс, который связывает комплемент. Образовавшееся соединение внешне не проявляется. Об его образовании узнают с помощью индикатора, которым является гемолитическая система, участвующая во второй (индикаторной) фазе реакции. Гемолитическая система состоит из эритроцитов барана и соответствующей гемолитической сыворотки. Гемолитическая сыворотка, реагируя с эритроцитами, делает их чувствительными (сенсибилизирует) к действию комплемента, в присутствии которого эритроциты разрушаются (лизируются). Если лизиса нет, комплемент связан первой системой и, следовательно, антиген в ней соответствует антителу. Отсутствие гемолиза регистрируют как положительный ответ. Если в испытуемой системе антиген не соответствует антителу, иммунный комплекс не образуется и комплемент остается свободным. Свободный комплемент участвует во второй системе, вызывая гемолиз эритроцитов, результат РСК при этом отрицательный.
Для постановки РСК требуется точное определение количественных соотношений всех ингредиентов, участвующих в реакции: исследуемой сыворотки, антигена, комплемента, гемолитической сыворотки кролика и эритроцитов барана. Поэтому, постановке основного опыта предшествует титрование гемолитической сыворотки и выбор ее рабочего разведения, титрование других ингредиентов.
В РСК используют:
1. Прогретую (инактивированную) сыворотку при 56°С в течение 30 мин, чтобы разрушить имеющийся в ней комплемент. Обычно сыворотку больного применяют в разведении 1:5-1:10, иммунные (диагностические) сыворотки – в разведении 1:50 и более.
2.Диагностикум.
3.Комплемент в рабочей дозе. Перед опытом С обычно титруют, т. е. определяют наименьшее его количество, при добавлении которого к гемолитической системе происходит полный гемолиз в течение 1 ч при 37°С. Титруют С по схеме.
4.Эритроциты барана. Используют 3% взвесь отмытых эритроцитов барана.
5.Гемолитическая сыворотка.
ВРСК применяют гемолитическую сыворотку в тройном титре. Например, если титр гемолитической сыворотки составляет 1/200, то рабочее разведение сыворотки составляет 1/400,
следовательно, к 0,1 мл гемолитической сыворотки следует добавить 39,9 мл изотонического раствора хлорида натрия
Применение. РСК применяют для диагностики многих инфекционных болезней, в частности сифилиса (реакция Вассермана).
54. Реакция нейтрализации токсина антитоксином, нейтрализации вирусов в культуре клеток и в организме лабораторных животных. Механизм. Компоненты. Способы постановки. Применение.
В основе этой реакции лежит способность специфической антитоксической сыворотки нейтрализовать экзотоксин. Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов, что связано с блокадой микробных антигенов
антителами, т. е. их нейтрализацией.
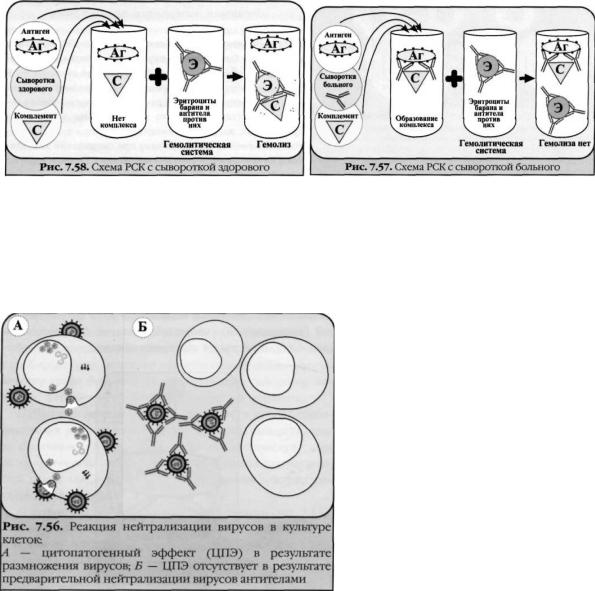
Реакцию нейтрализации (РН) проводят путем введения смеси антиген—антитело животным или в чувствительные тестобъекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген—антитело.
Для проведения реакции исследуемый материал, в котором предполагается наличие экзотоксина, смешивают с
антитоксической сывороткой, выдерживают в термостате и вводят животным (морским свинкам, мышам). Контрольным животным вводят фильтрат исследуемого материала, не обработанный сывороткой. В том случае, если произойдет нейтрализация экзотоксина антитоксической сывороткой, животные опытной группы останутся живыми. Контрольные животные погибнут в результате действия экзотоксина.
Реакция нейтрализации (РН) используется для определения в исследуемом материале наличия бактериальных токсинов или вирусов. Индикаторной системой служат биологические объекты. Постановка РН осуществляется в 2 этапа (первый этап – in vitro, второй этап - in vivo): Смешивание исследуемого материала с антитоксической (противовирусной) сывороткой, инкубация в течение часа; Введение смеси материал+сыворотка в организм лабораторных животных либо заражение клеточных культур (опытная группа). Одновременно исследуемый материал (без антисыворотки) вводят контрольной группе животных (клеточных культур). Учет результатов РН проводят после гибели животных (клеточных культур) контрольной группы. Если
при этом в опытной группе животные (клеточные культуры) не погибают, реакцию считают положительной: антитела в этом случае нейтрализуют биологическое действие токсина (вируса).
55. Реакция иммунофлюоресценции. Механизм. Компоненты. Применение.
Реакция иммунной флюоресценции (РИФ)
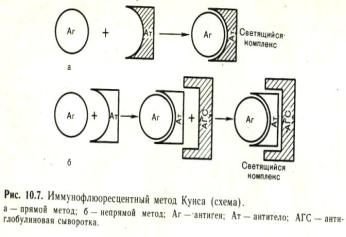
Реакция основана на том, что иммунные сыворотки обрабатывают флюорохромами (ФИТЦ), которые соединяются с антителами. Сыворотки при этом не теряют своей иммунной специфичности. При взаимодействии полученной люминесцентной сыворотки с соответствующим антигеном образуется специфический светящийся комплекс, легко видимый в люминесцентном микроскопе.
Различные иммунофлюоресцентные сыворотки могут быть использованы для прямого и непрямого метода иммунофлюоресценции. При прямом методе специфические флюоресцирующие иммунные сыворотки готовят для каждого микроба путем иммунизации кролика убитой культурой возбудителя, затем иммунную сыворотку кролика соединяют с флюорохромом (изоционат или изо-тиоционат флюоресцеина). Метод применяется для экспрессдиагностики с целью обнаружения бактериальных или вирусных антигенов.
Непрямой метод предусматривает использование диагностической иммунной не флюоресцирующей сыворотки (иммунизированного кролика или больного человека) и флюоресцирующей сыворотки, имеющей антитела против видовых глобулинов диагностической сыворотки.
Иммунофлюоресцентный метод (РИФ, реакция иммунофлюоресценции) - метод выявления специфических Аг с помощью Ат, конъюгированных с флюорохромом. Обладает высокой чувствительностью и специфичностью.
Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения Ат и поверхностных рецепторов и маркеров лейкоцитов (иммунофенотипирование) и др. клеток.
Различают три разновидности метода: прямой, непрямой, с комплементом.
Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах
люминесцентного микроскопа. |
Бактерии |
||
в |
мазке, |
обработанные |
такой |
люминесцирующей сывороткой, |
светятся |
||
по периферии клетки в виде каймы зеленого цвета. Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами
микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела,
меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе.
Механизм. На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген — антитело препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изотоническим раствором хлорида натрия для удаления не связавшихся с антигеном антител. Затем на препарат наносят флюоресцирующую антиглобулиновую сыворотку против глобулинов кролика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими анти телами образуются светящиеся комплексы антиген — антитело, которые обнаруживаются при люминесцентной микроскопии.
Применяется в основном для обнаружения возбудителей инфекций мочеполовых путей, таких как хламидии, микоплазмы, трихомонады, гонококки, вирус герпеса и пр.
56. Иммуноферментный анализ. Иммуноблотинг. Механизмы. Компоненты. Применение.
Иммуноферментный анализ (ИФА)
Широкое применение находит твердофазный иммуноферментный анализ (ИФА). Он основан на том, что белки прочно адсорбируются на пластинках, например из поливинилхлорида. Один из наиболее распространенных на практике вариантов ИФА основан на использовании меченных ферментом специфических антител той же специфичности. К носителю с иммобилизованными антителами добавляют раствор с анализируемым антигеном. В процессе инкубации на твердой фазе образуются специфические комплексы антиген-антитело. Затем носитель отмывают от не связавшихся компонентов и добавляют гомологичные антитела, меченные ферментом, которые связываются со свободными валентностями антигена в составе комплексов. После вторичной инкубации и удаления избытка этих меченных ферментом антител определяют ферментативную активность на носителе, величина которой будет пропорциональна начальной концентрации исследуемого антигена.
При другом варианте ИФА к иммобилизованному антигену добавляют исследуемую сыворотку. После инкубации и удаления не связавшихся компонентов с помощью меченных ферментом антиглобулиновых антител выявляют специфические иммунокомплексы. Данная схема является одной из наиболее распространенных при постановке ИФА.
*
+
Специфические |
Исследуемый материалСпецифические антитела Субстрат |
антитела |
|
возбудитель |
с пероксидазой |
для пероксидазы |
||||||||
|
+ |
|
|
|
|
|
|
|
|
|
||
|
|
* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Исследуемая |
АГС, меченая |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
сыворотка |
|
пероксидазой |
|
Субстрат для |
|
|
|||
|
|
Специфический |
|
|
|
|
пероксидазы |
|
|
|||
|
|
|
|
|
|
|||||||
антиген
Контроль:
позитивный - иммунная сыворотка, меченная пероксидазой + субстрат - 2 лунки;
негативный - нормальная сыворотка + субстрат - 2 лунки.
Иммуноферментный анализ или метод — выявление антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, бета-галактозидазой или щелочной фосфатазой). После соединения антигена с меченной ферментом иммунной сывороткой в смесь добавляют субстрат/хромоген. Субстрат расщепляется ферментом и изменяется цвет продукта реакции — интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител.
ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики ВИЧ-инфекций, гепатита В и др., а также определения гормонов, ферментов, лекарственных препаратов и других биологически активных веществ, содержащихся в исследуемом материале в минорных концентрациях (1010-1012 г/л).
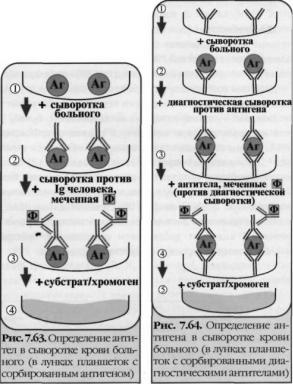
Твердофазный ИФА — вариант теста, когда один из компонентов иммунной реакции (антиген или антитело) сорбирован на твердом носителе, напр., в лунках планшеток из полистирола. Компоненты выявляют добавлением меченых антител или антигенов. При положительном результате изменяется цвет хромогена. Каждый раз после добавления очередного компонента из лунок удаляют несвязавшиеся реагенты путем промывания,
I. При определении антител (левый рисунок) в лунки планшеток с сорбированным антигеном последовательно добавляют сыворотку крови больного, антиглобулиновую сыворотку, меченную ферментом, и субстрат/хромоген для фермента.
II. При определении антигена (правый рисунок) в лунки с сорбированными антителами вносят антиген (напр., сыворотку крови с искомым антигеном), добавляют диагностическую сыворотку против него и вторичные антитела (против диагностической сыворотки), меченные ферментом, а затем субстрат/хромоген для фермента.
Конкурентный ИФА для определения антигенов: искомый антиген и меченный ферментом антиген конкурируют друг с другом за связывание ограниченного количества антител иммунной сыворотки.
Другой тест - Конкурентный ИФА для определения антител: искомые антитела и меченные ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе.
Иммуноблоттинг — высокочувствительный метод выявления белков, основанный на сочетании электрофореза и ИФА или РИА. Иммуноблоттинг используют как диагностический метод при ВИЧ-инфекции и др.
Антигены возбудителя разделяют с помощью электрофореза в полиакриламидном геле, затем переносят их из геля на активированную бумагу или нитроцеллюлозную мембрану и проявляют с помощью ИФА. Фирмы выпускают такие полоски с «блотами» антигенов. На эти полоски наносят сыворотку больного. Затем, после инкубации, отмывают от несвязавшихся антител больного и наносят сыворотку против иммуноглобулинов человека, меченную ферментом. Образовавшийся на
полоске комплекс [антиген + антитело больного + антитело против Ig человека] выявляют добавлением хромогенного субстрата, изменяющего окраску под действием фермента.
57. Серологические реакции используемые для диагностики вирусных инфекций
Иммунные реакции используют при диагностических и иммунологических исследованиях у больных и здоровых людей. С этой целью применяютсерологические методы, т. е. методы изучения антител и антигенов с помощью реакций антиген—антитело, определяемых в сыворотке крови и других жидкостях, а также тканях организма. Обнаружение в сыворотке крови больного антител против антигенов возбудителя позволяет поставить диагноз болезни. Серологические исследования применяют также для идентификации антигенов микробов, различных биологически активных веществ, групп крови, тканевых и опухолевых антигенов, иммунных комплексов, рецепторов клеток и др. При выделении микроба от больного проводят идентификацию возбудителя путем изучения его антигенных свойств с помощью иммунных диагностических сывороток, т. е. сывороток крови гипериммунизированных животных, содержащих специфические антитела. Это так называемаясерологическая идентификация микроорганизмов.
В микробиологии и иммунологии широко применяются реакции агглютинации, преципитации, нейтрализации, реакции с участием комплемента, с использованием меченых антител и антигенов (радиоиммунологический, иммуноферментный, иммунофлюоресцентный методы). Перечисленные реакции различаются по регистрируемому эффекту и технике постановки, однако, все они основаны на реакции взаимодействия антигена с антителом и применяются для выявления как антител, так и антигенов. Реакции иммунитета характеризуются высокой чувствительностью и специфичностью.
Особенности взаимодействия антитела с антигеном являются основой диагностических реакций в лабораториях. Реакция invitroмежду антигеном и антителом состоит из специфической и неспецифической фазы. В специфическую фазу происходит быстрое специфическое связывание активного центра антитела с детерминантой антигена. Затем наступает неспецифическая фаза — более медленная, которая проявляется видимыми физическими явлениями, например образованием хлопьев (феномен агглютинации) или преципитата в виде помутнения. Эта фаза требует наличия определенных условий (электролитов, оптимального рН среды). Связывание детерминанты антигена (эпитопа) с активным центром Fab-фрагмента антител обусловлено ван-дер-ваальсовыми силами, водородными связями и гидрофобным взаимо-
действием. Прочность и количество связавшегося антигена антителами зависят от аффинности, авидности антител и их валентности.
Схема практического использования серологических реакций
Иммунологическая реакция (Аг + Ат = ИК)
1.ИР, основанные на прямом взаимодействии антигена с антителом (РА – реакция агглютинации, РП, РГА – реакция гемагглютинации и др.);
2.ИР, основанные на опосредованном взаимодействии антигена с антителом (РПГА – реакция пассивной гемагглютинации, КоАг, РСК и др.);
3.ИР с использованием меченных антител или антигенов (РИФ – реакция иммунной флюоресценции, ИФА – иммуноферментный анализ и др.), в качестве меток можно использовать ферменты, изотопы, флюорохромы.
58.Вакцины. Определение. Современная классификация вакцин. Требования, предъявляемые к вакцинным препаратам.
Вакцина – от слова «вакка» - корова - Иммунобиологические препараты, применяемые для создания активной специфической невосприимчивости организма к определенному возбудителю.
Принципы получения вакцинных штаммов
Разработаны Л.Пастером
Селекция спонтанных мутантов с пониженной вирулентностью и сохраненной иммуногенностью путем культивирования в определенных условиях;
Пассивирование через организм животных, устойчивых к данной инфекции.
Классификация вакцин
По назначению:
1.Профилактические;
2.Лечебные;
По природе иммуногенов вакцины:
1.Бактериальные;
2.Вирусные;
3.Риккетсиозные;
4.Антитоксические;
По количеству компонентов:
1.Моновакцины;
2.Поливакцины;
По способу приготовления:
1.Вакцины 1 поколения; (цельномикробные, цельновирионные): живые, убитые
2.Вакцины второго поколения; (химические) (анатоксины)
3.Вакцины 3 поколения; (генно-инженерные вакцины): биосинтетические, векторные
4.Ассоциированные.( это комбинированные вакцины)
5.Вакцины 4 поколения (Синтетические пептидные; Антиидиотипические; Плазмидные; Вакцины содержащие компоненты комплекса гистосовместимости (МНС); Растительные.)
Требования, предъявляемые к современным вакцинам:
Иммуногенность;
Низкая аллергенность;
Не должны обладать тератогенностью, онкогенностью;
Штаммы, из которых приготовлена вакцина, должны быть генетически стабильны;
Длительный срок хранения;
Технологичность производства;
Простота и доступность в применении.
59. Вакцинопрофилактика. Вакцины из живых бактерий и вирусов. Принципы получения вакцинных штаммов. Способы аттенуации. Примеры вакцин из живых бактерий и вирусов. Преимущества и недостатки аттенуированных вакцин.
Иммунопрофилактика – способ предупреждения инфекционных заболеваний путем создания искусственного специфического иммунитета. Выделяют вакцинопрофилактику и серопрофилактику.
Принципы получения вакцинных штаммов
Разработаны Л.Пастером
Селекция спонтанных мутантов с пониженной вирулентностью и сохраненной иммуногенностью путем культивирования в определенных условиях;
Пассивирование через организм животных, устойчивых к данной инфекции.
Действующие начало любой вакцины – антиген иммуноген. В зависимости от природы возбудителя вакцины подразделяются:
Первое поколение вакцин – цельномикробные, цельновирионные
I.Живые:
Дивергентные – содержат микроорганизмы находящиеся в близком родстве с возбудителями инфекционных заболеваний и обладающие перекрестной иммуногенностью.
1.БЦЖ – против туберкулеза.
2.Ротовирусная.
3.Оспенная (вирус коровьего бешенства).
4.Аттенуированные (ослабленные) вакцины:
Очень опасные и заразные:
Чумная;
Туляремийная;
Сибиреязвенная;
Бруцеллезная (2 вида);
Против вирусов:
Паратитная;
Коревая;
Краснушная;
Гриппозная живая, сухая, интраназальная, детская;
Полимиелитная пероральная типов 1,2 и 3 из штаммов Сэбина (ОПР);
Герпетическая;
Аденовирусная;
Вакцины против
Сыпно-тифозная;
Вакцина желтой лихорадки;
Вакцина лихорадки Ку.
Преимущества живых вакцин:
1.По механизму действия они напоминают дикие штаммы и вытесняют последние из организма;
2.Формируют эффективный гуморальный и клеточный иммунитет, так как размножаются и циркулируют в организме;
3.Легко проводить вакцинацию, так как необходимы небольшие дозы и требуется только однократная вакцинация.
Недостатки:
1.Содержат до 99% балласта – реактогенны (много побочных действий);
2.Способны вызывать мутации клеток организма;
3.Содержат вирусы-загрязнители;
4.Трудно дозируются, требуют особых условий хранения;
5.Есть возможность возвращения в вирулентную форму.
!!!Живые вакцины не ставят людям с иммунодефицитами!!!
Между введениями живых вакцин рекомендован интервал не менее 1 месяца, в противном случае возможны тяжелые побочные реакции, иммунный ответ может быть пониженным.
Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий.
Аттенуация (ослабление) возможна путѐм воздействия на штамм химических (мутагены) и физических (температура) факторов или посредством длительных пассажей через невосприимчивый организм. Так же в качестве живых вакцин используются дивергентные штаммы (непатогенные для человека), имеющие общие протективные антигены с патогенными для человека микробами. Примером такой вакцины является БЦЖ и вакцина против натуральной оспы.
