
mikra
.pdf4.Определение состава и характеристик тканей человека (например: групп крови, резусфактор трансплантационных антигенов);
5.Выявление конкретного иммунного дефекта и подбор способа иммунокоррекции;
6.Изучение эффективности иммунокорректирующей терапии и прогнозирование течения иммунного заболевания;
Актуальность темы:
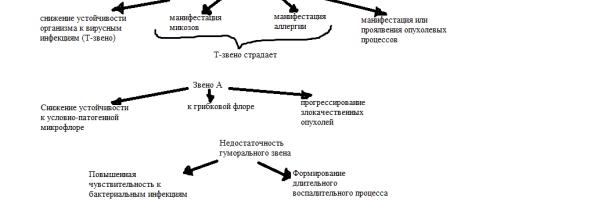
Установлено, что в патогенезе огромного числа болезней принимают участие иммунные механизмы.
Клиническая иммунология базируется на достижениях фундаментальной иммунологии, и может применяться в областях медицины, где лабораторный компонент является неотъемлемой частью.
Иммунный статус человека определяется совокупностью показателей неспецифической и специфической защиты, и характеризует индивидуальную реактивность организма.
Иммунная реактивность организма различна не только у разных людей, она изменяется и у одного и того же человека в разные периоды жизни.
На состояние иммунной системы влияют:
1.Климатолографические факторы;
2.Социальные факторы (питание, жилищно-бытовые условия, профессиональные вредности);
3.Производственные факторы (ионизирующая радиация, температура, шум);
4.Медицинские факторы (диагностические и лечебные процедуры, лекарственная терапия, травматические операционные вмешательства);
45. Оценка иммунного статуса: основные показатели и методы их определения.
Оценка иммунного статуса имеет значение для выявления иммунной недостаточности, для определения показаний и выбора терапевтических средств, для наблюдения за эффективностью иммуномодулирующей или депрессивной терапии.
Несмотря на вариабельность нормативных показателей, иммунный статус можно оценить комплексом лабораторных исследований.
Лабораторные исследования проводятся в несколько этапов:
1.Этап – клинико-лабораторный:
Сбор и оценка иммунологического анализа: частота инфекционных заболеваний, характер их течения, выраженность температурной реакции, наличие очагов хронической инфекции, реакции на вакцинации или введение лекарственных средств;
Оценка результатов общего клинического анализа крови: содержание гранулоцитов, моноцитов, лимфоцитов, т.е лейкоцитарной формулы;
Выявление бактерионосительства и вирусоносительства с помощью бактериологических и вирусологических серологических исследований;
2.Этап – лабораторно-иммунологический – постановка иммунных тестов в системе in vitro с целью оценки факторов:
Неспецифической защиты;
Субсистема А;
Гуморальная защита – субсистема В;
Клеточная защита – субсистема Т;
Все существующие в настоящее время лабораторные тесты разделены на тесты I и II уровня.
Тесты I уровня – ориентировочные. На этом уровне выявляются грубыенарушения деятельности иммунной системы.
1.Определение факторов естественной резистентности, БАСК, лизоцим, комплемент и др.
2.Оценка фагоцитарной активности лейкоцитов;
3.Подсчет относительного и абсолютного числа лимфоцитов;
4.Подсчет количества Ig разных классов;
Тесты II уровня ставят в зависимости от того, какие данные были получены в тестах I уровня. Это аналитические тесты – на этом уровне проводится более глубокий анализ состояния иммунной системы.
1.Определение субпопуляций Т-лимфоцитов;
2.Определение функциональной активности Т- и В-лимфоцитов;
3.Определение медиаторов иммунной системы;
4.Тесты на гиперчувствительность замедленного типа (ГЗТ);
Правила оценки иммунограммы
1)Комплексный анализ более информативен, чем оценка каждого показателя в отдельности;
2)Полноценный клинический анализ иммунограммы можно проводить лишь в комплексе с оценкой клинической картины и данных анализа;
3)Реальную информацию об изменениях в иммунограмме неуст лишь сильные сдвиги показателей;
4)Анализ иммунограммы в динамике более информативен как в диагностике, так и в прогнозе течения заболеваний;
5)Для диагностической и прогностической оценки имеют значение индивидуальные особенности, такие как возраст, сопутствующие заболевания или хронические;
6)Первостепенное практическое значение имеет соотношение показателей, а не их абсолютное значение;
7)При оценке иммунограммы следует исключить возможность колебаний показателей в зависимости от времени суток, приема пищи и даже страха;
46. Первичные и вторичные иммунодефициты.
Иммунодефицит – это снижение иммунитета, или полное отсутствие иммунного ответа в результате нарушения какого-либо звена иммунитета. Например, уменьшение или нарушение образования иммунных клеток на уровне стволовых клеток, нарушение какого-либо звена иммунитета, либо на разрушение активности зрелых клеток.
Первичный иммунодефицит – врожденный.
В качестве первичных иммунодефицитов выделяют такие состояния, при которых нарушение иммунных гуморальных и клеточных механизмов связано с генетическим блоком, т. е. генетически обусловлено неспособностью организма реализовывать то или иное звено иммунологической реактивности. Расстройства иммунной системы могут затрагивать как основные специфические звенья в функционировании иммунной системы, так и факторы, определяющие неспецифическую резистентность. Возможны комбинированные и селективные варианты иммунных расстройств. В зависимости от уровня и характера нарушений различают гуморальные, клеточные и комбинированные иммунодефициты.
Врожденные иммунодефицитные синдромы и заболевания представляют собой довольно редкое явление. Причинами врожденных иммунодефицитов могут быть удвоение хромосом, точечные мутации, дефект ферментов обмена нуклеиновых кислот, генетически обусловленные нарушения мембран, повреждения генома в эмбриональном периоде и др. Как правило, первичные иммунодефицита проявляются на ранних этапах постнатального периода и наследуются по аутосомнорецессивному типу. Проявляться первичные иммунодефициты могут в виде недостаточности фагоцитоза, системы комплемента, гуморального иммунитета (В-системы), клеточного иммунитета (Т-системы) или же в виде комбинированной иммунологической недостаточности.
Вторичный иммунодефицит – иммунодепрессия – обусловлена воздействием на иммунную систему угнетающих факторов, тормозящих деления предшественников иммунных клеток.
Вторичные иммунодефициты в отличие от первичных развиваются у лиц с нормально функционировавшей от рождения иммунной системой. Они формируются под воздействи ем окружающей среды на уровне фенотипа и обусловлены нарушением функции иммунной системы в результате различных заболеваний или неблагоприятных воздействий на организм. При вторичных иммунодефицитах могут поражаться Т- и В-системы иммунитета, факторы неспецифической резистентности, возможны также их сочетания. Вторичные иммунодефициты встречаются значительно чаще, чем первичные. Вторичные иммунодефицита, как правило, преходящи и поддаются иммунокоррекции, т. е. восстановлению нормальной деятельности иммунной системы.
Известно разделение вторичных иммунодефицитов на:
Физиологические, новорожденные, пубертатного периода, беременности и лактации, старения, биоритмичности, экологические, сезонные, эндогенные интоксикации, радиационные, СВЧ, патологические, постинфекционные, стрессовые, регуляторнометаболические, медикаментозные, онкологические.
Факторы:
ионизирующее излучение;
циклические углеводороды (бензол, толуол и т.д);
соли тяжелых металлов (Cu, Pb);
лекарственные препараты (антибиотики, нестероидные противовоспалительные, цитостатики, галогены (Br, Cr, J);
факторы, угнетающие функции иммунных клеток (инсулин);
Причины вторичных иммунодефицитов:
1.Инфекции, при которых возбудители размножаются в клетки гемопоэтической системы;
2.Состояния, которые развиваются при нарушениях иммунитета в ходе перенесенных заболеваний;
3.Первичные или приобретенные метаболические или гормональные дефекты;
4. Применение супрессивной терапии при лечении опухолей;
Клинические проявления недостаточности иммунитета
Иммунодефициты, как первичные, так и особенно вторичные, широко распространены среди людей. Они являются причиной проявления многих болезней и патологических состояний, поэтому требуют профилактики и лечения с помощью иммунотропных препаратов.
47. Взаимодействие антигена с антителом in vitro. Теория сетевых структур.
Реакции между антигенами и антителами in vitro, имеющие диагностическое значение, называли серологическими (от лат. sеrum - сыворотка), так как источником антител служила сыворотка крови. Они используются для количественного и качественного определения антигенов и антител в исследуемом материале.
При постановке серологических реакций учитывают следующие условия: наличие изотонического раствора (электролита), реакция рН близкая к нейтральной и температура среды (от 20 до 37 ° С).
Серологические реакции применяются с целью решения следующих задач:
1. |
для |
выявления |
неизвестного |
антигена |
(микроорганизма, |
белка и |
т.д.). |
||
|
При этом используют диагностические иммунные антисыворотки, которые получают |
||||||||
|
путем многократной иммунизации лабораторных животных соответствующими |
||||||||
|
антигенами. |
|
|
|
|
|
|
|
|
2. |
для |
определения |
наличия |
и |
титра |
антител |
в |
сыворотке |
крови. |
|
Обнаружение антител проводят с использованием специальных антигенных |
||||||||
|
диагностикумов (взвеси эталонных инактивированных микроорганизмов). |
|
|||||||
Таким образом, в серологических реакциях один из двух основных компонентов (АГ или АТ) всегда должен быть известным.
Серологические реакции подразделяются на прямые и непрямые.
В прямых серологических реакциях участвуют только антигены и антитела. Результат прямых серологических реакций наблюдается непосредственно по изменению оптических свойств
раствора (образование хлопьев, помутнения, опалесценции). Это реакции агглютинации, преципитации.
В непрямых серологических реакциях для визуализации результата взаимодействия антигенов и антител используются индикаторные системы. Это РСК, РНГА, и т.д. р
Теория сетей. Необходимое условие образование сетей - наличие более трех антигенных детерминант на каждую молекулу антигена, и по два активных центра на каждую молекулу антитела. Молекулы антигена являются узлами решетки, а молекулы антител - связующими звеньями. Область оптимальных соотношений (зона эквивалентности) концентраций антигена и антител, когда в надосадочной жидкости после образования осадка не обнаруживаются ни свободные антигены, ни свободные антитела.
48. Реакция агглютинации. Компоненты, механизм, способы постановки. Применение.
Агглютинация - это склеивание и выпадение в осадок микробов или других клеток под действием антител в присутствии электролита (изотонического раствора хлорида натрия). Группы склеенных бактерий (клеток) называют агглютинатом. Для реакции агглютинации необходимы следующие компоненты:
1.Антитела (агглютинины), которые находятся в сыворотке больного или иммунного животного.
2.Антиген - взвесь живых или убитых микробов, эритроцитов или других клеток.
3.Изотонический (0,9%) раствор хлорида натрия.
Реакцию агглютинации для серодиагностики применяют при брюшном тифе и паратифах (реакция Видаля), при бруцеллезе (реакция Райта и Хеддлсона), туляремии и т.д. Антителом при этом является сыворотка больного, а антигеном известный микроб. При идентификации микробов или других клеток антигеном служит их взвесь, а антителом - известная иммунная сыворотка. Эту реакцию широко применяют для диагностики кишечных инфекций, коклюша и др.
Методы постановки РА
Ориентировочная РА на стекле
Развернутая РА
(объемный метод)
Реакция коагглютинации
Развернутая РА на стекле (сероидентификация)
Реакция агглютинации на стекле. На обезжиренное предметное стекло наносят две капли специфической (адсорбированной) сыворотки и каплю изотонического раствора хлорида натрия. Неадсорбированные сыворотки предварительно разводят в соотношении 1:5 - 1:100. Капли на стекло необходимо наносить так, чтобы между ними было расстояние. Культуру петлѐй или пипеткой тщательно растирают на стекле, а потом вносят в каплю изотонического, раствора хлорида натрия и в одну из капель сыворотки, размешивая в каждой до образования гомогенной взвеси. Капля сыворотки, в которую не внесена культура, является контролем сыворотки.
Внимание! Нельзя переносить культуру из сыворотки в каплю изотонического раствора хлорида натрия, которая является контролем антигена. Реакция протекает при комнатной температуре в течение 1-3 мин. Если контроль сыворотки остаѐтся прозрачным, в контроле антигена наблюдается равномерная муть, а в капле, где культура смешана с сывороткой, появляются хлопья агглютината на фоне прозрачной жидкости, результат реакции считается положительным.
«О» |
«К» |
Диагностическая Физиологический
сыворотка +культура |
раствор + культура |
Развѐрнутая реакция агглютинации (объемный метод). Готовят последовательные, чаще всего двукратные, разведения сыворотки. Метод называют объѐмным. Для определения титра антител в сыворотке крови возьмите 6 пробирок. В первую пробирку налейте 1 мл исходного разведения сыворотки 1:50 и во все 6 пробирок градуированной пипеткой внесите по 1 мл физиологического раствора. В первой пробирке получится разведение сыворотки 1:100 при объѐме 2 мл. Из первой пробирки 1 мл перенесите во вторую пробирку, где разведение станет 1:200. Так сделайте ряд последовательных разведений сыворотки в 5 первых пробирках (1:100, 1:200, 1:400, 1:800, 1:1600). Из пятой пробирки 1 мл вылейте в дезинфицирующий раствор. Во все 6 пробирок добавьте по 2 капли диагностикума. Шестая пробирка является контролем культуры, так как содержит только физиологический раствор и диагностикум.
Ингредиенты |
|
|
|
номер пробирки |
|
|
||
|
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
|
4 |
5 |
6 |
7 |
|
|
|
|
|
|
|
контроль |
контроль |
|
|
|
|
|
|
|
сыворотки |
диагности- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кума |
|
|
|
|
|
|
|
|
|
Физиологический |
1,0 |
1,0 |
1,0 |
|
1,0 |
1,0 |
1,0 |
1,0 |
раствор |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сыворотка больного в |
1,0 |
1,0 |
1,0 |
|
1,0 |
1,0 |
1,0 |
- |
разведении 1:50 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Диагностикум (капли) |
2 |
2 |
2 |
|
2 |
2 |
- |
2 |
|
|
|
|
|
|
|
|
|
Разведение сыворотки |
1:100 |
1:200 |
1:400 |
|
1:800 |
1:1600 |
1:100 |
- |
|
|
|
|
|
|
|
|
|
Такой контроль необходим для исключения спонтанной агглютинации культуры. Пробирки встряхивают и помещают в термостат при температуре 37°С на 2 часа, а затем оставляют на сутки при комнатной температуре, после чего производят учѐт результатов реакции агглютинации. При постановке реакции агглютинации с сыворотками детей первых месяцев жизни в связи с функциональной неполноценностью антителообразования необходимо выявление более низких титров антител, что учитывается при разведении сыворотки. Исходное разведение сыворотки берут 1:25. В первой пробирке получают разведение 1:50, затем 1:100 и т.д.
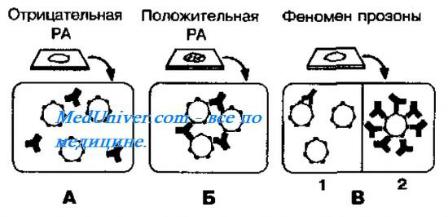
При положительном результате реакции в пробирках видны склеевшиеся клетки в виде зерен или хлопьев на фоне прозрачной жидкости. Агглютинат постепенно оседает на дно в виде «зонтика», а жидкость над осадком просветляется. Контроль антигена равномерно мутный.
По характеру осадка различают мелко- и крупнозернистую (хлопьевидную) агглютинацию. Мелкозернистая агглютинация получается при работе с О-сыворотками. Крупнозернистая - при взаимодействии подвижных микробов со жгутиковыми Н-сыворотками. Она наступает быстрее мелкозернистой, образующийся при этом осадок очень рыхлый и легко разбивается.
Интенсивность реакции выражается следующим образом:
++++ все клетки осели, жидкость в пробирке совершенно прозрачна. Результат реакции резко положительный;
+++ осадок меньше, нет полного просветления жидкости. Результат реакции положительный; ++ осадок еще меньше, жидкость мутнее. Результат реакции сомнительный;
на дне пробирки незначительный осадок, жидкость мутная. Сомнительный результат реакции;
- осадка нет, жидкость равномерно мутная, как в контроле антигена. Отрицательный результат реакции
Механизм
РА используют для:
1) определения антител в сыворотке крови больных, например, при бруцеллезе (реакции Райта, Хеддельсона), брюшном тифе и паратифах (реакция Видаля) и других инфекционных болезнях;
2) определения
возбудителя, выделенного от больного;
3) определения групп крови с использованием моноклональных антител против аллоантигенов эритроцитов.
49. Реакция Кумбса. Механизм. Компоненты. Применение.
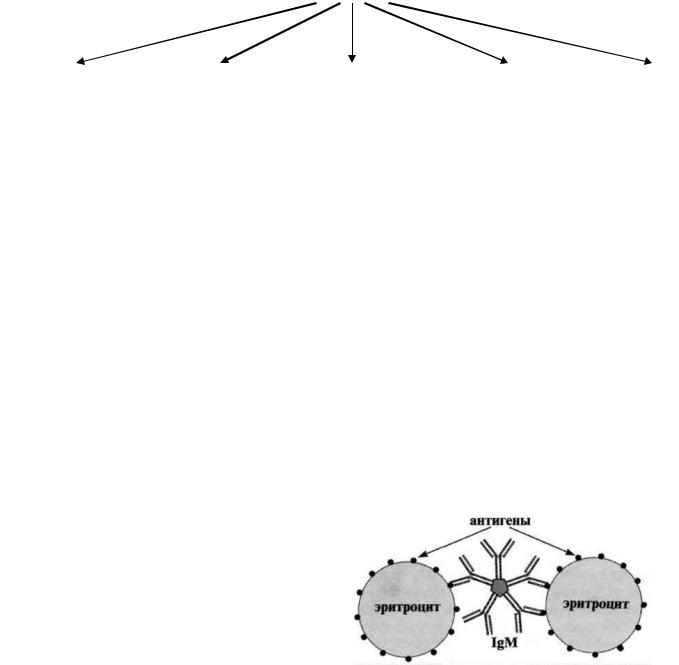
Антиглобулиновый тест, предназначенный для выявления неполных антиэритроцитарных антител, был предложен Кумбсом, Морантом, Рейс в 1945 г. и получил в дальнейшем название пробы Кумбса . Суть данного метода заключается в том, что антиглобулиновая сыворотка, содержащая антитела к иммуноглобулинам человека, при реакции с эритроцитами, сенсибилизированными неполными антителами, приводит к их агглютинации.
В зависимости от того, фиксированы ли антитела на поверхности эритроцитов или находятся в свободном состоянии в плазме крови, применяется прямая или непрямая проба Кумбса.
Прямая проба Кумбса ставится в тех случаях, когда есть основания предполагать, что исследуемые красные кровяные клетки уже in vivo подверглись сенсибилизации соответствующими антителами, т.е. первая фаза реакции — фиксация антител на поверхности эритроцитов — произошла в организме и последующее добавление антиглобулиновой сыворотки вызывает агглютинацию сенсибилизированных клеток.

С помощью непрямой пробы Кумбса выявляют неполные антитела, присутствующие в исследуемой сыворотке. В данном случае реакция протекает в два этапа. Первый этап — инкубация тест-эритроцитов с исследуемой сывороткой, во время которой происходит фиксация на эритроцитарной поверхности антител, содержащихся в исследуемом образце сыворотки. Второй этап — добавление антиглобулиновой сыворотки.
Механизм. Сложность выявления неполных (моновалентных) антител связана с тем, что эти антитела, связываясь с эпитопами специфического антигена, не образуют структуру решетки и реакция между антигенами и антителами не выявляется ни агглютинацией, ни преципитацией, ни другими тестами. Для выявления образовавшихся комплексов антиген — антитело приходится использовать дополнительные тест-системы. Для выявления неполных антител, например к резусантигену эритроцитов в сыворотке крови беременной женщины, реакция ставится в два этапа: 1) к двукратным разведениям испытуемой сыворотки добавляют эритроциты, содержащие резусантиген, и выдерживают при 37 °С в течение часа; 2) к тщательно отмытым после первого этапа эритроцитам добавляют кроличью античеловеческую анти-глобулиновую сыворотку (в заранее оттитрованном рабочем разведении). После инкубации в течение 30 мин при 37 °С результаты оценивают по наличию гемагглютинации (положительная реакция). Необходимо ставить контроль ингредиентов реакции: 1) антиглобулиновая сыворотка + заведомо сенсибилизированные специфическими антителами эритроциты; 2) обработанные нормальной сывороткой эритроциты + антиглобулиновая сыворотка; 3) обработанные исследуемой сывороткой резус-отрицательные эритроциты + антиглобулиновая сыворотка.
До настоящего времени проба Кумбса широко применяется в лабораторной практике для диагностики иммунопатологических состояний, в частности при аутоиммунных гемолитических анемиях, характеризующихся деструкцией эритроцитов вследствие связывания клеточной мембраны с антителами и (или) компонентами системы комплемента. С его помощью выявляют присутствие на эритроцитарной мембране Ig G (обычно Ig G1 и Ig G3), которые могут активировать комплемент, а иногда и комплемента (С3d). Однако в остром периоде заболевания в связи с разрушением эритроцитов, на которых фиксировалось большое количество антител, при гемолитическом кризе, а также при недостаточном количестве антител при хроническом течении болезни может отмечаться отрицательная прямая проба Кумбса [8, 18, 22, 2].
Необходимо подчеркнуть, что непрямая проба Кумбса остается наилучшим методом индивидуального подбора трансфузионных сред, так как позволяет наиболее точно установить индивидуальную совместимость донора и реципиента по эритроцитарным антигенам.
Дополнительное выполнение прямого антиглобулинового теста на наличие аутоантител рекомендуется при обследовании всех реципиентов органов и тканей в предтрансплантационном периоде и реципиентов гемопоэтических стволовых клеток также и после трансплантации [3].
Кроме иммуногематологии и трансфузиологии антиглобулиновые пробы широко применяются при диагностике целого ряда патологических состояний: при гематологических заболеваниях, включая лимфопролиферативные, при системных заболеваниях соединительной ткани, болезни Шегрена, хроническом активном гепатите и др.
Активно используются пробы Кумбса в медицинской генетике и судебной медицине для определения поверхностных эритроцитарных антигенов.
При некоторых патологических состояниях в организме синтезируются неполные антитела или антигены. Выявление этих неполных реагентов предложил Кумбс.
Реакция торможения гемагглютинации. Вирус + диагностическая сыворотка противогриппозная - (экспозиция + изотонический раствор хлорида натрия) - + эритроциты и нейтрализованный вирус.
50. Реакция пассивной гемагглютинации. Механизм. Компоненты. Применение.
Реакция непрямой (пассивной) гемагглютинации (РПГА, РНГА)
Методы постановки РНГА
РНГА с |
|
РНГА с |
|
Реакция латекс- |
|
Реакция |
|
РНГА с унитиолом |
эритроцитарным |
|
эритроцитарным |
|
агглютинации |
|
Кумбса |
|
(выявление IgM и |
антигенным |
|
антительным |
|
|
|
|
||
|
|
|
|
|
|
|||
диагностикумом |
|
диагностикумом |
|
|
|
|
|
IgG) |
|
|
|
|
|
|
|
|
|
Реакция непрямой (пассивной) гемагглютинации (РНГА, РПГА) основана на использовании эритроцитов с адсорбированными на их поверхности антигенами или антителами, взаимодействие которых с соответствующими антителами или антигенами больных вызывает склеивание и выпадение эритроцитов на дно пробирки или ячейки в виде фестончатого осадка (зонтика).
Компоненты. Для постановки РНГА могут быть использованы эритроциты барана, лошади, кролика, курицы, мыши, человека и другие, которые заготавливают впрок, обрабатывая формалином или глютаральдегидом. Адсорбционная емкость эритроцитов увеличивается при обработке их растворами танина или хлорида хрома.
Антигенами в РНГА могут служить полисахаридные АГ микроорганизмов, экстракты бактериальных вакцин, АГ вирусов и риккетсий, а также другие вещества.
Эритроциты, сенсибилизированные АГ, называются эритроцитарными диагностикумами. Для приготовления эритроцитарного диагностикума чаще всего используют эритроциты барана, обладающие высокой адсорбирующей активностью.
Применение. РНГА применяют для диагностики инфекционных болезней особенно у детей, при необходимости выявления антител в более низких титрах., определения гонадотропного гормона в моче при установлении беременности, для выявления повышенной чувствительности к лекарственным препаратам, гормонам и в некоторых других случаях. Эта реакция может быть использована и для обнаружения антигенов при применении специфических сывороток
Механизм. Реакция непрямой гемагглютинации (РНГА) отличается значительно более высокой чувствительностью и специфичностью, чем реакция агглютинации. В лунках пластмассовых пластин готовят последовательные разведения исследуемого материала. Затем в каждую лунку вносят одинаковый объем 3 % суспензии на-
груженных антителами эритроцитов. При необходимости реакцию ставят параллельно в
нескольких рядах лунок с эритроцитами, нагруженными антителами разной групповой специфичности.
Через 2 ч инкубации при 37 °С учитывают результаты, оценивая внешний вид осадка эритроцитов (без встряхивания): при отрицательной реакции появляется осадок в виде компактного.диска или кольца (пуговки) на дне лунки, при положительной реакции — характерный кружевной осадок эритроцитов, тонкая пленка с неровными краями.
51. Реакция торможения гемагглютинации. Механизм. Компоненты. Применение.
Реакция торможения гемагглютинации (РТГА) - метод идентификации вируса или выявления
противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови.
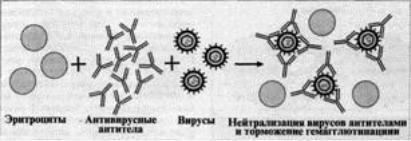
Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении антигенов вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты.
РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных.
Механизм. Типирование вируса проводят в реакции торможения гемаг-глютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса А с антигенами H0N1, H1N1, Н2N2, H3N2 и др. могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток.
№ 52 Реакция преципитации. Механизм. Компоненты. Способы постановки. Применение.
Реакция преципитации (РП) - это формирование и осаждение комплекса растворимого молекулярного антигена с антителами в виде помутнения (преципитата). Он образуется при смешивании антигенов и антител в равных количествах; избыток одного из них снижает уровень образования иммунного комплекса.
РП ставят в тех случаях, когда приходится пользоваться растворимыми антигенами: лизатами, экстрактами, гаптенами. При взаимодействии такого антигена с антителом в присутствии электролитов (изотонический раствор хлорида натрия) образуется преципитат в виде мутного «кольца» или осадка.
Применение: РП обычно применяют для определения Аг при диагностике ряда инфекций (сибирская язва, менингит, пневмония и др.); в судебной медицине - для определения видовой принадлежности крови, спермы и т. д.; в санитарно-гигиенических исследованиях - при установлении фальсификации продуктов; с ее помощью определяют филогенетическое родство животных и растений.
Для этой реакции необходимы следующие компоненты.
1. А н т и т е л а (преципитины) - иммунная сыворотка с высоким титром антител (не ниже 1:100000). Титр преципитирующей сыворотки устанавливают по наибольшему разведению антигена, с которым она дает реакцию. Сыворотку обычно применяют неразведенной или в разведении 1:5-1:10.
