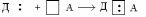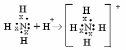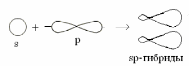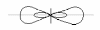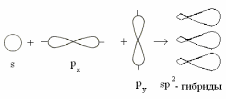- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Способы образования ковалентной связи
Обменный механизм. Ковалентная связь образуется парой одиночных электронов с антипараллельными спинами, принадлежащих двум взаимодействующим атомам: НCl и NH3
|
s |
p |
|
|
d |
|
|
|
|
|
|
|
s |
p |
|
|
Cl 3 |
↑↓ |
↑↓ |
↑↓ |
↑ |
|
|
|
|
|
|
N |
2 |
↑↓ |
↑ |
↑ |
↑ |
![]()
-
Н 1
↓
1
↓
↓
↓
s
s
s
s
Н
Н
Н
Таким образом, ковалентность (число ковалентных связей) атомов в этих соединениях определяется числом неспаренных электронов на последнем электронном уровне атома в невозбужденном состоянии.
Однако известны и другие случаи.
Например,
-
s
p
2
↑↓
↑
↑
С
1
↑↓
В невозбужденном состоянии атом углерода может образовать две ковалентные связи. Но для углерода более типичны соединения, где он образует 4 связи: CO2, CH4 и др. Этот процесс возможен в результате возбуждения атома углерода:
-
s
p
2
↑
↑
↑
↑
С*
1
↑↓
Теперь на внешнем электронном уровне атома углерода 4 неспаренных электрона и он может участвовать в образовании 4-х ковалентных связей, при этом выделяется большое количество энергии, которое значительно перекрывает расход энергии на перевод атома в возбужденное состояние. Распаривание электронов происходит только в пределах одного электронного уровня. Энергетически невыгоден переход электрона из одного уровня в другой, поэтому у кислорода и фтора строение внешнего электронного уровня одинаково в нормальном и возбужденном состояниях:
|
s |
p |
|
|
|
s |
p |
|
|
|
2 |
↑↓ |
↑↓ |
↑ |
↑ |
2 |
↑↓ |
↑↓ |
↑↓ |
↑ |
|
O 1 |
↑↓ |
F 1 |
↑↓ |
|
|
|||||
У этих элементов нет свободных орбиталей во втором электронном слое и электроны не могут распариться при возбуждении, поэтому они проявляют постоянную ковалентность, равную 2 и 1 соответственно. Атомы элементов третьего и последующих периодов имеют свободный или незавершенный d-подуровень, на который при возбуждении могут переходить s- и р-электроны внешнего слоя, вследствие чего здесь появляются дополнительные возможности образования неспаренных электронов.
-
s
p
d
Cl 3
↑↓
↑↓
↑↓
↑
Cl* 3
↑↓
↑↓
↑
↑
↑
При возбуждении хлора у него появляется 3, 5 и 7 неспаренных электронов и возможность к образованию такого же числа ковалентных связей.
Из приведенных примеров ясно, что число ковалентных связей элемента определяется числом неспаренных электронов не только в нормальном, но и в возбужденном состоянии.
Донорно-акцепторный механизм. Нередко валентность элемента превосходит число неспаренных электронов в его атомах. Происходит это потому, что есть другой механизм образования ковалентной связи, заключающийся в том, что один атом отдает неподеленную электронную пару, а партнер предоставляет свободную орбиталь. Первый называется донором (Д), второй – акцептором (А). Ковалентную связь, образующуюся по такому механизму, называют донорно-акцепторной и в ее образовании участвуют атомы, находящиеся в возбужденном состоянии. Схематически образование донорно-акцепторной связи может быть представлено следующим образом:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
s
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Рассмотрим химическое строение молекулы СО (С=О)
|
s |
p |
|
|
С 2 |
↑↓ |
↑ |
↑ |
|
|
||||
О 2 |
↑↓ |
↓ |
↓ |
↑↓ |
Между этими элементами возникает две ковалентные связи (=) и одна донорно-акцепторная (←), где О – донор, а С – акцептор (С=←О).
Если учесть, что число связей элемента определяет его валентность, то в этом соединении С и О – трехвалентны.
Существуют два способа перекрывания электронных облаков при образовании ковалентной связи: сигма (σ) и пи (π).
Сигма (σ)-связь образуется при перекрывании s-s, s-p, p-p орбиталей взаимодействующих атомов, при этом область перекрывания (максимальная электронная плотность) находится на линии, соединяющей центры атомов:
H-H |
H-Cl |
Cl-Cl |
s s |
s p |
p p |
Рис. 2.1. Схемы образования σ-связи
Пи (π)-связь образуется при перекрывании p-p, p-d, d-d орбиталей взаимодействующих атомов, при этом получаются две области перекрывания, расположенные по обе стороны от оси связи:
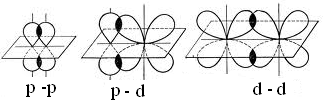
Рис.2.2. Схемы образования π-связи
Одинарная связь - всегда σ, а кратные связи представляют собой сочетание σ и π связей: двойная связь - σ + π, тройная связь - σ + π + π. σ-Связь является более прочной, чем π-связь, т.к. у нее большая область перекрывания АО.
π С = О σ |
|
Рис. 2.3. Схема образования двойной связи на примере молекулы СО
Экспериментально было обнаружено, что энергия связи, угол между связями в молекуле отличаются от теоретически рассчитанных значений. Чтобы объяснить такое расхождение экспериментальных фактов с теорией, необходимо учитывать, что наиболее устойчивому состоянию молекулы отвечает такая ее геометрическая структура и такое расположение пространственных электронных облаков, которому соответствует наименьший запас энергии. Это приводит к тому, что атомные электронные облака в молекуле перестраиваются, т.е. гибридизуются.
Гибридизация - это смешение электронных облаков,сопровождающееся изменением их формы, направленности в пространстве. Число гибридных орбиталей равно суммарному числу гибридизующихся орбиталей (табл. 2.4).
Рассмотрим более типичные случаи гибридизации различных орбиталей, участвующих в образовании химических связей.
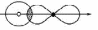
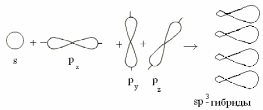
sp-гибридизация. Данный тип гибридизации наблюдается при образовании атомом двух связей, за счет одного s- и одного р- электронов (рис. 2.4).
|
|
Рис. 2.4. Схема sp-гибридизации
Таблица 2.4
Гибридизация атомных орбиталей
Тип |
Определение |
Форма молекулы |
Валентный угол |
Пример |
sp |
Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые орбитали |
Линейная |
1800 |
СH≡CH, ВеCl2 |
sp2 |
Одна s-орбиталь и две p-орбитали превращаются в три одинаковые орбитали |
Плоская тригональная |
1200 |
H2C=CH2, ВCl3 |
sp3 |
Одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые орбитали |
Тетрагональная
|
109,50 |
H3C-CH3, CH4, РCl3, SiH4, NH3, H2O |
sp3d |
Одна s-орбиталь, три p-орбитали и одна d-орбиталь |
бипирамидальная |
900 и 1200 |
PF5 |
sp3d2 |
Одна s-орбиталь, три p-орбитали и две d-орбитали |
октаэдрическая |
900 |
SF6, SbCl6¯ |
Например, в молекуле MgCl2 образуются две равнозначные σ-связи, в которых участвуют две sр- гибридных орбитали
s p E s p
Mg 3 |
↑↓ |
|
|
|
→ |
Mg * 3 |
↑ |
↑ |
|
|
Гибридные электронные облака располагаются в пространстве на одной прямой под углом 1800, что дает возможность осуществиться одинаковому полному перекрыванию их с электронными облаками хлора. Это обеспечивает линейное строение молекулы MgCl2 (рис. 2.5).
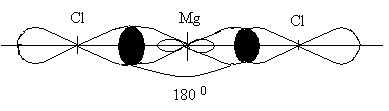
Рис. 2.5. Схема строения молекулы MgCl2
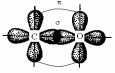
sp2-гибридизация. В этом случае происходит смешение трех валентных орбиталей: одной s типа и двух р типа. Три sp2-гибридных орбитали располагаются в пространстве под углом 1200 в одной плоскости (рис. 2.3).
|
|
Рис. 2.6. Схема sр2-гибридизации
Например, в молекуле AlCl3 образуются три равнозначные σ-связи, в которых участвуют три sр2 – гибридных орбитали алюминия:
s p E s p
Al 3 |
↑↓ |
↑ |
|
|
→ |
Al * 3 |
↑ |
↑ |
↑ |
|
Три sp2- гибридных электронных облака атома алюминия, перекрываясь с р-электронными облаками хлора, образуют устойчивую плоскую тригональную молекулу (рис. 2.7).
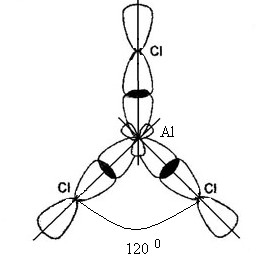
Рис. 2.7. Схема строения молекулы AlCl3
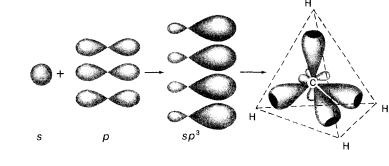
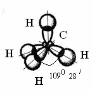
sp3-гибридизация. В гибридизации участвуют одна s- и три р-орбитали, в результате образуются четыре sp3- гибридных орбитали, ориентированных в пространстве к вершинам тетраэдра под углом 109028/ (рис. 2.8).
Рис. 2.8. Схема sр3-гибридизации |
|
Такую гибридизацию можно рассмотреть на примере молекулы метана.
s p E s p
C 2 |
↑↓ |
↑ |
↑ |
|
→ |
C * 2 |
↑ |
↑ |
↑ |
↑ |
|
|
|
|
|||||||||||
Рис. 2.9. Схема строения молекулы СН4
Соответствующее строение имеют и другие молекулы с такой гибридизацией атомных орбиталей.
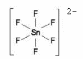
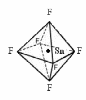
У элементов третьего и последующего периодов в образовании гибридных электронных орбиталей могут участвовать и d-орбитали. Особенно важен случай sp3d2-гибридизации, когда образуется 6 гибридных орбиталей, вытянутых к вершинам октаэдра (рис. 2.10).
[SnF6]2-
|
октаэдр |
Рис. 2.10. Схема строения координационного иона [SnF6]2-
В гибридизации могут участвовать атомные орбитали, занятые одним непарным электроном, двумя спаренными электронами или свободные орбитали. Это можно рассмотреть на примере молекулы воды (рис. 2.11).
Н2О
s p
s s H H |
|
Рис. 2.11. Схема строения молекулы Н2О
Здесь две σ-связи образуют угол, определяемый направлением р-орбиталей кислорода в пространстве. Однако угол между связями не 90°, а 104,5°, который близок к тетраэдрическому. Объяснить это можно явлением гибридизации электронных орбиталей, которое приводит к образованию более энергетически выгодных структур, т.е. более прочных связей. При образовании молекулы воды наблюдается sp3-гибридизация, в которой принимают участие четыре орбитали кислорода: две р-орбитали, на каждой из которых расположено по одному электрону, и s- и р-орбитали, на которых по два спаренных электрона. Некоторые расхождения в величине угла связаны с неравноценным состоянием электронных облаков, окружающих атом кислорода в молекуле воды.
Кроме рассмотренных теорий химической связи, существуют и более сложные, которые дают возможность расширить представления о природе химической связи, например, метод молекулярных орбиталей (ММО). ММО объясняет существование прочного молекулярного иона водорода (Н2+), парамагнетизм кислорода, дробную кратность связи и др., что невозможно объяснить с помощью метода валентных связей. В данном пособии рассмотрена более простая, но достаточно информационная теория МВС.
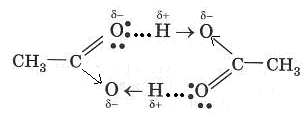
Водородная связь (внутри- или межмолекулярная) возникает за счет положительно поляризованного атома водорода, связанного с сильно электроотрицательным атомом, например, фтором, кислородом, серой, азотом.
Возникновение водородной связи можно объяснить в первом приближении действием электростатических сил, но в окончательном варианте эта связь ближе всего к донорно-акцепторному взаимодействию. Энергия водородной связи 8 - 40 кДж/моль, что значительно слабее ковалентной связи (для сравнения - энергия ковалентной связи 150 - 400 кДж/моль), поэтому ее обозначают пунктиром или точками:
Н+-F- + Н+-F-→ Н+-F-∙∙∙ Н+-F-∙∙∙ Н+-F-
H-O-H+ H-O-H→ H-O-H∙∙∙O-H∙∙∙O-H и т.д.
| |
Н Н
Этой энергии достаточно, чтобы вызвать ассоциацию молекул, что служит причиной аномально высоких температур кипения и плавления различных веществ. Например, водородные соединения подгруппы кислорода H2S, H2Se, H2Te в обычных условиях газы, вода - жидкость с достаточно высокой температурой кипения (1000 С).
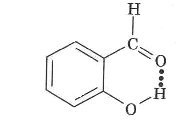
Особенно большое значение водородные связи имеют для органических соединений (спирты, кислоты, белки, нуклеиновые кислоты и др.). В них встречаются межмолекулярные и внутримолекулярные водородные связи:
раствор спирта в воде:
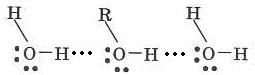
димеры уксусной кислоты (СН3СООН)2:
3) внутримолекулярная водородная связь в молекуле о-гидроксибензальдегида: