
- •15.03.04 «Автоматизация технологических процессов и производств» и
- •27.03.02 «Управление качеством» подготовки бакалавров Составитель г.Ю. Вострикова
- •Рецензенты:
- •Оглавление
- •Введение
- •Раздел 1. Основные химические понятия и стехиометрические законы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Раздел 2. Квантово-механические представления
- •Основные теоретические положения
- •47 Ag 1s22s22p63s23p64s23d104p65s24d9 - неправильно,
- •47 Ag 1s22s22p63s23p64s23d104p65s14d10- правильно,
- •2.2. Химическая связь и строение молекул Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Способы образования ковалентной связи
- •Решение типовых задач
- •Вопросы для семинарского занятия
- •2.3. Окислительно-восстановительные реакции Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Примерный вариант самостоятельной работы
- •Раздел 3. Общие закономерности химических процессов
- •3.1. Энергетика химических процессов
- •Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •3.2. Химическая кинетика и равновесие Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 5, § 5.5; гл. 6, § 6.1; гл. 7, §§ 7.1 – 7.3]; [2 – гл.VI, §§ 57 – 61, 63]. Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 4. Растворы. Дисперсные системы
- •4.1. Способы выражения количественного состава растворов Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 4, § 4.1]; [2 – гл. VII, §§ 73, 74]. Основные теоретические положения
- •Основные способы выражения концентрации
- •Решение типовых задач
- •0,5 Моль/л.
- •4.2. Общие свойства растворов Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Решение типовых задач
- •4.4. Водородный показатель рН. Гидролиз солей Содержание материала для самостоятельного изучения
- •Литература: [1 – гл. 8, §§ 8.5, 8.6]; [2 – гл.VII, §§ 90 – 92]. Основные теоретические положения
- •Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
- •Из уравнения диссоциации следует, что
- •Задачи для самостоятельного решения
- •Объясните, написав уравнения реакций в молекулярной и ионно-молекулярной форме.
- •Вопросы для семинарского занятия
- •4.5. Гетерогенные дисперсные системы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Молекулы пав обозначают следующим символом:
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Тема 5. Электрохимические системы
- •5.1. Электродные потенциалы и электродвижущие силы Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •Решение типовых задач
- •5.2. Электролиз Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •5.3. Коррозия и защита металлов от коррозии Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Вопросы для семинарского занятия
- •Раздел 6. Технология и переработка полимеров
- •6.1. Методы получения, строение и свойства полимеров Содержание материала для самостоятельного изучения
- •Основные теоретические положения
- •Решение типовых задач
- •6.2. Переработка полимерных материалов Содержание материала для самостоятельного изучения
- •Некоторые представители композиционных материалов, применяемых в строительстве
- •Задачи для самостоятельного решения
- •Заключение
- •Библиографический список Основной
- •Дополнительный
- •15.03.04 «Автоматизация технологических процессов и производств»
- •3 94006 Воронеж, ул. 20-летия Октября, 84
Решение типовых задач Задача 1. Вычислите рН раствора гидроксида кальция с молярной концентрацией 0,005 моль/л, считая диссоциацию Са(он)2 полной.
Решение. рН = – lg [H+]. Гидроксид кальция при диссоциации образует ионы кальция и гидроксид-ионы: Ca(OH)2 Ca2+ + 2OH‾. Концентрация ионов ОН– связана с концентрацией ионов Н+ ионным произведением воды: [H+] · [OH‾] = 10‾14. Отсюда [H+] = 10‾14 / [OH‾].
Из уравнения диссоциации следует, что
[OH‾] = 2 [Ca(OH)2] = 2 · 0,005 = 0,01 моль/л.
[H+] = 10‾14/0,01 = 10–12 моль/л; рН = – lg 10‾12 = 12.
Задача 2. Водородный показатель раствора азотистой кислоты рН = 3, степень диссоциации α = 0,01. Вычислите молярную концентрацию кислоты в растворе (сM).
Решение. Так как водородный показатель рН = - lg [H+], то
[H+] = 10–pH = 10– 3 моль/л. Из уравнения диссоциации азотистой кислоты
HNO2 H+ + NO2‾, следует, что [H+] = [HNO2]диссоц = 10‾3. Из выражения
α = [HNO2]диссоц / [HNO2]общ следует:
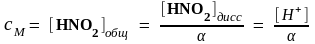 ,
,
 моль/л.
моль/л.
Задача 3. Какие из приведенных солей – FeSO4, Na2SO3, КCl – подвергаются гидролизу? Составьте молекулярные и молекулярно-ионные уравнения гидролиза солей. Какую реакцию среды имеют эти растворы?
Решение. Соль FeSO4 образована двухзарядным ионом Fe2+ слабого двухкислотного основания Fe(OH)2 и ионом SO42‾ сильной кислоты H2SO4. Гидролиз такой соли протекает в две ступени. По первой ступени ионы Fe2+ связывают гидроксид-ионы OH– воды в малодиссоциирующий ион FeOH+, при этом ионы Н+ накапливаются, и раствор приобретает кислую реакцию, т.е. рН < 7.
2FeSO4 + 2HOH (FeOH)2SO4 + H2SO4,
2Fe2+ + 2SO42‾ + 2HOH 2FeOH+ + SO4 2‾+2H+ + SO42‾,
Fe2+ + HOH FeOH+ + H+.
Гидролиз в обычных условиях протекает, главным образом, по первой ступени. Разбавление раствора и повышение температуры усиливает гидролиз и обусловливает его вторую ступень:
(FeOH)2SO4 + 2HOH 2Fe(OH)2 + H2SO4,
2FeOH+ + SO4 2‾ + 2HOH 2Fe(OH)2 + 2H+ + SO42‾,
FeOH+ + HOH Fe(OH)2 + H+.
Na2SO3 образована сильным основанием NaOH и слабой двухосновной кислотой H2SO3. Гидролиз обусловливают двухзарядные ионы SO32–. Гидролиз практически ограничивается первой ступенью:
Na2SO3 + НОН NaOH + NaНSO3,
2Na+ + SO32‾ + НОН Na+ + OH‾ + Na+ + НSO3‾,
SO32‾ + HOH OH‾ + НSO3 –.
При разбавлении и повышении температуры возможен гидролиз по II ступени, которая выражается уравнениями:
NaНSO3 + НОН NaOH + H2SO3,
Na+ + НSO3‾ + НОН Na+ + OH‾ + H2SO3,
НSO3‾ + НОН OH‾ + H2SO3.
Ионы SO32‾ связывают ионы Н+ в малодиссоциирующие ионы, при этом гидроксид-ионы накапливаются в растворе, и его среда ставится щелочной, т.е. рН >7.
Соль KCl образована сильным основанием KOH и сильной кислотой НCl. Ионы K+ не могут связать гидроксид-ионы, а ионы Cl‾ не могут связать ионы H+ воды. Эта соль гидролизу не подвергается. Реакция раствора нейтральная, т.е. рН = 7.
Задачи для самостоятельного решения
1. Какие вещества относят к электролитам и в чём суть электролитической диссоциации? Между растворами каких веществ возможно химическое взаимодействие?
1) HCl + KOH → ; 2) Fe SO4 + KOH → ; 3) Na2SO4 + KOH → .
Ответ подтвердите, написав уравнения в молекулярной и ионно-молекулярной форме.
2. Составьте уравнения электролитической диссоциации веществ Н3РО4, Са(NO3)2 и NН4ОН. Для слабых электролитов напишите выражение констант диссоциации. Какой электролит является наиболее слабым?
3. Составьте молекулярные уравнения реакций, которым соответствуют следующие сокращенные ионно-молекулярные уравнения:
1) Cr(OH)3 + 3Н+ Cr3+ + Н2О; 2) Cu2+ + 2ОН‾ → Cu(OH)2;
3) Н+ + NО2‾ → НNО2.
Перечислите условия протекания реакций двойного обмена.
4. Какое из оснований Ni(ОН)2, Mg(OH)2, Fe(OH)2 является наиболее слабым электролитом? Ответ поясните, написав уравнения их электролитической диссоциации и выражения для констант диссоциации.
5. Какие вещества – Аl(OH)3, H2SO4, Na2SO4 – будут взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями.
6. Что характеризует водородный показатель, и какие значения он может принимать? Приведите шкалу рН. Раствор гидроксида кальция имеет рН = 12, чему равна его концентрация в растворе при 100 %-ной диссоциации (α = 1)? Ответа подтвердите расчетом.
7. Какие соли подвергаются гидролизу, а какие не подвергаются? Какая соль из приведенных ниже не подвергающаяся гидролизу:
1) СrCl3 ; 2) (NH4 )2SO3; 3) Na2SO4 ; 4) Na3PO4?
